ABC-model van bloemontwikkeling
Het ABC-model van bloemontwikkeling is een wetenschappelijk model van het proces waarbij de generatieve meristemen van planten een patroon van genexpressie hebben, dat leidt tot het verschijnen van een orgaan dat gericht is op seksuele voortplanting: een bloem. Er zijn drie fysiologische ontwikkelingen die moeten plaatsvinden om dit te laten plaatsvinden. Ten eerste moet het meristeem van de plant overgaan van vegetatief naar generatief onder invloed van bijvoorbeeld koude (vernalisatie) of daglengte (korte- en langedagplanten)of een bepaald aantal bladeren of een bepaald niveau aan totale biomassa hebben. Plantenhormonen spelen een belangrijke rol in het proces, waarbij de gibberellines een bijzonder belangrijke rol spelen.[1] Ten slotte de vorming van de individuele delen van de bloem: de kelkbladen, kroonbladen, meeldraden en stamper. De laatste fase is gemodelleerd met behulp van het ABC-model, dat tot doel heeft de biologische basis van het proces te beschrijven vanuit het perspectief van de moleculaire genetica en ontwikkelingsgenetica. Het generatievemeristeem is "bepaald", wat betekent dat de cellen, eenmaal gedifferentieerd, zich niet langer zullen delen dit in tegenstelling tot een vegetatief meristeem.
Overgang van vegetatief naar generatief[bewerken | brontekst bewerken]
De overgang van de vegetatieve fase naar een reproductieve fase brengt een grote verandering met zich mee in de vitale cyclus van de plant, misschien wel de belangrijkste, omdat het proces correct moet worden uitgevoerd om te garanderen dat de plant nakomelingen produceert. Deze overgang wordt gekenmerkt door de inductie en ontwikkeling van het bloemmeristeem, waardoor een verzameling bloemen in een bloeiwijze of één bloem ontstaat.
Er zijn veel signalen die de moleculaire biologie van het proces reguleren. De volgende drie genen in zandraket (Arabidopsis thaliana) bezitten zowel gemeenschappelijke als onafhankelijke functies bij de bloemtransitie: FLOWERING LOCUS T (FT), LEAFY (LFY), SUPPRESSOR OF OVEREXPRESSION OF CONSTANS1 (SOC1, ook wel AGAMOUS-LIKE20 genoemd).[2] SOC1 is een gen van het MADS-box-type, dat reacties op fotoperiode, vernalisatie en gibberellines integreert.[1]
Vorming van het bloemmeristeem[bewerken | brontekst bewerken]
Het onderhoud en ontwikkeling van zowel het vegetatieve als het generatieve meristeem wordt gecontroleerd door genetische mechanismen. Een aantal genen zal bijvoorbeeld rechtstreeks het behoud van de eigenschappen van de meristeemcel reguleren (homeobox-gen WUSCHEL of WUS), terwijl andere via negatieve terugkoppelingsmechanismen de expressie van een eigenschap zal onderdrukken (gen CLAVATA of CLV). Op deze manier ontstaat door beide mechanismen een terugkoppelingslus, die samen met andere elementen het systeem veel robuustheid geeft.[3] Samen met het WUS-gen onderdrukt het SHOOTMERISTEMLESS (STM)-gen ook de differentiatie van het topmeristeem. Dit gen remt de differentiatie van de meristeemcellen, maar maakt nog steeds celdeling in de dochtercellen mogelijk, wat, als ze hadden kunnen differentiëren, tot verschillende organen zou hebben geleid.[4]
Bouw bloeiwijze[bewerken | brontekst bewerken]
De anatomie van een bloem bestaat uit een reeks organen (kelkbladen, bloembladen, meeldraden en stampers) die volgens een bepaald patroon zijn gepositioneerd ten behoeve van de generatieve voortplanting bij bloeiende planten. De bloem komt voort uit de activiteit van drie klassen genen, die de bloemontwikkeling reguleren:
- Meristeemidentiteitsgenen, die coderen voor de transcriptiefactoren die nodig zijn om de inductie van de identiteitsgenen te initiëren. Ze zijn positieve regulatoren van de orgaanidentiteit tijdens de bloemontwikkeling.
- Orgaanidentiteitsgenen, die rechtstreeks de orgaanidentiteit controleren en ook coderen voor transcriptiefactoren die de expressie van andere genen controleren, waarvan de producten betrokken zijn bij de vorming of functie van de verschillende organen van de bloem.
- Kadastergenen, die fungeren als ruimtelijke regulatoren voor de orgaanidentiteitsgenen door grenzen te definiëren voor hun expressie. Op deze manier controleren ze de mate waarin genen op elkaar inwerken en regelen ze daarmee of ze tegelijkertijd op dezelfde plek werken.
Het ABC-model van de bloemontwikkeling[bewerken | brontekst bewerken]

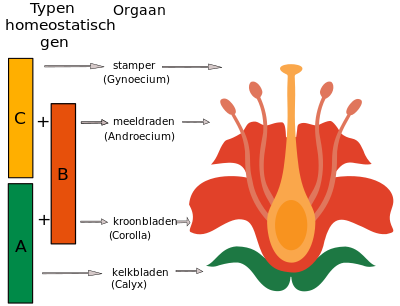
Het ABC-model van de bloemontwikkeling werd voor het eerst geformuleerd door George Haughn en Chris Somerville in 1988. Het werd voor het eerst gebruikt als model om de verzameling genetische mechanismen te beschrijven die de identiteit van bloemorganen vaststellen bij de Rosids, zoals geïllustreerd door de zandraket (Arabidopsis thaliana) en de Asterids, zoals geïllustreerd door de grote leeuwenbek (Antirrhinum majus). Beide soorten hebben vier kransen (kelkbladen, bloembladen, meeldraden en stamper), die worden gedefinieerd door de differentiële expressie van een aantal homeotische genen die in elke krans aanwezig zijn. Dit betekent dat de kelkbladen uitsluitend worden gekenmerkt door de expressie van A-genen, terwijl de bloembladen worden gekenmerkt door de co-expressie van A- en B-genen. De B- en C-genen bepalen de identiteit van de meeldraden en de vruchtbladen vereisen alleen dat C-genen actief zijn. Type A- en C-genen zijn wederzijds antagonistisch.[5]
Het feit dat deze homeotische genen de identiteit van een orgaan bepalen, wordt duidelijk wanneer een gen dat een bepaalde functie vertegenwoordigt, bijvoorbeeld het A-gen, niet tot expressie komt. Bij zandraket resulteert dit niet tot expressie komen in een bloem die bestaat uit één krans van vruchtbladen, een andere met meeldraden en weer een andere uit vruchtbladen. Deze methode voor het bestuderen van de genfunctie maakt gebruik van reverse genetics-technieken om transgene planten te produceren die een mechanisme bevatten voor het uitschakelen van genen door RNA-interferentie. In andere onderzoeken, waarbij gebruik wordt gemaakt van forward genetics-technieken zoals genmapping, is het de analyse van de fenotypen van bloemen met structurele afwijkingen die leidt tot het klonen van het gen in kwestie. De bloemen kunnen een niet-functioneel of overmatig tot expressie gebracht allel bezitten voor het gen dat wordt bestudeerd.[6]
Het bestaan van twee aanvullende functies, D en E, is ook voorgesteld naast de reeds besproken functies A, B en C. Functie D specificeert de identiteit van de zaadknop, als een afzonderlijke reproductieve functie van de ontwikkeling van de vruchtbladen, die plaatsvindt na hun bepaling. Functie E heeft betrekking op een fysiologische behoefte die kenmerkend is voor alle bloemknopen, hoewel deze aanvankelijk werd beschreven als noodzakelijk voor de ontwikkeling van de drie binnenste knopen (Functie E sensu stricto). De bredere definitie (sensu lato) suggereert echter dat dit vereist is in de vier hoekpunten. Daarom, wanneer Functie D verloren gaat, wordt de structuur van de zaadknoppen vergelijkbaar met die van de bladeren en wanneer Functie E sensu stricto verloren gaat, worden de bloemorganen van de drie buitenste kransen getransformeerd in kelkblaadjes, terwijl bij het verliezen van Functie E sensu lato alle kransen op bladeren lijken. De genproducten van genen met D- en E-functies zijn ook MADS-box-genen.
Genetische analyse[bewerken | brontekst bewerken]
De methodologie voor het bestuderen van de bloemontwikkeling bestaat uit twee stappen. Ten eerste de identificatie van de exacte genen die nodig zijn voor het bepalen van de identiteit van het bloemenmeristeem. Bij A. thaliana omvatten deze APETALA1 (AP1) en LEAFY (LFY). Ten tweede wordt genetische analyse uitgevoerd op de afwijkende fenotypen voor de verwante kenmerken van de bloemen, wat de karakterisering van de homeotische genen mogelijk maakt, die bij het proces betrokken zijn.
Analyse van mutanten[bewerken | brontekst bewerken]

Er zijn een groot aantal mutaties die de bloemmorfologie beïnvloeden, hoewel de analyse van deze mutanten een recente ontwikkeling is. Ondersteunend bewijs voor het bestaan van deze mutaties komt voort uit het feit dat een groot aantal de identiteit van bloemorganen beïnvloedt. Sommige organen ontwikkelen zich bijvoorbeeld op een plek waar andere zich zouden moeten ontwikkelen. Dit wordt homeotische mutatie genoemd, wat analoog is aan HOX-genmutaties gevonden in Drosophila. Bij Arabidopsis en Antirrhinum, de twee taxa waarop de modellen zijn gebaseerd, hebben deze mutaties altijd invloed op aangrenzende kransen. Dit maakt de karakterisering mogelijk van drie klassen van mutaties, volgens welke kransen worden aangetast:
- Mutaties in type A-genen – Deze mutaties beïnvloeden de kelk en bloemkroon, de buitenste kransen. In deze mutanten, zoals APETALA2 in A. thaliana, ontwikkelen zich vruchtbladen in plaats van kelkbladen en meeldraden in plaats van bloembladen. Dit betekent dat de kransen van de bloemkroon worden omgezet in reproductieve kransen.
- Mutaties in type B-genen – Deze mutaties beïnvloeden de bloemkroon en de meeldraden, de tussenliggende kransen. Er zijn twee mutaties gevonden in A. thaliana, APETALA3 en PISTILLATA, die de ontwikkeling van kelkbladen veroorzaken in plaats van bloembladen en vruchtbladen op de plaats van de meeldraden.
- Mutaties in type C-genen – Deze mutaties beïnvloeden de reproductieve kransen, namelijk de meeldraden en de vruchtbladen. De A. thaliana-mutant van dit type wordt AGAMOUS genoemd en bezit een fenotype dat bloembladen bevat in plaats van meeldraden en kelkbladen in plaats van vruchtbladen.
Technieken voor het vasstellen van differentiële expressie[bewerken | brontekst bewerken]
Er zijn kloonstudies uitgevoerd op DNA in de genen die geassocieerd zijn met de getroffen homeotische functies in de hierboven besproken mutanten. Deze onderzoeken maakten gebruik van seriële analyse van genexpressie tijdens de bloemontwikkeling om patronen van weefselexpressie aan te tonen, die in het algemeen overeenkomen met de voorspellingen van het ABC-model.
De aard van deze genen komt overeen met die van transcriptiefactoren, die, zoals verwacht, structuren hebben die analoog zijn aan een groep factoren in gisten en dierlijke cellen. Deze groep wordt MADS-box genoemd, wat een acroniem is voor de verschillende factoren in de groep. Deze MADS-boxfactoren zijn bij alle onderzochte groentesoorten aangetroffen, hoewel de betrokkenheid van andere elementen die betrokken zijn bij de regulatie van genexpressie niet kan worden uitgesloten.[7]
Genen met type-A-functie[bewerken | brontekst bewerken]
In zandraket berust de A-functie hoofdzakelijk op de twee genen APETALA1 (AP1) en APETALA2 (AP2). AP1 is een gen van het MADS-box-type, terwijl AP2 behoort tot de familie van genen die AP2 bevat, waar zijn naam vandaan komt en die bestaat uit transcriptiefactoren die alleen in planten voorkomen.[17] Er is ook aangetoond dat AP2 een complex vormt met de co-repressor TOPLESS (TPL) bij het ontwikkelen van bloemknoppen om het C-klasse gen AGAMOUS (AG) te onderdrukken. AP2 komt echter niet tot expressie in het topmeristeem (SAM), dat de latente meristeemcelpopulatie gedurende het volwassen leven van zandraket bevat. Daarom wordt gespeculeerd dat TPL samenwerkt met een ander A-klasse gen in het topmeristeem om AG te onderdrukken. AP1 functioneert als een type A-gen, zowel bij het controleren van de identiteit van kelk- en bloembladen, als bij het bloemmeristeem. AP2 functioneert niet alleen in de eerste twee kransen, maar ook in de overige twee, in de ontwikkeling van eicellen en zelfs in bladeren. Het is ook waarschijnlijk dat er post-transcriptionele regulatie bestaat, die de A-functie ervan controleert, of zelfs dat het andere doeleinden heeft bij het bepalen van de orgaanidentiteit, onafhankelijk van de hier genoemde.
Genen met type-B-functie[bewerken | brontekst bewerken]
In zandraket berust de B-functie hoofdzakelijk op de twee genen, APETALA3 (AP3) en PISTILLATA (PI), die beide MADS-box-genen zijn. Een mutatie van een van deze genen veroorzaakt de homeotische omzetting van bloemblaadjes in kelkbladen en van meeldraden in vruchtbladen.[8] Dit komt ook voor in de homologen van de grote leeuwenbek, respectievelijk DEFICIENS (DEF) en GLOBOSA (GLO).[9] Voor beide soorten is de actieve vorm van binding met DNA de afgeleide van het heterodimeer: AP3 en PI, of DEF en GLO.[10]
De GLO/PI-lijnen die in Petunia zijn gedupliceerd, bevatten Petunia × atkinsiana GLOBOSA1 (PhGLO1, ook wel FBP1 genoemd) en ook PhGLO2 (ook wel PMADS2 of FBP3 genoemd). Voor de functionele elementen equivalent aan AP3/DEF in Petunia is er zowel een gen dat een relatief vergelijkbare sequentie bezit, genaamd PhDEF en er is ook een atypisch B-functiegen genaamd PhTM6. Fylogenetische studies hebben de eerste drie binnen de euAP3-lijn geplaatst, terwijl PhTM6 tot die van paleoAP3 behoort.[11] In termen van de evolutionaire geschiedenis lijkt het verschijnen van de euAP3-lijn verband te houden met de opkomst van tweezaadlobbigen, aangezien vertegenwoordigers van euAP3-type B-functiegenen aanwezig zijn in tweezaadlobbigen, terwijl paleoAP3-genen aanwezig zijn in eenzaadlobbigen en onder andere in basale bedektzadigen.[12]
 bloemdiagram van een tulp |
Bloemformule van de tulp: * K3 C3 A6 G(3) of of * Ca3 Co3 A6 G(3) |
 tulp van boven |

Zoals hierboven besproken, zijn de bloemorganen van de 'nieuwe' tweezaadlobbigen gerangschikt in vier verschillende kransen, die de kelkbladen, bloembladen, meeldraden en vruchtbladen bevatten. Het ABC-model stelt dat de identiteit van deze organen wordt bepaald door respectievelijk de homeotische genen A, A+B, B+C en C. In tegenstelling tot de kelkblad- en bloembladkransen van de 'nieuwe' tweezaadlobbigen, heeft het bloemdek van veel planten van de familie Liliaceae twee vrijwel identieke petaloïde-kransen (de tepalen). Om de bloemmorfologie van de Liliaceae te verklaren, stelden van Tunen et al. in 1993 een aangepast ABC-model voor. Dit model suggereert dat klasse B-genen niet alleen tot expressie komen in de kransen 2 en 3, maar ook in 1. Hieruit volgt dat de organen van de kransen 1 en 2 klasse A- en B-genen tot expressie brengen, waardoor ze een bloembladachtige structuur hebben. Dit theoretische model is experimenteel bewezen door het klonen en karakteriseren van homologen van de Antirrhinum-genen GLOBOSA en DEFICIENS in een Liliaceae, de tulp Tulipa gesneriana.[13] Deze genen komen tot expressie in de kransen 1, 2 en 3. De homologen GLOBOSA en DEFICIENS zijn ook geïsoleerd en gekarakteriseerd in Agapanthus praecox ssp. orientalis (Agapanthaceae), die fylogenetisch ver verwijderd is van de modelorganismen. In deze studie werden de genen respectievelijk ApGLO en ApDEF genoemd. Beide bevatten open leesramen die coderen voor eiwitten met 210 tot 214 aminozuren. Fylogenetische analyse van deze sequenties gaf aan dat ze behoren tot de B-genfamilie van de eenzaadlobbigen. Uit in situ hybridisatiestudies bleek dat beide sequenties zowel in de krans 1 als in de kransen 2 en 3 tot expressie komen. Wanneer ze samen worden genomen, laten deze waarnemingen zien dat het bloemenontwikkelingsmechanisme van Agapanthus ook het gemodificeerde ABC-model volgt.[14]
Genen met type-C-functie[bewerken | brontekst bewerken]
In zandraket is de C-functie afgeleid van een MADS-box-type gen genaamd AGAMOUS (AG), dat zowel betrokken is bij het vaststellen van de identiteit van de meeldraden en de vruchtbladen als bij de bepaling van het bloemenmeristeem.[15] Daarom hebben de AG-mutanten geen androecium en gynoecium en hebben ze in hun plaats bloembladen en kelkbladen. Bovendien is de groei in het midden van de bloem ongedifferentieerd, daarom groeien de bloembladen en kelkbladen in herhalende kransen.
Het PLENA (PLE)-gen is aanwezig in de gewone leeuwenbek, in plaats van het AG-gen, hoewel het geen homoloog is. Het FARINELLI (FAR)-gen is echter wel een homoloog, die specifiek is voor de ontwikkeling van de helmknoppen en de rijping van stuifmeel.[16]
Bij Petunia, Antirrhinum en bij maïs wordt de C-functie aangestuurd door een aantal genen die op dezelfde manier werken. De genen die nauwere homologen zijn van AG in Petunia zijn pMADS3 en het bloemenbindend eiwit 6 (FBP6 = Floral Binding Protein6).[16]
Genen met type-D- en E-functies[bewerken | brontekst bewerken]
De D-functiegenen werden ontdekt in 1995. Deze genen zijn MADS-box-eiwitten en ze hebben een functie die verschilt van de eerder beschreven genen, hoewel ze een zekere homologie hebben met C-functiegenen. Deze genen worden FLORAL BINDING PROTEIN7 (FBP7) en FLORAL BINDING PROTEIN1L (FBP1L) genoemd.[17] Het bleek dat ze bij Petunia betrokken zijn bij de ontwikkeling van de zaadknop. Vergelijkbare genen werden later gevonden in Arabidopsis,[18] waar ze ook betrokken zijn bij de ontwikkeling van vruchtbladen en de eicel en zelfs bij structuren die verband houden met de zaadverspreiding.
Het verschijnen van interessante fenotypes in RNA-interferentiestudies bij Petunia en tomaat leidde in 1994 tot de definiëring van een nieuw type functie in het bloemontwikkelingsmodel. Aanvankelijk werd gedacht dat de E-functie alleen betrokken was bij de ontwikkeling van de drie binnenste kransen, maar uit later onderzoek bleek dat de expressie ervan in alle bloemkransen een vereiste was.[19]
Bronnen, noten en/of referenties
|
