Antimoon(III)jodide
| Antimoon(III)jodide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
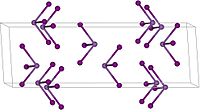
Kristalrooster van
| ||||

| ||||
Molecuulmodel van
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Antimoon(III)jodide | |||
| Andere namen | Antimoontrijodide, Trijoodstibaan | |||
| Molmassa | 502,473 g/mol | |||
| SMILES | [SbH3+3].[I-].[I-].[I-]
| |||
| CAS-nummer | 7790-44-5 | |||
| EG-nummer | 232-205-8 | |||
| PubChem | 24630 | |||
| Wikidata | Q2505731 | |||
| Beschrijving | Rode kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302+H332 - H317 - H411 | |||
| P-zinnen | P273 - P280 - P301+P312+P330 - P302+P352 - P304+P340+P312 | |||
| EG-Index-nummer | 232-205-8 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 4,921 g/cm³ | |||
| Smeltpunt | 170,5 °C | |||
| Kookpunt | 401,6 °C | |||
| Oplosbaarheid in water | Oplosbaar,hydrlyseert langzaam | |||
| Goed oplosbaar in | Benzeen, Alcohol, Aceton, Koolstofdisulfide, Zoutzuur, Kaliumjodide, tin(IV)chloride, Dimethylamine, HI, alkalimetaaltriiodides[2] | |||
| Slecht oplosbaar in | Chloroform, Tetrachloormethaan[2] | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 1,58 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
-100.4 kJ/mol | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||

|
| Kristallijn Antimoon(III)iodide |

|
| Fijngemalen |
Antimoon(III)jodide is een anorganische verbinding met de formule . Deze robijnrode vaste stof is de enige verbinding van enkel antimoon en jood die bekend is. Antimoon heeft hier oxidatiegetal +3. Zoals bij meer jodides van de zwaardere hoofdgroepmetalen is de structuur afhankelijk van de fase van de stof. In de gasfase is een moleculaire stof met een driezijdige piramide als structuur zoals voorspeld door VSEPR. In de vaste fase echter is het antimoon-atoom omgeven door een octahedron van zes jood-atomen, drie relatief dichterbij, drie wat verder weg.[3] In de verwante bismutverbinding bevinden de jood-atomen zich allemaal op de zelfde afstand.[4]
Synthese[bewerken | brontekst bewerken]
Antimoon(III)jodide kan direct uit de elementen gemaakt worden. Een tweede manier wordt gevormd door de reactie tussen antimoon(III)oxide en waterstofjodide. Daarnaast is ook de reactie tussen de elementen in kokende benzeen of tetra een optie.
| 1 | : | |
| 2 | : | |
| 3 | : |
Eigenschappen[bewerken | brontekst bewerken]
In water en aan de lucht (waterdamp) wordt antimoon(III)jodide omgezet in antimoon(III)oxidojodide:[5]
Toepassingen[bewerken | brontekst bewerken]
SbI3 is toegepast als doteerstof in de vorming van thermo-elektrisch materiaal.[6]
| Bronnen, noten en/of referenties
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Antimony triiodide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
|







![{\displaystyle {\ce {S2Sb\ +\ 3I2\ ->[{\ce {kokend\ C6H6\ of\ CCl4}}]\ 2SbI3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c057a7e4a1356eed4fab3443ada6adb10e82fd1b)
