Benzofenon
| Benzofenon | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
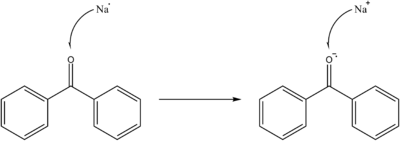
Structuurformule van benzofenon
| ||||
| ||||
Molecuulmodel van benzofenon
| ||||
| Algemeen | ||||
| Molecuulformule | C13H10O | |||
| IUPAC-naam | benzofenon | |||
| Andere namen | difenylmethanon, difenylketon, benzoylbenzeen | |||
| Molmassa | 182,217 g/mol | |||
| SMILES | O=C(C2=CC=CC=C2)C1=CC=CC=C1
| |||
| CAS-nummer | 119-61-9 | |||
| Wikidata | Q409482 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,11 g/cm³ | |||
| Smeltpunt | 47,9 °C | |||
| Kookpunt | 305,4 °C | |||
| Goed oplosbaar in | benzeen, THF, ethanol, propyleenglycol | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Benzofenon is een organische verbinding met als brutoformule C13H10O. Gesubstitueerde benzofenonen zoals oxybenzon en dioxybenzon worden gebruikt in zonnebrandcrème.
Synthese[bewerken | brontekst bewerken]
Benzofenon kan gemaakt worden uit de reactie van benzeen met tetrachloormethaan gevolgd door hydrolyse van het gevormde difenyldichloormethaan,[1] of door Friedel-Craftsacylering van benzeen met benzoylchloride in aanwezigheid van een lewiszure katalysator (bijvoorbeeld aluminiumchloride).
Toepassingen[bewerken | brontekst bewerken]
Benzofenon kan gebruikt worden in producten als parfums en zepen om te voorkomen dat UV-licht de geur en kleuren aantast. Het kan ook aan plastic verpakkingsmateriaal toegevoegd worden als UV-blokker. Hierdoor kunnen producten in helder glas of plastic verpakt worden in plaats van in ondoorzichtig materiaal.
In laboratoria worden oplosmiddelen vaak gedestilleerd met natrium en benzofenon als droogmiddel. Het product van deze twee chemicaliën in de afwezigheid van zuurstof en water is een donkerblauw ketyl. Een oplossing van dit ketyl kan gebruikt worden als kwalitatieve test voor de afwezigheid van zuurstof en water.
Eigenschappen[bewerken | brontekst bewerken]
Benzofenon is een bekende fotosensitizer in fotochemie. Het kruist van de S1-toestand naar de triplettoestand in vrijwel 100%. Het resulterende diradicaal neemt een waterstof op van een waterstofdonor om een ketylradicaal te vormen.
Radicaalanion[bewerken | brontekst bewerken]
Natrium wordt vaak gebruikt als droogmiddel om oplosmiddelen te drogen door in een reactie met water het hydroxide te vormen, wat een vaste stof is.
Het nadeel van het gebruik van natrium als droogmiddel (onder het smeltpunt) is de lage reactiesnelheid tussen een vaste stof en een vloeistof. Als het droogmiddel echter oplosbaar is, is de droogsnelheid veel hoger. Benzofenon wordt vaak gebruikt om een oplosbaar droogmiddel te vormen. Een voordeel van dit gebruik is de intens blauwe kleur van het ketylradicaalanion. Natrium-benzofenon kan dus gebruikt worden als indicator van een zuurstof- en watervrije omgeving in de destillatie van oplosmiddelen.[2][3]
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|