Koper(I)jodide
| Koper(I)jodide | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
Koper(I)jodide
| |||||
| Algemeen | |||||
| Molecuulformule | CuI | ||||
| IUPAC-naam | koper(I)jodide | ||||
| Andere namen | cuprojodide | ||||
| Molmassa | 190,45 g/mol | ||||
| CAS-nummer | 7681-65-4 | ||||
| PubChem | 6432705 | ||||
| Wikidata | Q411207 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H315 - H317 - H318 - H335 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P280 - P301+P312+P330 - P305+P351+P338 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 5,67[1] g/cm³ | ||||
| Smeltpunt | 606 °C | ||||
| Kookpunt | (ontleedt) 1290 °C | ||||
| Goed oplosbaar in | 3,5 M KI | ||||
| Slecht oplosbaar in | water | ||||
| Brekingsindex | 2,346 | ||||
| Evenwichtsconstante(n) | KS[2]=1 × 10−12 | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Koper(I)jodide is de anorganische verbinding met als brutoformule CuI. De verbinding werd vroeger aangeduid als cuproiodide. De stof wordt voor een grote verscheidenheid van doelen ingezet, variërend van de organische synthese tot regen maken.
Koper(I)jodide is wit, maar vaak is de stof verontreinigd, en dan is de kleur groen of roodbruin, zoals in het natuurlijk voorkomende mineraal marshiet.[3] Voor jodiden is verkleuren vrij normaal, vanwege het gemak waarmee jodide wordt geoxideerd tot elementair jood.
Structuur
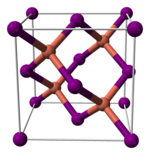
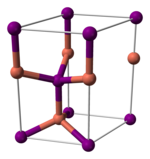
[bewerken | brontekst bewerken]Koper(I)jodide vormt, zoals de meeste binaire (er komen maar twee elementen in de verbinding voor) metaalhalogeniden, een anorganisch polymeer. Het fasediagram van koper(I)jodide vertoont diverse kristallijne vormen. Onder 390 °C heeft de stof een zinkblende structuur (γ-CuI), tussen 390 en 440 °C wurtzietstructuur (β-CuI). Boven 440 °C wordt een steenzout structuur (α-CuI) gevonden. In de zinkblende- en wurtziet-structuur zijn de ionen tetraëdrisch omgeven met een Cu-I-afstand van 233,8 pm. Ook koper(I)bromide en koper(I)chloride vertonen de overgang van de zinkblende-structuur naar de wurtziet-structuur bij resp. 405 en 435 °C. De conclusie daaruit is dat naarmate de koper-halogeenbinding langer wordt, de overgangstemperatuur daalt. De interatomaire afstanden zijn voor het bromide en het chloride 217,3 en 205,1 pm respectievelijk.[4]
 |
 |
 |
Synthese
[bewerken | brontekst bewerken]Koper(I)jodide kan bereid worden door koper en jood in geconcentreerd waterstofjodide te verhitten. In het laboratorium wordt koper(I)jodide meestal bereid door het eenvoudig mengen van een waterige oplossing van natriumjodide of kaliumjodide en een oplosbaar koper(II)zout, meestal koper(II)sulfaat.
Het gevormde CuI2 ontleed direct in di-jood en onoplosbaar koper(I)jodide.[5]
De reactie is toegepast om het gehalte koper te bepalen, omdat het gevormde I2 titrimetrisch in een redoxtitratie bepaald kan worden.
De reactie zal in eerste instantie vreemd lijken. Het toepassen van de vuistregel uit de redoxreacties, er treedt reactie op als Eooxidator – Eoreductor > 0, gaat hier niet op. Het verschil is kleiner dan nul, dus zou de reactie niet mogen verlopen. De evenwichtsconstante voor de reactie[6] is 1,38 × 10−13. Als vrij standaard concentraties (0.1 Mol.L−1) voor zowel koper(II) als jodide gebruikt worden, wordt voor Cu+ een concentratie van 3 × 10−7 Mol.L−1 berekend. Bijgevolg komt daarmee het ionenproduct ruim boven het oplosbaarheidsproduct en ontstaat een neerslag. De neerslagvorming leidt tot een daling van [Cu+] waardoor het evenwicht verschuift en de reactie gaat aflopen.
CuI is, zoals boven al aangegeven, slecht oplosbaar in water (0,00042 g/L bij 25 °C), maar wel oplosbaar in geconcentreerde oplossingen van NaI of KI, waarin het lineaire anion [CuI2]− gevormd wordt. Verdunnen van deze oplossingen leidt tot het opnieuw neerslaan van CuI. Via dit oplossen en weer neerslaan kan koper(I)jodide gezuiverd worden, en worden ook kleurloze/witte stalen verkregen.[7]
Toepassingen
[bewerken | brontekst bewerken]Koper(I)jodide heeft verscheidene toepassingen. Het wordt vaak aangewend als reagens in de organische synthese. In combinatie met 1,2- of 1,3-diamineliganden katalyseert koper(I)jodide de omzetting van aryl-, heteroaryl- en vinylbromiden in de corresponderende jodiden. Natriumjodide wordt daarbij vaak als jodidebron gebruikt, dioxaan doorgaans als oplosmiddel. Arylhalogeniden worden met koper(I)jodide als katalysator toegepast om koolstof-koolstof- en koolstof-heteroatoom-bindingen te maken zoals in de Heck-, de Sonogashira- de Stille-, de Suzuki- en de Ullman-koppeling. De aryljodiden zijn echter reactiever in de betreffende reacties dan de bromiden en chloriden.[8]
Koper(I)jodide wordt toegepast bij regen maken,[3] waarbij de hoeveelheid of het soort neerslag in een wolk wordt gewijzigd door stoffen in de atmosfeer te verspreiden die condensatiekernen vormen en zo de neerslagvorming bevorderen. Zilverjodide bezit een gelijkaardige toepassing.
Koper(I)jodide wordt als additief in nylon gebruikt, waardoor het beter warmtebestendig wordt. Dit vindt zowel toepassingen in de industriële als in het huishouden. Verder wordt de stof als jodidebron gebruikt in keukenzout en voedseladditieven voor dieren.[3]
Bron
[bewerken | brontekst bewerken]- Macintyre, J. Dictionary of Inorganic Compounds. Chapman and Hall, London, (1992). Vol. 3, p. 3103.
Externe links
[bewerken | brontekst bewerken]- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ↑ Skoog West Holler Crouch. Fundamentals of Inorganic Chemistry. Brooks/Cole, 2004, pp. A-6 ISBN 978-0-03-035523-3
- ↑ a b c Patnaik, Pradyot (2003). Handbook of inorganic chemicals (Google Books excerpt). McGraw-Hill, New York, 268–269. ISBN 0-07-049439-8.
- ↑ Wells, A. F. Structural Inorganic Chemistry Oxford University Press, Oxford, (1984). 5th ed., p. 410 and 444.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ De exacte waarde hangt af van de keuze van de halfreactie voor jodium. De waarde zelf is berekend via de formule: Kredox=10^{(nox*nred/0,0591)*(Eooxidator – Eoreductor)}, die zelf relatief eenvoudig uit de Nernstvergelijking is af te leiden. Invullen van Eoox=EoCu2+/Cu+ = 0,15; nox = 1 voor koper; Eored=EoI−/I2 = 0,52; nred = 2 voor jood
- ↑ Kauffman, G. B.; Fang, L. Y. (1983). Purification of Copper(I) Iodide. Inorg. Synth. 22: 101–103. DOI: 10.1002/9780470132531.ch20.
- ↑ Klapars, A., Buchwald, S. L. (2002). Copper-Cataylzed Halogen Exchange in Aryl Halides: an Aromatic Finkelstein Reaction. J. Am. Chem. Soc. 124: 14845. DOI: 10.1021/ja028865v.





