Kwadraatzuur
| Kwadraatzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van kwadraatzuur
| ||||
| Algemeen | ||||
| Molecuulformule | C4H2O4 | |||
| IUPAC-naam | 3,4-dihydroxycyclobut-3-een-1,2-dion | |||
| Molmassa | 114,06 g/mol | |||
| SMILES | C1(=C(C(=O)C1=O)O)O
| |||
| InChI | 1/C4H2O4/c5-1-2(6)4(8)3(1)7/h1,5H
| |||
| CAS-nummer | 2892-51-5 | |||
| EG-nummer | 220-761-4 | |||
| PubChem | 17913 | |||
| Wikidata | Q903298 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H317 - H319 - H335[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P280 - P305+P351+P338[1] | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit-grijs | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Kwadraatzuur is de triviale naam voor de organische verbinding 3,4-dihydroxycyclobut-3-een-1,2-dion. Het is een derivaat van cyclobuteen. De naam kwadraatzuur verwijst naar het vierkante koolstofskelet, maar door de ongelijke bindingslengten van de koolstof-koolstofbindingen in de vierring, vormt het skelet geen perfect vierkant.
De zouten en esters van kwadraatzuur heten squaraten.[2]
Synthese[bewerken | brontekst bewerken]
De oorspronkelijke synthese, gepubliceerd in 1959, betrof de hydrolyse van gehalogeneerde cyclobuteenderivaten, namelijk 1,3,3-tri-ethoxy-2-chloor-4,4-difluorcyclobuteen of 1,2-di-ethoxy-3,3,4,4-tetrafluorcyclobuteen.[3]
Later zijn diverse andere syntheseroutes gepubliceerd. Een gepatenteerde methode betreft de reactie van isobutylvinylether met chlooracetylchloride tot 2-chloor-3-isobutoxycyclobutanon, met een amine als katalysator. Verdere halogenering leidt tot 2,2,4,4-tetrachloor-3-isobutoxycyclobutanon, dat gedehydrohalogeneerd wordt tot 2,4,4-trichloor-3-isobutoxy-2-cyclobuteen-1-on. Ten slotte leidt hydrolyse van dit intermediair tot kwadraatzuur.[4]
Eigenschappen[bewerken | brontekst bewerken]
Kwadraatzuur is een grijze kristallijne vaste stof die ontleedt bij ongeveer 293 °C. Het is een sterk diprotisch zuur met als zuurconstanten:
- pKa1 = 1,5
- pKa2 = 3,4
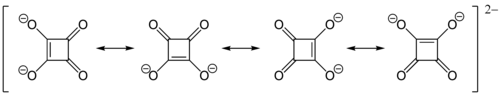
Zouten en esters van kwadraatzuur worden squaraten genoemd. De lage pKz-waarden, dus grote zuursterkte, zijn het gevolg van de stabilisatie van het gevormde anion door resonantie. De negatieve lading in het dianion is gelijkmatig verdeeld over de zuurstofatomen, zodat het ion symmetrisch is met een perfect vierkante structuur:
Derivaten[bewerken | brontekst bewerken]
Veel reacties van kwadraatzuur treden op aan de hydroxylgroepen.
Esters/Ethers[bewerken | brontekst bewerken]
De naamgeving van producten van reacties met alkylgroepen kan verwarrend zijn: afwisselend worden ze als ether of ester beschreven.
Met trimethylorthoformiaat wordt de 3,4-dimethoxycyclobutaan-1,2-dion of dimethylsquaraat verkregen.[5]
Zuurchlorides[bewerken | brontekst bewerken]
Net als "normale" carbonzuren reageert kwadraatzuur met thionylchloride onder vorming van het zuurchloride:
Zoals in alle zuurchlorides is chloride hier ook een goede leaving group. Een grote groep nucleofielen kan deze chloor-atomen vervangen. Dithiokwadraatzuur wordt op deze manier gesynthetiseerd.
Amides[bewerken | brontekst bewerken]
Kwadraatamide wordt ofwel verkregen via het zuurchloride, ofwel via de alkylverbinding:[6]
- Di-ethylsquaraat met ammoniak geeft kwadraatamide plus ethanol.
Reactie aan de carbonylgroep[bewerken | brontekst bewerken]
Ook een of beide carbonylgroepen kunnen vervangen worden, bijvoorbeeld door een dicyanomethyleengroep, . Voorbeelden zijn: 1,2-bis(dicyanomethyleen)squaraat en 1,3-bis(dicyanomethyleen)squaraat. Na afsplitsen van de protonen blijkt het di-anion zijn aromatisch karakter behouden te hebben. Dit soort ionen wordt soms aangeduid als pseudo-koolstof-zuurstof-anionen.
Fotolyse[bewerken | brontekst bewerken]
Fotolyse van kwadraatzuur in een matrix van vast argon bij 10 K levert ethyndiol.[7]
Toepassingen[bewerken | brontekst bewerken]

Van kwadraatzuur en de esters ervan is een groep kleurstoffen afgeleid: de squaraïnes. Dit zijn dubbele condensatieproducten van kwadraatzuur met nucleofiele verbindingen, zoals elektronrijke aromatische of heteroaromatische verbindingen.
Kwadraatzuur is een bouwsteen voor andere chemische verbindingen zoals farmaceutische stoffen.[8] Kwadraatzuur of derivaten ervan kunnen in thermochemische beeldvormende processen gebruikt worden waarbij het zuur na verhitting vrijgezet wordt en een kleurverandering veroorzaakt in een zuurgevoelig materiaal.[9]
De dibutylester van kwadraatzuur, dibutylsquaraat, wordt gebruikt om haaruitval tegen te gaan.[10]