Organogoudchemie
In de organogoudchemie in de strikte zin van het woord worden verbindingen bestudeerd waarin een directe binding voorkomt tussen koolstof en goud. In bredere zin worden ook organische reacties bestudeerd waarin goud een essentiële rol speelt. Omdat goud een metaal is, vormt de organogoudchemie een subdiscipline van de organometaalchemie.
Organogoudverbindingen zijn vooral academisch interessant, praktisch-technisch zijn er weinig toepassingen bekend. Goud komt in organogoud-verbindingen vooral voor met oxidatiegetallen +1 en +3.[1][2][3] De eerste organogoud-verbinding, goudcarbide (Au2C2), werd in 1900 ontdekt.
Goud(I)verbindingen[bewerken | brontekst bewerken]
De goud(I)-complexen hebben een coördinatiegetal 2, zijn lineair, diamagnetisch en beschikken over 14 valentie-elektronen. Deze complexen hebben de algemene formule LAuR waarin "L" voor een ligand als trifenylfosfine of isocyanide staat. De ligand voorkomt de reductie van Au(I) tot metallisch Au(0) met dimerisatie van het organische deel van de verbinding tot gevolg. Goud(I) wordt ook gevonden als auraat, MAuR2 (een aatcomplex), waarbij het kation doorgaans voorzien is van eigen liganden om de stabiliteit te bevorderen. Het AuR2−anion is lineair, net als andere M(d10)complexen zoals Hg(Me)2 en Pd(Me)22+. Van goud is bekend dat het in staat is acetylides te vormen (waaruit weer polymere structuren ontstaan), evenals carbenen en carbynen. De standaardmethode om LAuR-verbindingen te maken verloopt via de reactie van een Grignardreagens met een goud(I)halogenide. Als volgreactie kan de reactie met een organolithiumreagens (R-Li) gebruikt worden waarbij een aatcomplex gevormd wordt.
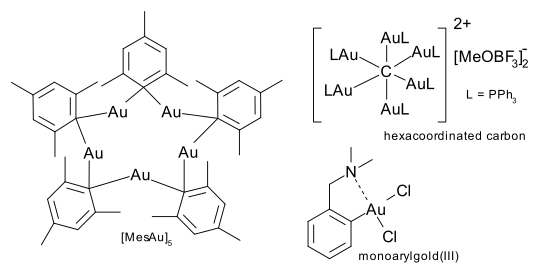
In een speciale groep verbindingen fungeert een koolstofatoom van een aromatische verbinding als brug tussen twee goudatomen. Een van die verbindingen, (MesAu)5, ontstaat in de reactie tussen Au(CO)Cl en het Grignardreagens mesitylmagnesiumbromide. Met goud kan koolstof tot 6 coördinatiebindingen aangaan. Een voorbeeld van verbindingen van het type C(AuL)4 is isolobaal met methaan en van het type C(AuL)5+ is isolobaal met het methanium-ion een voorbeeld.
Goudcyanideverbindingen, ook wel dicyanoauraten genoemd, met de algemene formule MAu(CN)2, zijn belangrijk in de goudwinning via goudcyanatie, een van de manieren om goud uit zijn ertsen te isoleren. De binding tussen koolstof en metaal is in cycaniden doorgaans ionogeen, maar voor de auraten zijn er aanwijzingen dat er sprake is van een covalente binding.[4]
Goud(III)verbindingen[bewerken | brontekst bewerken]
In de goud(III)verbindingen wordt het coördinatiegetal 4 aangetroffen, de structuur vormt een vlak vierkant, de verbindingen zijn diamagnetisch, giftig en beschikken over 16 valentie-elektronen. Als het aantal van 4 liganden formeel niet gehaald wordt, kan bijvoorbeeld chloor aan twee verschillende goudatomen binden. Een andere mogelijkheid wordt gevormd door intramoleculaire complexvorming. In het algemeen zijn goud(III)verbindingen giftig, en daarom minder bestudeerd dan hun goud(I)-tegenpolen. De chemie van de organische goud(III)verbindingen beperkt zich de facto tot de monoarylgoud(III)complexen.
Goud als katalysator[bewerken | brontekst bewerken]
De katalytische activiteit van goud kan in twee grote groepen verdeeld worden:
- heterogene katalyse, waaronder ook die met goudnanodeeltjes en
- homogenene katalyse met zowel goud(I)- als goud(III)verbindingen.
Een aantal commerciële katalysatoren op basis van goud zijn: goud(I)chloride, goud(III)chloride, chloorgoudzuur en goudfosfines als chloor(trifenylfosfine)goud(I). Een veel gebruikte katalytische combinatie wordt gevormd door goud(III)chloride en zilvertriflaat.
Door goud gekatalyseerde reacties hebben vooral betrekking op alkenen en alkynen. De π-binding die daarin aanwezig is, speelt daarbij een belangrijke rol op de manier zoals die door Dewar, Chatt en Duncanson beschreven is. Goud is niet het enige element dat op die manier bindingen vormt en reacties aangaat, een aantal met het waterstofion isolabale ionen van diverse metalen (kation; lege s-orbitaal) vertonen hetzelfde gedrag. Het zijn elementen uit dezelfde rij in het periodiek systeem als goud: kwik(II) en platina(II). In 2007 stelden Furstner & Davies[5] de term pi-zuur voor om dit soort ionen aan te duiden (zie kation-pi-interactie).
Het resulterende complex van metaal aan de π-binding is elektrofiel geactiveerd. In bijvoorbeeld de oxymercuratie wordt de rol van het metaal door kwik vervuld, met als nadeel een sterke koolstofkwik-binding waardoor katalytische hoeveelheden niet voldoen, maar eerder stoichiometrische hoeveelheden, met extra oplos- en zuiveringsstappen, noodzakelijk zijn. Voordelen van het gebruik van goud als katalysator zijn:
- De binding tussen koolstof en goud is juist vrij zwak, waardoor een echt katalytische rol in katalytische hoeveelheden mogelijk is.
- De organogoud-verbindingen zijn de stabiliteit in de lucht vanwege de hoge elektrodepotentiaal van Au+ naar Au3+.
- Organogoud-verbindingen reageren bij voorkeur met koolstof gecombineerd met een mindere neiging tot reactie met zuurstof waardoor stabiliteit ten opzichte van water en alcoholen ontstaat.
- De binding tussen koolstof en goud zal bij voorkeur vervangen worden door een tussen koolstof en waterstof door opname van H+ in plaats van eliminatie van H− (hydride) van een β-positie. De reactiviteit van de verbindingen is daardoor groter, terwijl ze tegelijkertijd minder toxisch worden.[6]

Onderstaande reacties zijn voorbeelden en geen uitputtend overzicht!
Chirale aldolreactie[bewerken | brontekst bewerken]
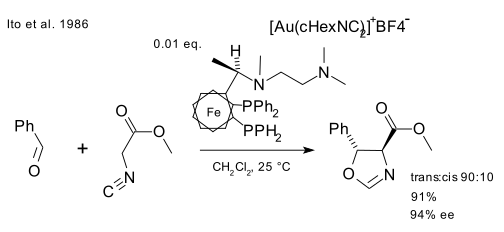
Een van de reacties waarin goud een katalytische rol speelt werd in 1986 beschreven door Ito.[7] In de reactie van benzaldehyde met methylisocyanoacetaat met een chirale ferrocenylfosfine ligand en de goud(I)verbinding (Au(cHexCN)2)BF4 werd een chiraal oxazoline gevormd. Deze reactie was niet alleen een van de eerste door een goudverbinding gekatalyseerde reactie, het was de eerste gekatalyseerde chirale aldol-reactie.
In het mechanisme van deze reactie is een centrale rol weggelegd voor een goud(I)complex dat (vereenvoudigd) weergegeven kan worden als een complex waarin goud(I) tegelijkertijd gecoördineerd wordt door twee fosfine-liganden en de isocyanaatgroep[8] dat dan met de carbonylgroep reageert.
Oxidatie van acetylenen[bewerken | brontekst bewerken]
In 1978 lukte het Thomas fenylacetyleen om te zetten in acetofenon met behulp van waterstoftetrachloorauraat in een opbrengst van 37%[9]. In deze reactie nam goud(III) de plaats in van kwik in een oxymercuratie.
Utimoto liet in 1991 zien dat onder invloed van NaAuCl4 alkynen en water met elkaar tot ketonen reageren.[10]. Teles wees op een belangrijk nadeel van deze methode: het goud(III) wordt makkelijk tot het vrije metaal gereduceerd, en dat is katalytisch niet actief. Voor wat betreft door goud gekatalyseerde reacties betekende dit de terugkeer naar de met liganden beschermde verbindingen van goud(I)[11]:
Geforceerde diels-alderreactie[bewerken | brontekst bewerken]
In 2000 slaagde een groep onderzoekers rond Hashmi erin een geforceerde (normaal niet optredende) diels-alderreactie tussen een alkyn en furaan te realiseren waarbij uiteindelijk een fenol ontstaat[12]:
Heterogene katalyse[bewerken | brontekst bewerken]
Het gebruik van goud als een heterogene katalysator is al langer bekend. Goud is een aantrekkelijk materiaal als katalysator vanwege zijn stabiliteit tegen oxidatie en een groot aantal morfologisch verschillende vormen zoals verschillende typen goudclusters. Aangetoond is dat goud een effectieve katalysator is in lage temperatuur oxidatie van koolstofmonoxide en in de omzetting van acetyleen in vinylchloride. Hoewel de techniek duidelijk is, is de discussie over het mechanisme van de katalytische werking nu (2010) nog open[13]. De rol van goud als katalysator in deze technisch belangrijke reacties is niet groot. Naast het feit dát goud een reactie kán katalyseren speelt ook een rol dat goud een hoger prijskaartje heeft dan bijvoorbeeld organische ijzerverbindingen, waarvan in de laatste jaren ook een groot aantal van dit soort reacties beschreven is.
[bewerken | brontekst bewerken]
Navigatie Koolstof-elementbinding
Bronnen, noten en/of referenties
|