Zwaveldichloride
| Zwaveldichloride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
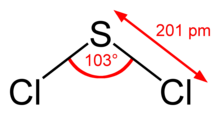
Structuurformule van zwaveldichloride
| |||||

| |||||
Molecuulmodel van zwaveldichloride
| |||||
| Algemeen | |||||
| Molecuulformule | SCl2 | ||||
| IUPAC-naam | zwaveldichloride | ||||
| Andere namen | zwavel(II)chloride | ||||
| Molmassa | 102,971 g/mol | ||||
| SMILES | S(Cl)Cl
| ||||
| InChI | 1S/Cl2S/c1-3-2
| ||||
| CAS-nummer | 10545-99-0 | ||||
| EG-nummer | 234-129-0 | ||||
| PubChem | 25353 | ||||
| Wikidata | Q409028 | ||||
| Beschrijving | Rode vloeistof met indringende geur | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H314 - H335 - H400 | ||||
| EUH-zinnen | EUH014 | ||||
| P-zinnen | geen | ||||
| EG-Index-nummer | 016-013-00-X | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | rood | ||||
| Dichtheid | 1,621 g/cm³ | ||||
| Smeltpunt | −121,0 °C | ||||
| Kookpunt | 59 °C | ||||
| Zelfontbrandings- temperatuur | 234 °C | ||||
| Dampdruk | (bij 20°C) 21.800 Pa | ||||
| Brekingsindex | 1,5570 | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH |
−49 kJ/mol | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Zwaveldichloride is een corrosieve anorganische verbinding van chloor en zwavel, met als brutoformule SCl2. De stof komt voor als een rode vloeistof met een indringende geur, die exotherm hydrolyseert in water, met vorming van waterstofchloride. Het wordt gebruikt als precursor in de synthese van organische zwavelverbindingen.
Zwaveldichloride reageert hevig met aluminium, natrium, salpeterzuur en distikstofpentaoxide.
Synthese[bewerken | brontekst bewerken]
Zwaveldichloride kan op twee manieren bereid worden:
- Door chlorering van elementair zwavel:
- Door chlorering van zwavelchloride:
Toepassingen[bewerken | brontekst bewerken]
Zwaveldichloride wordt in een aantal organische syntheses gebruikt om alkenen om te zetten naar chloor-gesubstitueerde thio-ethers. Zo leidt de reactie van etheen met zwaveldichloride tot de vorming van het zeer giftige mosterdgas.[1]
Zwaveldichloride is tevens precursor in de synthese van tal van anorganische zwavelverbindingen. Indien het in reactie met fluorhoudende zouten wordt gebracht, wordt het corrosieve zwaveltetrafluoride (SF4) gevormd. In reactie met ammoniak wordt tetrazwaveltetranitride (S4N4) gevormd.
Zie ook[bewerken | brontekst bewerken]
Externe links[bewerken | brontekst bewerken]
- (en) Gegevens van zwaveldichloride in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van zwaveldichloride
Bronnen, noten en/of referenties
|





