Lawesson-reagens
| Lawesson-reagens | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van het Lawesson-reagens
| ||||

| ||||
Molecuulmodel van het Lawesson-reagens
| ||||
| Algemeen | ||||
| Molecuulformule | C14H14O2P2S4 | |||
| IUPAC-naam | 2,4-bis(4-methoxyfenyl)-1,3-dithia-2,4-difosfetaan-2,4-disulfide | |||
| Andere namen | LR | |||
| Molmassa | 404,467284 g/mol | |||
| SMILES | COC1=CC=C(P2(SP(S2)(C3=CC=C(OC)C=C3)=S)=S)C=C1
| |||
| InChI | 1S/C14H14O2P2S4/c1-15-11-3-7-13(8-4-11)17(19)21-18(20,22-17)14-9-5-12(16-2)6-10-14/h3-10H,1-2H3
| |||
| CAS-nummer | 19172-47-5 | |||
| EG-nummer | 242-855-4 | |||
| PubChem | 87949 | |||
| Wikidata | Q419324 | |||
| Beschrijving | Lichtgeel poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H261 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P231+P232 - P422 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | lichtgeel | |||
| Smeltpunt | 228-231 °C | |||
| Onoplosbaar in | water | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Het Lawesson-reagens is een organische verbinding die in de organische synthese gebruikt wordt als thioneringreagens. De stof komt voor als een lichtgeel poeder, dat onoplosbaar is in water.
Geschiedenis[bewerken | brontekst bewerken]
Het Lawesson-reagens is niet ontdekt door de Zweed Sven-Olov Lawesson, maar hij was wel de scheikundige die het populair maakte als thioneringreagens. Het reagens werd in de jaren '50 van de 20e eeuw voor het eerst bereid tijdens een systematische studie van de reactie van aromatische verbindingen met fosforpentasulfide (P4S10).[1] In latere jaren hebben een aantal anorganische scheikundigen de algemene chemie van Lawessons reagens en aanverwante verbindingen onderzocht.
Synthese[bewerken | brontekst bewerken]
Een mengsel van anisol en fosforpentasulfide wordt verhit totdat het mengsel kleurloos is en er geen waterstofsulfide meer wordt gevormd.[2] Herkristallisatie uit tolueen of xyleen levert het zuivere reagens als een geel poeder.
Aangezien het Lawesson-reagens een sterke en onaangename geur heeft wordt het aangeraden de verbinding in een zuurkast te maken en om al het gebruikte glaswerk goed schoon te maken voordat het buiten de zuurkast komt. Een veelgebruikte en effectieve methode hiervoor is het gebruik van natriumhypochloriet (bleekloog).
Mechanisme[bewerken | brontekst bewerken]
Het Lawesson-reagens heeft een vierring van alternerende zwavel- en fosforatomen. Onder verhitting kan de centrale fosfor-zwavel-vierring geopend worden om twee reactieve dithiofosfine-yliden (R-PS2) te vormen:
De chemie van het Lawesson-reagens is in feite de chemie van deze reactieve tussenproducten. Het bestaan van deze verbindingen kan worden aangetoond door middel van 31P-NMR-spectroscopie.
Toepassingen[bewerken | brontekst bewerken]
De chemie van Lawessons reagens en aanverwante verbindingen is onderzocht door diverse onderzoeksgroepen.[3][4][5] Een veelgebruikt gebruik van het Lawesson-reagens is het omzetten van een carbonylverbinding naar een thiocarbonylverbinding. Een amide kan bijvoorbeeld worden omgezet in een thioamide door dit reagens te gebruiken. Daarnaast wordt het gebruikt voor de synthese van thio-esters en thioketonen.
In het algemeen geldt, hoe elektronenrijker een carbonylgroep is, des te sneller de carbonylgroep wordt omgezet in de corresponderende thiocarbonylgroep.
Een combinatie van zilverperchloraat en het Lawesson-reagens kan als oxofiel lewiszuur reageren, met de mogelijkheid de diels-alderreactie van dienen met alfa-bèta-onverzadigde aldehyden te katalyseren.
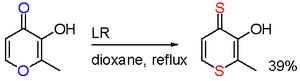
In een onderzoek uit 2006[6] resulteert de reactie van maltol met het Lawesson-reagens in een selectieve zuurstofvervanging op twee posities:
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|