Pericyclische reactie

In de organische chemie is een pericyclische reactie een type organische reactie waarin enerzijds de overgangstoestand van de molecule een cyclische geometrie heeft (het breken en vormen van bindingen geschiedt door een reorganisatie van elektronenparen door interactie van orbitalen van geschikte symmetrie) en anderzijds de reactie via een geconcerteerd mechanisme verloopt. Er worden dus geen intermediairen gevormd.
Pericyclische reacties zijn doorgaans omleggingen en worden gekenmerkt door een uniek stereochemisch verloop: er wordt doorgaans slechts 1 isomeer gevormd (in tegenstelling tot andere reacties, waarbij mengsels van isomeren kunnen gevormd worden). De stereoselectiviteit wordt doorgaans beschreven met behulp van de grensorbitaaltheorie of met de Woodward-Hoffmann-regels. Door de sterk geordende overgangstoestand is de activeringsenergie van dergelijke reacties meestal vrij hoog. Ze kunnen op twee manieren geactiveerd worden: thermisch (toevoer van warmte) en fotochemisch (toevoer van elektromagnetische energie). Beide manieren kunnen verschillende eindproducten (zowel wat betreft structuur als stereochemie) veroorzaken.
Types[bewerken | brontekst bewerken]
Pericyclische reacties worden doorgaans in 3 grote types ingedeeld, op basis van de transitietoestand die gevormd wordt:
| Type | Startverbinding(en) | Overgangstoestand | Eindverbinding |
|---|---|---|---|
| Cycloadditiereactie | 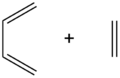 |
 |

|
| Elektrocyclische reactie |  |
 |

|
| Sigmatrope omlegging |  |
 |

|
Deze reactietypes kunnen nog verder onderverdeeld worden. Zo behoren de 1,3-dipolaire cycloadditie, de cheletrope reactie, de een-reactie en de diels-alderreactie allen tot de cycloaddities. Elektrocyclische reacties worden doorgaans niet verder ingedeeld. Tot de belangrijke sigmatrope omleggingen behoren onder andere de Claisen-omlegging en de Cope-omlegging.
Dyotrope reacties vormen een bijzonder type: ze kunnen opgevat worden als pericyclische isomerisaties.
Verloop en mechanisme[bewerken | brontekst bewerken]
Een aantal pericyclische reacties zijn evenwichtsreacties (zoals sigmatrope omleggingen). Het is mogelijk de reactie naar een van de kanten te dwingen door het product een aanmerkelijk lagere energie te geven, een unimoleculaire variatie op het principe van Le Chatelier.
Voor veel pericyclische reacties zijn ook stapsgewijze, vaak via radicalen verlopende, processen bekend. Vaak kon besloten worden dat de reactie geconcerteerd was, maar in een aantal gevallen ligt de discussie nog open. Voor de discussie met betrekking tot de [2+2]-cycloadditie is het doek nog niet gevallen, of is het mechanisme misschien zelfs afhankelijk van de gebruikte reagentia. Ook metaal-gekatalyseerde reacties kunnen netto hetzelfde effect opleveren (hetzelfde reactieproduct) als pericyclische reacties. Volgens de definitie zijn het echter geen percyclische reacties, omdat er metaal-gestabiliseerde intermediairen gevormd worden en de reactie bijgevolg niet geconcerteerd is.
Een van de (op moleculaire schaal gezien) grootste pericyclische reacties is een sigmatrope omlegging die toegepast werd bij de synthese van een corrine door Albert Eschenmoser waarbij gebruikgemaakt werd van een 16π elektron-systeem.[1]
Het is niet steeds nodig dat enkel koolstof deel uitmaakt van de reagerende componenten: zo zijn de aza-diels-alderreactie, de oxo-diels-alderreactie en de Paternò-Büchi-reactie voorbeelden waarbij stikstof dan wel zuurstof deelneemt aan de pericyclische overgangstoestand en ingebouwd wordt in de uiteindelijke (cyclische) structuur. Op die manier kunnen heterocyclische verbindingen worden gevormd.
Pericyclische reacties in de biochemie[bewerken | brontekst bewerken]
Pericyclische reacties treden ook op in een aantal biologische processen:
- Claisen-omlegging van chorismaat tot prefenaat in bijna alle prototrofe organismen
- [1,5]-sigmatrope omlegging van precorrine-8x tot hydrogenobyrinzuur
- Niet-enzymatische, fotochemische elektrocyclische ringopening en een [1,7]-sigmatrope hydride-verschuiving bij de synthese van vitamine D
De omzetting van isochorismaat in salicylaat en pyruvaat is een gekatalyseerde, echte pericyclische reactie:[2]
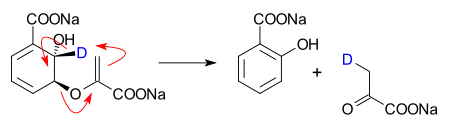
In dit experiment werd het isochorismaat op een specifieke plaats gedeutereerd en vervolgens onderworpen aan de werking van het lyase. Er zijn twee redenen waarom andere reactiemechanismen (ionogeen of base-gekatalyseerd) kunnen worden uitgesloten:
- Uit de grootte van het kinetisch-isotoopeffect (2,34) kan afgeleid worden dat de binding tussen koolstof en deuterium tijdens de overgangstoestand van de snelheidsbepalende stap van de reactie verbroken wordt
- NMR-studies tonen aan dat het deuterium uitsluitend in pyruvaat wordt teruggevonden
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|
