Salicylzuur
| Salicylzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
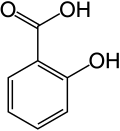
Structuurformule van salicylzuur
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | 2-hydroxybenzoëzuur | |||
| Molmassa | 138,12074 g/mol | |||
| SMILES | C1=CC=C(C(=C1)C(=O)O)O
| |||
| InChI | 1S/C7H6O3/c8-6-4-2-1-3-5(6)7(9)10/h1-4,8H,(H,9,10)
| |||
| CAS-nummer | 69-72-7 | |||
| EG-nummer | 200-712-3 | |||
| PubChem | 338 | |||
| Wikidata | Q193572 | |||
| Vergelijkbaar met | 4-hydroxybenzoëzuur, 3-hydroxybenzoëzuur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H318 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 | |||
| LD50 (ratten) | (oraal) 891 mg/kg | |||
| LD50 (konijnen) | (oraal) 1300 mg/kg | |||
| LD50 (muizen) | (oraal) 480 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,44 g/cm³ | |||
| Smeltpunt | 158,3 °C | |||
| Kookpunt | 211 °C | |||
| Vlampunt | 157 °C | |||
| Oplosbaarheid in water | (bij 20°C) 2 g/L | |||
| Goed oplosbaar in | ethanol | |||
| Slecht oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKz1 = 2.97 (carboxyl; 25 °C)[1] pKz2 = 13.82 (hydroxyl; 20 °C)[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Salicylzuur is een aromatisch carbonzuur en heeft als brutoformule C7H6O3. De zuivere stof komt voor als kleurloze en reukloze kristallen, die slecht oplosbaar zijn in water.
De stof is opgenomen in de lijst van essentiële geneesmiddelen van de WHO.
Voorkomen
[bewerken | brontekst bewerken]Salicylzuur komt voor in onder andere wilgenbast, bepaalde soorten fruit, moerasspirea en sommige cactussen. Salicylzuur is een antioxidant die in planten en vruchten waarschijnlijk een functie vervult in de afweer tegen vraat en als conserveermiddel.
Synthese
[bewerken | brontekst bewerken]De stof kan bereid worden uit fenol door middel van de Kolbe-Schmitt-reactie:
Structuur en eigenschappen
[bewerken | brontekst bewerken]Salicylzuur heeft 2 protolyseerbare groepen, zowel de fenolische hydroxylgroep (pKa = 12,38) als de carboxygroep (pKa = 2,97) vertonen deze eigenschap. Delokalisatie van de negatieve lading binnen de aromatische ring zorgt ervoor dat de zuursterkte aanmerkelijk groter is dan wat men zou verwachten van gewoon carbonzuur. Ondanks de zuursterkte is de stof nauwelijks oplosbaar in water. Zouten en esters van de stof worden salicylaten genoemd.
Toepassingen
[bewerken | brontekst bewerken]Salicylzuur werd vóór de uitvinding van acetylsalicylzuur (Aspirine), de azijnzure ester van salicylzuur, als koortsremmer gebruikt. Acetylsalicylzuur bleek behalve koortsremmend ook pijnstillend te werken.
Salicylzuur wordt in hoge concentraties (tot 50%) gebruikt bij de behandeling van wratten: salicylzuur verweekt met name de hoornlaag.[3] In lage concentraties van enkele procenten wordt het toegevoegd aan huidcrèmes om de penetratie van een geneesmiddel te bevorderen. Zo kan de geneeskrachtige stof gemakkelijker (sneller) door de huid heen dringen. Op deze manier kan het ook helpen tegen acne.
Salicylzuur en zijn verbindingen werden wel als conserveermiddel in levensmiddelen gebruikt. Dit is in de Europese Unie niet meer toegestaan. De esters met de carboxygroep van salicylzuur geuren erg aangenaam, een bekend voorbeeld is methylsalicylaat, die ruikt naar de bloemen van de plant Gaultheria procumbens.
Verder kan het een precursor zijn voor de stof 2,4,6-trinitrofenol (picrinezuur): de carboxygroep is namelijk vlot te verwijderen door middel van decarboxylering.
Externe links
[bewerken | brontekst bewerken] salicylzuur - International Chemical Safety Card
salicylzuur - International Chemical Safety Card- (en) Gegevens van salicylzuur in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van salicylzuur
- ↑ Wishart DS, Djombou Feunang Y, Guo AC, Lo EJ, Marcu A, Grant JR, Sajed T, Johnson D, Li C, Sayeeda Z, Assempour N, Iynkkaran I, Liu Y, Maciejewski A, Gale N, Wilson A, Chin L, Cummings R, Le D, Pon A, Knox C, Wilson M. "Salycylic acid | DrugBank Online". DrugBank. 5.0
- ↑ "Salicylic acid". Archived from the original on 2014-05-24. Retrieved 2014-05-23.
- ↑ Behandeling wratten www.apotheek.nl




