Fosfineoxide (stofklasse)

Fosfineoxides, soms ook gespeld als fosfinoxides of fosfine-oxides, zijn in de organische chemie fosforverbindingen met de algemene formule , waarin de R staat voor een alkyl- of arylgroep of eventueel een of twee waterstof-atomen. Trifenylfosfineoxide is een voorbeeld van een degelijke stof. In de anorganische chemie vormt fosforylchloride een voorbeeld van deze klasse van verbindingen.[1]
Stamverbinding[bewerken | brontekst bewerken]
De stamverbinding, fosfineoxide is niet stabiel, hoewel het massaspectroscopisch is aangetoond als reactieproduct van fosfine en zuurstof,[2] via FT-IR in de reactie tussen fosfine en ozon[3] en het is geïsoleerd in een matrix bij de reactie van fosfine, vanadiumoxytrichloride en chromylchloride[4] Het is ook beschreven als relatief stabiel in een waterige-ethanol oplossing, waarin het gemaakt was via de elektrochemische oxidatie van witte fosfor. In deze oplossing disproportioneert het langzaam naar fosfine en onderfosforigzuur:[5]

|

|

|

| |||
Fosfineoxide |
Onderfosforigzuur |
Fosfine | ||||
Secondaire fosfineoxides zijn in evenwicht met het tautomere fosfinigzuur .
fosineoxide is beschreven als intermediair in de bij kamertemperatuur verlopende polymerisatie van fosfine en salpeterzuur tot vast .[6]
Structuur en binding[bewerken | brontekst bewerken]
Tertiaire fosfineoxides[bewerken | brontekst bewerken]
Tertiaire fosfineoxides zijn de meest voorkomende vorm van deze groep verbindingen. Met hun formule zijn het tetraëdrische moleculen. Ze worden meestal bereid door oxidatie van het overeenkomende teriaire fosfine. De binding tussen fosfor en zuurstof is kort, polair en sterk. Gebruik makend van de molecuulorbitaaltheorie is de korte binding tussen zuurstof en fosfor het gevolg van (gedeeltelijke) overdracht van elektronen uit de niet gehybridiseerde p-orbitalen van zuurstof naar de antibindende orbitaal van de fosfor-koolstofband.[7] De binding tussen fosfor en zuurstof is onderhevig geweest aan heftige discussie. Een van de voorgestelde modellen gebruikte de lege d-orbitalen van fosfor om de bindingssterkte te verklaren. De computationele benadering ondersteund deze optie echter niet. In termen van de klassieke Lewistheorie wordt de binding tegenwoordig gezien als een datieve binding zoals deze ook voor de amineoxides gebruikt wordt.[8][9]
Secondaire fosfineoxides[bewerken | brontekst bewerken]
Secondaire fosfineoxides, formeel de geoxideerde vorm van secondaire fosfines , hebben ook een tetraëdrische structuur rond fosfor.[10] Een commercieel beschikbaar voorbeeld van deze klasse van verbindingen is difenylfosfineoxide. Secondaire fosfineoxides worden gebruikt bij het samenstellen van katalysatoren voor koppelingsreacties tussen organische halogeniden en organometaalverbindingen.[11]
In tegenstelling tot de tertiaire fosfineoxides, zijn de secondaire wel gevoelig voor verdere oxidatie:
Deze reactie wordt vooraf gegaan door de tautomerisatie tot fosfinigzuur:
Primaire fosfineoxides[bewerken | brontekst bewerken]
Formeel kunne primaire fosfineoxides gezien worden als de geoxideerde producten van primaire fosfines. Ook dceze verbindiningen zijn tetraëdrisch. Net als de secondaire fosfineoxides zijn de primaire gevoelig voor tautomerisatie, het gevormde fosfinigzuur is vervolgens weer, net als zijn secondaire tegenhamher, gevoelig voor verdere oxidatie:
Net als de secondaire fosfineoxides zijn ook de primaire gevoelig voor disproportionering, nu naar het fosfinigzuur en het primaire fosfine:[12]
Synthese[bewerken | brontekst bewerken]
- Luchtzuurstof
- De standaard synbtheseroute naar fosfineoxides verloopt via de oxidatie van het overeenkomstige fosfine. Luchtzuurstof is doorgaans ene voldoende sterke oxidator om het fosfine volledig om te zetten in het fosfineoxide.
- De oxidatie is meestal niet bedoeld, en voor de synthese, opslag en het handelen met de fosfines moeten speciale technieken worden ingezet om zuurstof uit te sluiten.
- Andere oxidator
- Als de gevoeligheid voor luchtzuurstof te klein is, bijvoorbeeld in difenylmethylfosfine, kan waterstofperoxide ingezet worden om de omzetting uit te voeren:[13]
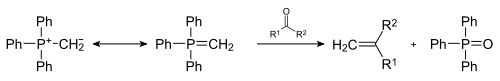
- Wittig-reatie
- Fosfineoxides ontstaan als bijbroduct van de Wittig-reactie:
- Thermolyse
- Een andere, hoewel niet gebruikelijke, manier om fosfineoxides te maken is de thermolyse van fosfoniumhydroxides:
- Hydrolyse
- De hydrolyse van fosfor(V)dihalides leidt ook tot het oxide:[14]
- Secondiare fosfineoxides
- Voor deze groep is de synthese mogelijk via de hydrolyse van het chloorfosfine:
Reductie[bewerken | brontekst bewerken]
Met de reductie van fosfineoxides wordt de reactie bedoeld waarbij het oxide wordt omgezet in het fosfine. Dit type reactie is uitvoerig bestudeerd, vooral omdat de fosfineoxides goed stabiele verbindingen zijn, maar de fosfines ook hun waardelvolle eigenschappen hebben. Tijdens de synthese kan het noodzakelijk of onvermijdelijk zijn dat het fosfine wordt omgezet in het oxide. Vooral voor tertiaire fosfineoxides is de terureactie onderzocht.
Voor het herstel van het fosfine is een goedkoop reagens nodig, vaak valt hierbij de keuze op silicium-houdende reagentia. De reacties kunnen in twee groepen verdeel worden:[15]
- stoichiometrische reacties
- Katalytische reacties
Stoichiometrische reacties[bewerken | brontekst bewerken]
In stoichiometrische reacties wordt het feitelijk reducerende reagens in een gelijk aantal mol gebruikt als het fosfineoxide. Trichloorsilaan is het standaard laboratorium reagens, industrieel wordt gebruik gemaakt van fosgeen waarmee trifenylfosfineoxide omgezet kan worden in chloortriphenylfosfoniumchloride, dat vervolgens gereduceerd wordt.[16]
Chirale fosfineoxides kunnen ontdaan worden van hun zuurstof atoom met behoud van de configuratie of met inversie. Klassiek vindt vooral inversie plaats als trichloorsilaan gecombineerd met tri-ethylamine wordt toegepast. Bij afwezigheid van van de Lewisbase vindt voornamelijk retentie plaatsvindt. [17]
De methode dankt zij populariteit aan de relatief lage prijs en goede beschikbaarheid van het trichloorsilaan.[Noot 1] Perchloorpolysilanen (hexachloordisilaan[Noot 2] en octachloortrisilaan[Noot 3] ) leiden in benzeen of chloroform zelf tot hogere opbrengsten. Bij deze reagentia wordt een siloxaan gevormd:
Het ontrekken van zuurstof aan de fosfineoxides is ook gelukt met behulp van boranen en alanen (Aluminiumhydrides).[15]
Katalytische reacties[bewerken | brontekst bewerken]
Bij het ontrekken van zuurstof aan de fosfineoxides spelen diësters van fosforzuur een katalytische rol in de reactie van het oxide met het hydrosilaan.[18]
Toepassingen[bewerken | brontekst bewerken]
Fosfineoxides worden als ligand toegepast in verschillende gevallen van homogene katalyse. In de coördinatiechemie zijn ze bekend om hun destabiliserende effect op koolstofmonoxide-liganden die in een cis-oriënatie staan ten opzichte van het fosfineoxide.
| Bronnen, noten en/of referenties
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Phosphine oxide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Noten in de tekst
Verwijzingen in de tekst
|
















![{\displaystyle {\ce {RPH(OH)\ ->[{\ce {[O]}}]\ RP(O)(OH)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45f389dfbb0db8e62bef8d83d86009c98149a486)




![{\displaystyle {\ce {[(C6H5)4P^{+}]Cl^{-}\ +\ NaOH\ ->[{\ce {\Delta }}]\ (C6H5)3P=O\ +\ NaCl\ +\ (C6H5)H}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a0788b1d8a9af758b0cf771bd3b8a0648b3a808)



![{\displaystyle {\ce {(C6H5)3P(O)\ +\ O=CCl2\ ->\ [(C6H5)3PCl^{+}]Cl^{-}\ +\ CO2\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c63132d206688b27d7debcdba8988af669c583f6)





