Oxalonitril
| Oxalonitril | ||||||
|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||||
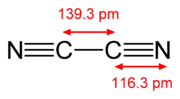
| ||||||
Structuurformule van oxalonitril
| ||||||
| Algemeen | ||||||
| Molecuulformule | C2N2 | |||||
| IUPAC-naam | ethaandinitril | |||||
| Andere namen | dicyaan, cyanogeen, oxaalzuurdinitril | |||||
| Molmassa | 52,0348 g/mol | |||||
| SMILES | C(#N)C#N
| |||||
| InChI | 1S/C2N2/c3-1-2-4
| |||||
| CAS-nummer | 460-19-5 | |||||
| EG-nummer | 207-306-5 | |||||
| PubChem | 9999 | |||||
| Wikidata | Q421724 | |||||
| Beschrijving | Brandbaar en giftig kleurloos gas | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H220-H331-H410 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | geen | |||||
| EG-Index-nummer | 608-011-00-8 | |||||
| VN-nummer | 1026 | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | gasvormig | |||||
| Kleur | kleurloos | |||||
| Dichtheid | (bij kookpunt) 0,95 g/cm³ | |||||
| Smeltpunt | −27,9 °C | |||||
| Kookpunt | −21,2 °C | |||||
| Dampdruk | (bij 20°C) 480.000 Pa | |||||
| Goed oplosbaar in | water | |||||
| log(Pow) | 0,07 | |||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Oxalonitril, ook wel aangeduid als dicyaan of cyanogeen, is een organische verbinding met als brutoformule C2N2. De stof komt voor als een kleurloos, zeer ontvlambaar en giftig gas met een kenmerkende prikkelende amandelgeur. Het is een pseudohalogeen. De molecule bestaat uit twee cyanidegroepen waarvan de koolstofatomen aan elkaar verbonden zijn.
Oxalonitril werd voor het eerst in zuivere toestand geïsoleerd door Louis Gay-Lussac in 1815, hoewel het wellicht al rond 1782 door Carl Wilhelm Scheele was gevormd tijdens zijn onderzoek naar waterstofcyanide.[1]
Synthese[bewerken | brontekst bewerken]
Oxalonitril kan via verschillende routes bereid worden. Een eerste methode is de oxidatie van waterstofcyanide met chloorgas bij een temperatuur rond 650 °C en met een katalysator zoals actieve kool of geactiveerd siliciumdioxide. Omdat dit zeer toxische en corrosieve gassen zijn moet er gespecialiseerde apparatuur gebruikt worden zoals een reactor in kwarts. De oxidatie van waterstofcyanide kan ook plaatsgrijpen met stikstofdioxide en een gepaste katalysator.[2]
Oxalonitril wordt gevormd wanneer een oplossing van kaliumcyanide of natriumcyanide gemengd wordt bij een oplossing van koper(II)sulfaat of koper(II)chloride. Hierbij wordt het zeer toxische koper(I)cyanide als nevenproduct gevormd:
Een andere mogelijkheid is de reactie van glyoxime met azijnzuuranhydride tot N,N'-diacetoxyglyoxime, dat dan op hoge temperatuur gepyrolyseerd wordt tot oxalonitril en azijnzuur.[3]
In het laboratorium kan oxalonitril verkregen worden door de thermische ontleding van kwik(II)cyanide:
Toepassingen[bewerken | brontekst bewerken]
Oxalonitril wordt gebruikt als reagens in diverse organische syntheses, waaronder die van geneesmiddelen en stikstofhoudende kunstmeststoffen zoals oxamide. Het kan met name gebruikt worden om een nitrilgroep in een verbinding te brengen.
Oxalonitril kan gebruikt worden voor de productie van oxaalzuur. Het reageert met waterstofgas tot ethyleendiamine.
Oxalonitril kan gepolymeriseerd worden door middel van elektropolymerisatie en verwerkt tot geleidende vezels.[4]
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Oxalonitril is een brandbaar gas. Het verbrandt met zuivere zuurstof met een zeer hete vlam (4300 à 4400 °C).[5] Bij verbranding komen er giftige gassen vrij, waaronder waterstofcyanide, koolstofmonoxide en stikstofoxiden. Het gas is 1,8 keer zo zwaar als lucht. Het vormt explosieve mengsels met lucht bij concentraties tussen ongeveer 4 en 37 volumeprocent.
Oxalonitril reageert hevig met sterk oxiderende stoffen, met gevaar op brand of explosie. Bij de reactie met zuren komen giftige gassen vrij, zoals waterstofcyanide.
Oxalonitril is irriterend voor de ogen en de luchtwegen en kan het centrale zenuwstelsel beïnvloeden. Dit kan leiden tot hoofdpijn, duizeligheid, ademhalingsstoornissen en bewusteloosheid. Blootstelling aan hoge concentraties kan dodelijk zijn.
Het gas lost goed op in water en is derhalve ook zeer toxisch voor in het water levende organismen.
Zie ook[bewerken | brontekst bewerken]
Externe links[bewerken | brontekst bewerken]
- (en) International Chemical Safety Card voor Cyanogen (internationale versie)
- (en) Gegevens van oxalonitril in de GESTIS-stoffendatabank van het IFA
Bronnen, noten en/of referenties
|






