Platina(VI)fluoride
| Platina(VI)fluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
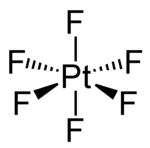
| ||||
Structuurformule van platina(VI)fluoride
| ||||
| Algemeen | ||||
| Molecuulformule | PtF6 | |||
| IUPAC-naam | platina(VI)fluoride | |||
| Andere namen | platinahexafluoride | |||
| Molmassa | 309,068419 g/mol | |||
| SMILES | [F-].[F-].[F-].[F-].[F-].[F-].[Pt]
| |||
| InChI | 1S/6FH.Pt/h6*1H;/p-6
| |||
| CAS-nummer | 13693-05-5 | |||
| PubChem | 3014771 | |||
| Wikidata | Q417309 | |||
| Beschrijving | Donkerrode kristallen | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | donkerrood | |||
| Dichtheid | (bij −140°C) 5,21 g/cm³ | |||
| Smeltpunt | 61,3 °C | |||
| Kookpunt | 69,1 °C | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | orthorombisch | |||
| Dipoolmoment | 0 D | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Platina(VI)fluoride (PtF6) is een fluoride van platina. De stof komt voor als donkerrode kristallen, die hevig reageren met water.
Synthese[bewerken | brontekst bewerken]
Platina(VI)fluoride kan bereid worden door een reactie van moleculair fluor en platina bij 300 °C:
Een alternatieve methode verloopt via de disproportionering van platina(V)fluoride bij 130 °C:
Kristalstructuur[bewerken | brontekst bewerken]
Platina(VI)fluoride neemt een octaëdrische structuur aan, in overeenstemming met de VSEPR-theorie. Het bezit een orthorombisch kristalstelsel en behoort tot ruimtegroep Pnma. De parameters van de eenheidscel bedragen (gemeten bij −140 °C):[1]
- a = 937,4 pm
- b = 852,7 pm
- c = 493,3 pm
De bindingslengte Pt-F bedraagt 184,8 pm.[1]
Eigenschappen[bewerken | brontekst bewerken]
Platina(VI)fluoride staat bekend als een extreem sterke oxidator: het is in staat om zelfs moleculair zuurstof en xenon te oxideren. Hierbij wordt platina zelf gereduceerd van Pt(VI) tot Pt(V). Platina(VI)fluoride heeft in deze context in de jaren '60 van de 20e eeuw een prominente rol gespeeld in het onderzoek naar het bestaan van verbindingen met edelgassen. De Amerikaanse scheikundige Neil Bartlett ontdekte in 1962 de oxiderende werking van platina(VI)fluoride op zuurstof:
Hij stelde vast dat de eerste ionisatie-energie van dizuurstof (1175 kJ/mol) vergelijkbaar is met die van xenon en dat het ontstane dioxygenyl-kation (O2+) een vergelijkbare grootte heeft als het xenonium-kation (Xe+). Zo kwam Bartlett ertoe dat ook xenon kan geoxideerd worden door platina(VI)fluoride:
Dit wordt beschouwd als de eerste edelgasverbinding. Bovendien werd de aanname dat edelgassen geen verbindingen kunnen aangaan toen van tafel geveegd.
Bronnen, noten en/of referenties
|




