Barbituurzuur
| Barbituurzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
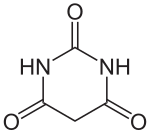
Structuurformule van barbituurzuur
| ||||

| ||||
Molecuulmodel van barbituurzuur
| ||||
| Algemeen | ||||
| Molecuulformule | C4H4N2O3 | |||
| IUPAC-naam | pyrimidine-2,4,6(1H,3H,5H)-trion | |||
| Andere namen | malonylureum, 6-hydroxyuracil | |||
| Molmassa | 128,08616 g/mol | |||
| SMILES | C1C(=O)NC(=O)NC1=O
| |||
| InChI | 1S/C4H4N2O3/c7-2-1-3(8)6-4(9)5-2/h1H2,(H2,5,6,7,8,9)
| |||
| CAS-nummer | 67-52-7 | |||
| EG-nummer | 200-658-0 | |||
| PubChem | 6211 | |||
| Wikidata | Q410278 | |||
| LD50 (ratten) | (peroraal) > 5000 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Smeltpunt | 250–252 °C | |||
| Kookpunt | 260 °C | |||
| Oplosbaarheid in water | (bij 20 °C) 142 g/L | |||
| Matig oplosbaar in | water | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Barbituurzuur is een organische verbinding met als brutoformule C4H4N2O3. Het is structureel afgeleid van pyrimidine. De stof komt voor als witte kristallen, die matig oplosbaar zijn in water. De verbinding werd op 4 december 1864 ontdekt door Adolf von Baeyer. De dag van de ontdekking werd tevens de naam van de stof: 4 december is immers het naamfeest van de heilige Barbara van Nicomedië. Volgens andere bronnen werd de stof vernoemd naar Barbara van Celje.
Synthese[bewerken | brontekst bewerken]
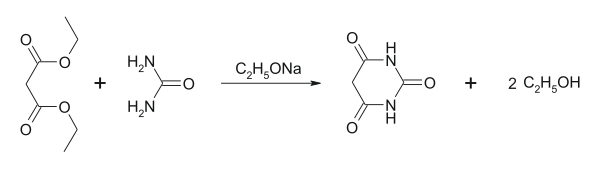
Barbituurzuur kan eenvoudigweg bereid worden door een condensatiereactie van malonzuur en ureum. Tegenwoordig wordt vaak di-ethylmalonaat gebruikt in plaats van malonzuur, omdat het zuur karakter van de tweede carboxylgroep een onvolledige synthese kan veroorzaken:
Eigenschappen[bewerken | brontekst bewerken]
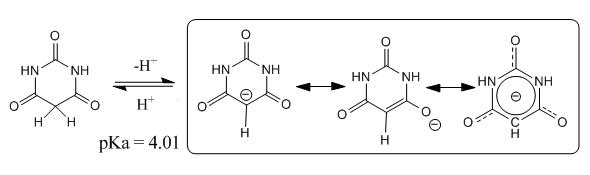
Het waterstofatoom op het α-koolstofatoom in de ring is relatief zuur (pKa = 4,01) voor een diketon. De oorzaak ligt in de stabilisatie van het carbanion dat ontstaat na deprotonering: de negatieve lading kan immers niet alleen op de zuurstofatomen van de naburige carbonylgroepen gelokaliseerd worden, maar ook nog op de stikstofatomen.
Toepassingen[bewerken | brontekst bewerken]
Derivaten van barbituurzuur worden barbituraten genoemd. Deze worden hoofdzakelijk als slaap- en kalmeringsmiddel aangewend. Barbituurzuur wordt bijgevolg vaak als uitgangsstof voor de synthese van barbituraten gebruikt. Hiervoor wordt meestal de Knoevenagel-condensatie aangewend.