IUPAC-nomenclatuur
Uitleg: De nieuwe aanbevelingen uit 2013 zijn niet of slechts zeer gedeeltelijk doorgevoerd. Veel voorbeelden zijn verouderd.
De IUPAC-nomenclatuur is een systematische manier om elementen en chemische verbindingen van een naam te voorzien. De regels voor deze systematische naamgeving worden opgesteld door de International Union of Pure and Applied Chemistry (IUPAC). Vooral in de organische chemie kent het systeem veelvuldig gebruik, maar ook in de anorganische chemie wordt de nomenclatuur gebruikt.
In de IUPAC-nomenclatuur wordt onderscheid gemaakt tussen elementen, organische stoffen (zoals koolwaterstoffen) en anorganische stoffen (zoals zouten). Binnen de IUPAC-nomenclatuur zijn er overkoepelde regels, maar ieder groep van stoffen kent ook eigen regels.
Algemene regels
[bewerken | brontekst bewerken]Telwoorden
[bewerken | brontekst bewerken]De IUPAC-naamgeving maakt in alle groepen van stoffen gebruik van telwoorden (ook wel: prefix). Met deze telwoorden worden aantallen atomen of atoomgroepen binnen een molecuul aangegeven. De telwoorden kennen hun oorsprong uit het Grieks of Latijn. De eerste twaalf telwoorden zijn hieronder weergegeven.
| Telwoord (prefix) | Betekenis |
|---|---|
| mono | 1 |
| di | 2 |
| tri | 3 |
| tetra | 4 |
| penta | 5 |
| hexa | 6 |
| hepta | 7 |
| octa | 8 |
| nona | 9 |
| deca | 10 |
| undeca | 11 |
| dodeca | 12 |
Koppeltekens
[bewerken | brontekst bewerken]Een overige algemene IUPAC-regel met betrekking tot het gebruik van koppeltekens luidt: “Ter verduidelijking mag een koppelteken geplaatst worden tussen twee klinkers die bij een verschillende naamonderdeel horen.” Tussen telwoorden en atoom- of ionnamen mag dus een koppel teken worden geplaats. De naam di-ijzertri-oxide en diijzertrioxide zijn chemische gezien dus gelijk. Het is echter gewenst een koppelteken te plaatsen tussen het telwoord di en de atoomnaam ijzer, omdat er anders een misvatting kan plaatsvinden over de uitspraak van de naam. Ditzelfde geldt voor di-jood en dijood.
Bepalen van de stamnaam en plaatsnummers
[bewerken | brontekst bewerken]In de organische chemie wordt de stamnaam van een koolwaterstof altijd zo gekozen, dat de langste keten van aaneengesloten koolstofatomen de hoofdketen vormt. In de onderstaande afbeelding is hierover een voorbeeld te zien. De structuurformule krijgt de stam naam hexaan omdat de langste keten zes koolstofatomen bevat. Daarnaast wordt het plaatsnummer van een zijgroep, substituent of karakteristieke groep altijd zo gekozen dat de laagste som van de plaatsnummers wordt bereikt. Hierover is een voorbeeld voor 2-broomhexaan weergegeven.

Elementen
[bewerken | brontekst bewerken]De naam een chemisch element wordt bepaald door de atoomsoort waar het element uit bestaat. In de meeste gevallen is de naam van het element hetzelfde als de naam van het atoom. Voorbeelden van zulke stoffen zijn: helium, ijzer en koolstof. Sommige elementen komen echter voor als meer-atomige moleculen. Deze elementen krijgen een telwoord (prefix) vóór hun naam om het aantal atomen in het molecuul aan te geven. Deze uitzonderingen zijn in de onderstaande tabel weergegeven.
| Formule | IUPAC-naam |
|---|---|
| H2 | diwaterstof |
| O2 | dizuurstof |
| N2 | distikstof |
| F2 | difluor |
| Br2 | dibroom |
| I2 | di-jood |
| Cl2 | dichloor |
| S8 | octazwavel |
| P4 | tetrafosfor |
Organische chemie
[bewerken | brontekst bewerken]Koolwaterstoffen
[bewerken | brontekst bewerken]Alkanen
[bewerken | brontekst bewerken]
Koolwaterstoffen die geen dubbele bindingen tussen koolstofatomen bevatten, worden alkanen genoemd. Als alle koolstofatomen op één lijn liggen, wordt het alkaan lineair genoemd. De naam van een lineair alkaan wordt bepaald door een stamnaam en een achtervoegsel. Het achtervoegsel voor alkanen is -aan. De stamnaam wordt bepaald door het aantal koolstofatomen dat zich in de langste aaneengesloten keten van koolstofatomen bevindt. De verschillende stamnamen zijn hieronder weergegeven. Alkanen behoren tot de verzadigde koolwaterstoffen. De eerst vijf simpele alkanen zijn hiernaast weergegeven.
| Aantal koolstofatomen | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| stamnaam | meth | eth | prop | but | pent | hex | hept | oct | non | dec | undec | dodec |
Alkenen
[bewerken | brontekst bewerken]Koolwaterstoffen die één of meerdere dubbele binding tussen koolstofatomen bevatten worden alkenen genoemd. De naam van een lineair alkeen wordt bepaald door een stamnaam en een achtervoegsel. Het achtervoegsel voor alkenen is -een. Net als bij alkanen wordt de stamnaam bepaald door het aantal koolstofatomen in de langste aaneengesloten keten. Alkenen behoren tot de onverzadigde koolwaterstoffen.
Bij alkanen dient de locatie van de dubbele binding aangegeven te worden in de naam. Dit wordt gedaan door het plaatsnummer van het laagste koolstofatoom te noteren tussen de stamnaam en het achtervoegsel. Hierbij komt de laatste klinker van de stamnaam vaak te vervallen. Als voorbeeld is de structuurformule van pent-1-een en pent-2-een weergegeven.

Als er meerdere dubbele bindingen tussen koolstofatomen aanwezig zijn, dient naast de locatie van iedere dubbele binding, ook de totale hoeveelheid dubbele bindingen aangegeven te worden. Dit wordt gedaan door een telwoord te plaatsen vóór het achtervoegsel. Als voorbeeld is de structuurformule van but-1,2-dieen en but-1,3-dieen weergegeven.

Als de plaatsing van een dubbele binding slechts op één enkele locatie mogelijk is, hoeft de locatie van de dubbele binding niet aangegeven te worden. Als voorbeeld is de structuurformule van etheen en propadieen weergegeven.

Bij alkenen kan isomerie optreden. De dubbele binding tussen koolstofatomen zorgt er namelijk voor de atomen niet vrij kunnen draaien om hun bindingsas. Dat maakt dat er Z/E-isomeren kunnen ontstaan. De Z staat hier voor het Duitse woord zusammen (vertaling: samen) en de E voor entgegen (vertaling: tegenovergesteld). Als voorbeeld is de structuurformule van Z-but-2-een en E-but-2-een. Zie voor de volledige uitwerking van dit fenomeen het artikel cis-trans-isomerie.

Alkynen
[bewerken | brontekst bewerken]Koolwaterstoffen die één of meerdere driedubbele binding tussen koolstofatomen bevatten worden alkynen genoemd. De naam van een lineair alkyn wordt bepaald door een stamnaam en een achtervoegsel. Het achtervoegsel voor alkenen is -yn. Net als bij alkanen wordt de stamnaam bepaald door het aantal koolstofatomen in de langste aaneengesloten keten. Alkynen behoren tot de onverzadigde koolwaterstoffen.
Bij alkynen dient de locatie van de driedubbele binding aangegeven te worden in de naam. Dit wordt gedaan door het plaatsnummer van het laagste koolstofatoom te noteren tussen de stamnaam en het achtervoegsel. Hierbij komt de laatste klinker van de stamnaam vaak te vervallen. Als voorbeeld is de structuurformule van pent-1-yn en pent-2-yn weergegeven.

Als er meerdere driedubbele bindingen tussen koolstofatomen aanwezig zijn, dient naast de locatie van iedere dubbele binding, ook de totale hoeveelheid driedubbele bindingen aangegeven te worden. Dit wordt gedaan door een telwoord te plaatsen vóór het achtervoegsel. Als voorbeeld is de structuurformule van pent-1,3-diyn, pent-1,4-diyn en hex-1,3,5-triyn weergegeven.

Als de plaatsing van een driedubbele binding slechts op een enkele locatie mogelijk is, hoeft de locatie van de driedubbele binding niet aangegeven te worden. Als voorbeeld is de structuurformule van ethyn en propyn weergegeven.

Cyclische verbindingen
[bewerken | brontekst bewerken]Als er in een koolwaterstof een cyclische groep van koolstofatomen voorkomt, wordt deze op eenzelfde manier benoemd als het desbetreffende alkaan, alkeen of alkyn, maar wordt hier het voorvoegsel cyclo- aan toegevoegd. Het koolwaterstof met zes koolstofatomen en geen dubbele bindingen tussen de koolstofatomen, die op een cyclische manier met elkaar zijn verbonden wordt dus cyclohexaan genoemd. Als voorbeeld in de structuurformule van cyclopropaan, cyclobutaan, cyclopentaan weergegeven.

Als er een dubbele of drie dubbele binding voorkomt in het cyclische koolwaterstof, gelden er dezelfde regels als bij lineaire alkenen en alkynen: de locatie van de dubbele binding moet worden aangegeven en bij meerdere dubbele bindingen dient het totaal aantal dubbele bindingen aangegeven te worden met een telwoord. Als de dubbele binding slechts op één manier geplaats kan worden, hoeft ook hier de locatie niet aangegeven te worden. Als voorbeeld is de structuurformule van cyclohexeen, cyclohexyn, cyclopent-1,3-dieen en cyclohex-1,3,5-trieen weergegeven. Deze laatste wordt ook wel benzeen genoemd.

In het geval van benzeen wordt de isomerie van zijgroepen aangeven met de voorvoegsels ortho-, meta- en para-. Deze benaming geeft de relatieve positie tussen zijgroepen weer. Als voorbeeld in de structuurformule van ortho-dimethylbenzeen, meta-dimethylbenzeen en para-dimethylbenzeen weergegeven.

Omdat de IUPAC-naam van cyclische verbinding snel complex en lang kan worden, zijn binnen de IUPAC-nomenclatuur veel algemenere namen zoals fenol, furaan, xyleen en indool ook geaccepteerd.
Vertakkingen
[bewerken | brontekst bewerken]In de structuurformule van een koolwaterstof kan zich naast de hoofdketen een groep van koolstof- en waterstofatomen in een zijketen bevinden. Als een koolwaterstof één of meerdere van zulke zijgroepen bevat, wordt dit een vertakt koolwaterstof genoemd. Zijgroepen worden als voorvoegsel vóór de naam van het respectievelijke lineaire koolwaterstof geschreven. De naam van een zijgroep wordt bepaald door een stamnaam en het achtervoegsel -yl. Een zijgroep met één koolstofatoom wordt dus methyl genoemd. De locatie van de zijgroep moet worden aangegeven met een plaatsnummer. Als er meerdere zijgroepen met hetzelfde aantal koolstofatomen aanwezig zijn wordt voor ieder van deze zijgroepen de locatie aangegeven en wordt met een telwoord het totaal aantal zijgroepen van dezelfde soort aangegeven. Als er meerdere zijgroepen met een ander aantal koolstofatomen aanwezig is, worden deze in alfabetische volgorde in de IUPAC-naam vermeld. In de figuur is een zevental voorbeelden van vertakten alkanen en alkenen weergegeven. Hierin is met kleuren aangegeven welke groep voor welk naamdeel zorgt.

Functionele groepen
[bewerken | brontekst bewerken]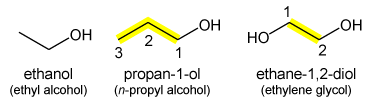
Bij alcoholen (R-OH) wordt het achtervoegsel "-ol" toegevoegd aan de alkaan-stamnaam met een plaatsnummer voor de positie van de -OH groep: CH3CH2CH2OH is propaan-1-ol. Methanol en ethanol zijn ondubbelzinnig en behoeven geen plaatsnummer. De achtervoegsels -diol, -triol, -tetraol, etc. worden gebruikt voor meerdere -OH-groepen: etheenglycol CH2OHCH2OH is ethaan-1,2-diol.

Als een karakteristieke groep met een hogere rangorde aanwezig is (zie rangorde van groepen hieronder), wordt het voorvoegsel "hydroxy" gebruikt, met zo nodig de bijbehorende positie: CH3CHOHCOOH is 2-hydroxypropaanzuur.
Halogeenverbindingen
[bewerken | brontekst bewerken]
Halogenen krijgen als voorvoegsel het betreffende plaatsnummer en fluor, chloor, broom, jood, afhankelijk van het halogeen. Wanneer er meer dan een van hetzelfde halogeenatoom aanwezig is, worden de voorvoegsels di-, tri-, etc. gebruikt. CHCl3 (chloroform) is trichloormethaan. Verschillende halogeenatomen worden zoals altijd op alfabetische volgorde geplaatst, zonder daarbij op di-, tri- te letten. Het verdovingsmiddel CF3CHBrCl is 2-broom-2-chloor-1,1,1-trifluorethaan.

Ketonen (R-CO-R') krijgen het achtervoegsel "-on" en vooraan eventueel een plaatsnummer: CH3COCH3 (aceton) is propaan-2-on of gewoon propanon. Als reeds een achtervoegsel voor een andere groep met een hogere rangorde werd gebruikt, wordt de groep C=O niet met een achtervoegsel aangeduid, maar met het voorvoegsel "oxo": CH3CH2CH2COCH3CHO is 3-oxohexanal.

Aldehyden (R-CHO) krijgen het achtervoegsel "-al". Een positienummer is meestal niet nodig - indien de aldehydegroep de hoogste rangorde heeft - daar een aldehyde zich altijd aan een uiteinde van de koolstofketen bevindt: HCHO (formaldehyde) is methanal, CH3CHO (aceetaldehyde) is ethanal. Heeft de aldehydegroep niet de hoogste rangorde dan is een positienummer soms wel noodzakelijk. Als er geen andere groepen aanwezig zijn wordt de koolstofketen zo genummerd dat het koolstofatoom van de aldehydegroep nummer "1" heeft.
Als de voorvoegselvorm vereist is, wordt "oxo" gebruikt (zoals soms ook bij ketonen), met eventueel het plaatsnummer: CHOCH3COOH is 3-oxopropaanzuur. Als het koolstofatoom van de aldehydegroep geen onderdeel is van de hoofdketen (bijvoorbeeld in het geval van cyclische aldehyden), wordt het voorvoegsel "formyl" of het achtervoegsel "carbaldehyde" gebruikt: C6H11CHO is cyclohexaancarbaldehyde.

Carbonzuren (R-COOH) krijgen het achtervoegsel "zuur". Het C-atoom van de zuurgroep wordt nummer "1" van de keten en een plaatsnummer is niet nodig. Bijvoorbeeld HCOOH (mierenzuur) is methaanzuur, CH3COOH (azijnzuur) is ethaanzuur.
Als er twee carboxylgroepen zijn in dezelfde keten, wordt het achtervoegsel "-dizuur". Bij drie of meer carboxylgroepen wordt het achtervoegsel "-carbonzuur" gebruikt. In deze gevallen tellen de koolstofatomen van de carboxylgroepen COOH niet mee als onderdeel van de hoofdketen. Hetzelfde geldt voor het voorvoegsel "carboxyl", dat soms wordt gebruikt. Citroenzuur is een voorbeeld; het heet 2-hydroxypropaan-1,2,3-tricarbonzuur, niet 2-carboxy-2-hydroxypentaandizuur.

Ethers (R-O-R') bestaan uit een zuurstofatoom verbonden met twee koolstofketens. De kortste van de 2 ketens bepaalt het eerste deel van de naam, met achtervoegsel "-oxy", de langste koolstofketen bepaalt de stamnaam van de ether. Dus CH3OCH3 is methoxymethaan en CH3OCH2CH3 is methoxyethaan (niet ethoxymethaan). Als het zuurstofatoom niet verbonden is aan het eind van de hoofdketen van de alkaan, dan wordt de kortere alkyl-plus-ether groep behandeld als een zijketen en voorafgegaan door de positie in de hoofdketen. Dus CH3OCH(CH3)2 is 2-methoxypropaan.
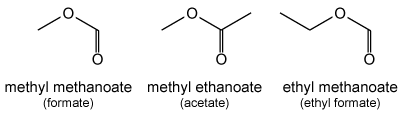
Esters (R-CO-O-R') worden benoemd met het achtervoegsel "-oaat" achter de alkaannaam voor R. Daarvóór komt de naam van de alkylgroep R'. Dus HCOOCH3 (methylformiaat) is methylmethanoaat, CH3COOCH3 (methylacetaat) is methylethanoaat en HCOOCH2CH3 (ethylformiaat) is ethylmethanoaat.
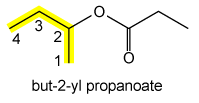
De alkylgroep R' kan ook vertakt zijn: CH3CH2CH(CH3)OCOCH2CH3 is (1-methylpropyl)propanoaat.

Aminen (R-NH2) worden genoemd naar het overeenkomstige alkaan met het achtervoegsel "-amine" (bijvoorbeeld CH3NH2 methaanamine). Indien nodig wordt de positie van de aminogroep NH2 vooraan toegevoegd: CH3CH2CH2NH2 1-propaanamine, CH3CHNH2CH3 2-propaanamine. Het voorvoegsel "amino" wordt gebruikt als in het molecuul nog een karakteristieke groep met een hogere rangorde aanwezig is.
Bij secundaire aminen (met de vorm R-NH-R') bepaalt de langste koolstofketen aan het stikstofatoom de stamnaam van het amine; de andere keten wordt voorgevoegd als een alkylgroep met als plaats-voorvoegsel een schuingeschreven N: CH3NHCH2CH3 is N-methylethaanamine. Tertiaire aminen (R-NR'-R") worden op dezelfde manier behandeld: CH3CH22N(CH3)CH2CH2CH3 is N-methyl-N-ethylpropaanamine.
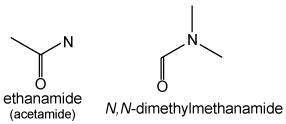
Amiden (R-CO-NH2) krijgen het achtervoegsel "-amide". Er bestaat geen vorm voor een voorvoegsel en er is geen plaatsnummer nodig, aangezien amiden altijd de koolstofketen afsluiten, bijvoorbeeld CH3CONH2 (aceetamide) is ethaanamide.
Secundaire en tertiaire amiden worden op dezelfde manier behandeld als aminen: alkylgroepen aan het stikstofatoom worden behandeld als substituenten met als plaatsvoorvoegsel N: HCON(CH3)2 is N,N-dimethylmethaanamide (dimethylformamide).
Cyclische verbindingen
[bewerken | brontekst bewerken]
Cycloalkanen en aromatische verbindingen kunnen worden behandeld als de hoofdketen van de chemische stof, waarbij de positie van de substituties worden genummerd rond de ringstructuur. Bijvoorbeeld de 3 isomeren xyleen CH3C6H4CH3, algemeen de ortho-, meta-, en para- vormen, zijn 1,2-dimethylbenzeen, 1,3-dimethylbenzeen en 1,4-dimethylbenzeen. De cyclische structuren kunnen zelf ook worden beschouwd als karakteristieke groepen, waarvan de namen als voorvoegsel "cycloalkyl" (bijvoorbeeld "cyclohexyl") of voor benzeen, "fenyl" luiden.
Het schema van de IUPAC-nomenclatuur wordt snel erg uitgebreid voor complexere moleculen waardoor veel algemene namen zoals fenol, furaan, indool, etc. worden geaccepteerd als stamnamen voor stoffen die daar van afgeleid zijn.
Rangorde van functionele groepen
[bewerken | brontekst bewerken]Als koolstofverbindingen meer dan een karakteristieke groep bevatten, bepaalt de rangorde welke groep als achtervoegsel en welke groep(en) als voorvoegsel worden genoemd. De hoogste rangorde bepaalt het achtervoegsel, alle anderen worden als voorvoegsel genoemd. De naam krijgt slechts één achtervoegsel. Uitzondering: dubbele en drievoudige bindingen worden ook als 'groep' beschouwd en worden alleen als achtervoegsel genoemd.
Karakteristieke groepen die met voorvoegsels worden aangegeven, worden op alfabetische volgorde geplaatst (eventuele numerieke voorvoegsels zoals di-, tri-, etc. tellen hiervoor niet mee), bijvoorbeeld chloorfluormethaan, niet fluorchloormethaan. Als er meer identieke groepen voorkomen, zijn de plaatsnummers oplopend (dus 1,2-ethaandiol, niet 2,1-ethaandiol.) De N positie-indicatie voor aminen en amiden komt voor "1", bijvoorbeeld CH3CH(CH3)CH2NH(CH3) is N,2-dimethylpropaanamine.
| Volgorde | Groep | Formule | Achtervoegsel | Voorvoegsel |
|---|---|---|---|---|
| 1 | Carbonzuur | R-COOH | -zuur | carboxy |
| 2 | Ester | R-CO-O-R | -oaat | alkoxycarbonyl of fenoxycarbonyl |
| 3 | Amide | R-CONH2 | -amide | aminocarbonyl |
| 4 | Cyanide | R-CN | -nitril | cyano |
| 5 | Aldehyde | R-CHO | -al | formyl (als het op de hoofdketen staat) of oxo (als het deel van de hoofdketen is) |
| 6 | Keton | R-CO-R | -on | oxoalkyl (als het op de hoofdketen staat) of oxo (als het deel van de hoofdketen is) |
| 7 | Alcohol | R-OH | -ol | hydroxy |
| 8 | Thiol | R-SH | -thiol | mercapto |
| 9 | Amine | R-NH2 | -amine | amino |
| 10 | Ether | R-O-R | -ether | oxy |
| 11 | Halogeenverbinding | R-X | — | halogeen |
Anorganische chemie
[bewerken | brontekst bewerken]Binaire verbindingen
[bewerken | brontekst bewerken]
Stoffen die uit twee atoomsoorten bestaan worden binaire verbinding genoemd. Deze stoffen krijgen een naam op basis van de atomen waar ze uit bestaat. Welke naam als laatste vermeld moet worden, is weergegeven in de figuur hiernaast. Daarnaast krijgt het laatst geschreven atoom vaak de uitgang -ide. Het aantal atomen in een binaire verbinding wordt aangegeven met een telwoord (prefix) dat vóór de atoomnaam wordt geplaatst. Het telwoord voor één (mono) wordt hier vaak weggelaten. Uitzondering hierop zijn de verbindingen die in hun formule eindigen op een enkel zuurstofatoom, zoals CO en NO. Bij deze verbindingen wordt een koppelteken geplaatst tussen het telwoord en de atoomnaam. Enkele voorbeelden van binaire verbindingen en hun IUPAC-naam zijn in de onderstaande tabel weergegeven.
| Formule | IUPAC-naam |
|---|---|
| CO2 | koolstofdioxide |
| N2O | distikstofmono-oxide |
| H2O2 | diwaterstofdioxide (of: waterstofperoxide) |
| FeCl2 | ijzerdichloride (of: ijzer(II)chloride) |
| FeCl3 | ijzertrichloride (of: ijzer(III)chloride) |
| CaF2 | calciumdifluoride (of: calciumfluoride) |
| CO | koolstofmono-oxide |
| NO | stikstofmono-oxide |
| GaAs | galliumarsenide |
| HCl | waterstofchloride |
Samengestelde en complexe ionen
[bewerken | brontekst bewerken]Zouten die bestaan uit samengestelde en complexe ionen, krijgen een eigen telwoord. De verschillen tussen de reguliere telwoorden en complexe telwoorden zijn hieronder weergegeven. Het enkelvoudige telwoord wordt gebruikt om het aantal enkelvoudige ionen weer te geven. Het complexe telwoord wordt gebruikt om het aantal samengestelde ionen weer te geven. Als er een overgangsmetaal voorkomt in het zout, wordt de lading van het metaalion doorgaans niet vermeld. In sommige gevallen levert dit echter onduidelijkheden op. Bijvoorbeeld wanneer er meerdere ionen van dezelfde atoomsoort met verschillende ladingen voorkomen in een zout. In die gevallen wordt de lading van het metaalion tussen haakjes weergegeven. Een voorbeeld van zo’n stof is het zout dat uit ijzer-ionen met een lading van 2+ en 3+ en daarnaast uit oxide-ionen bestaat: Fe3O4. De IUPAC-naam van deze stof luidt: ijzer(2+)di-ijzer(3+)tetra-oxide.
| Nummer | Eenvoudig telwoord | Complex telwoord |
|---|---|---|
| 1 | mono | - |
| 2 | di | bis |
| 3 | tri | tris |
| 4 | tetra | tetrakis |
| 5 | penta | pentakis |
| 6 | hexa | hexakis |
| 7 | hepta | heptakis |
| 8 | octa | octakis |
| 9 | nona | nonakis |
| 10 | deca | decakis |
| 11 | undeca | undecakis |
| 12 | dodeca | dodecakis |
Als een samengesteld ion meer dan één keer voorkomt in de verhoudingsformule wordt deze in de IUPAC-naam tussen haakjes weergegeven. Vóór de naam van het samengestelde ion wordt het complexe telwoord geschreven. De haakjes worden weergegeven om duidelijk verschil te maken tussen het aantal ionen in de verhoudingsformule en het aantal atomen in het ion. Zo krijgt het zout dat bestaat uit Fe3+-ionen en I3--ionen de naam: ijzertris(tri-jodide). Hierbij geeft het enkelvoudige telwoord tri aan dat het I3--ion uit drie joodatomen bestaat. Het complexe telwoord tris geeft aan dat er drie I3--ionen aanwezig zijn in de verhoudingsformule.
In sommige gevallen kan het voorkomen dat het niet duidelijk is welke lading het positieve en negatieve ion hebben. Dit komt vooral voor bij O22--ionen en O2--ionen. De formule Pb(O2)2 kan namelijk verwijzen naar het zout dat bestaat uit Pb4+-ionen en O22--ionen of naar het zout dat bestaat uit Pb2+-ionen en O2--ionen. Daarom wordt in deze gevallen de lading van het positieve en negatieve ion aangegeven. De respectievelijke namen zijn dan: lood(4+)bis(dioxide(2-)) en lood(2+)bis(dioxide(1-)). Meer voorbeelden van IUPAC-namen van stoffen die bestaan uit complexe-ionen zijn hieronder weergegeven.
| Formule | IUPAC-naam |
|---|---|
| Na2CO3 | dinatriumcarbonaat |
| Ca3(PO4)2 | calciumbis(fosfaat) |
| CaP2O7 | calciumdifosfaat |
| BaO2 | barium(2+)dioxide(2-) |
| PCl3O | fosfortrichlorideoxide |
| NaI3 | natriumtri-jodide |
| FeI3 | ijzertris(jodide) |
| Fe(I3)3 | ijzertris(tri-jodide) |
| Os(CO3)4 | osmiumtetrakis(carbonaat) |
| H3PO4 | triwaterstoffosfaat (of: fosforzuur) |
| H2SO4 | diwaterstofsulfaat (of: zwavelzuur) |
| (NH4)3PO4 | tris(ammonium)fosfaat |
Hydraten en coördinatie chemie
[bewerken | brontekst bewerken]Zouthydraten en complexen worden op eenzelfde manier voorzien van een naam als overige zouten. Om kristalwater aan te gegeven wordt er “-water” achter de naam van het zout geplaatst. De verhouding tussen het zout en het kristalwater wordt weergegeven met getallen die tussen haakjes staan. Zo krijgt het hydraat van magnesiumsulfaat (MgSO4∙7H2O) de IUPAC-naam: magnesiumsulfaat-water (1/7). Dit betekent dus dat één eenheid magnesiumsulfaat, zeven eenheden kristalwater heeft opgenomen.
Ditzelfde geldt voor complexen. Het complex tussen cadmiumsulfaat en ammoniak (CdSO4∙6NH3) krijgt de IUPAC-naam: cadmiumsulfaat-ammoniak (1/6). Als een samengestelde stof uit meerdere zouten is opgebouwd, wordt ook bij deze stoffen de verhouding aangegeven. Zo krijgt Al2(SO4)3∙K2SO4∙24H2O de IUPAC-naam: dialuminiumtris(sulfaat)-dikaliumsulfaat-water(1/1/24).
Overige toegestane naamgevingen
[bewerken | brontekst bewerken]De eerder genoemde naamgevingen voor anorganische verbindingen berusten op een aanpassing van de IUPAC-regels die is ingegaan in 2015. In veel vakliteratuur komt echter nog de oude naamgeving voor. Deze naamgeving is nog steeds toegestaan door de IUPAC, maar de nieuwe vorm heeft de voorkeur. In de oude naamgeving worden bij zouten geen telwoorden gebruikt. In gevallen dat een verhoudingsformule bij meerdere namen zou kunnen horen, wordt de lading van het overgangsmetaal aangegeven met een Romeins cijfer. De nieuwe IUPAC-naam di-ijzertrioxide mag dus nog steeds ijzer(III)oxide worden genoemd.
Triviale namen
[bewerken | brontekst bewerken]Naast de IUPAC-nomenclatuur worden er in het dagelijks leven vaak andere namen voor stoffen gebruikt. Deze namen worden triviale namen genoemd. De praktische toepassing van triviale namen maakt vooral het spreken over moeilijk stoffen makkelijker. Een IUPAC-naam is soms namelijk erg lang, wat de gesproken communicatie niet ten goede komt.
Zie ook
[bewerken | brontekst bewerken]Externe link
[bewerken | brontekst bewerken]- ↑ (en) Hartshorn, R.M., Hellwich, K.H., Andrey Y., Damhus, T., Hutton, A.T. (29 July). Brief guide to the nomenclature of inorganic chemistry. Pure and Applied Chemistry 87 2015. DOI:10.1515/pac-2014-0718.

