Neutron
| Neutron | ||
|---|---|---|

| ||
Neutron bestaande uit quarks (paars) en gluonen (rood)
| ||
| Samenstelling | 1 upquark, 2 downquarks | |
| Interactiekrachten | Zwakke, sterke, elektromagnetische kracht en gravitatiekracht | |
| Symbool | n, n0 | |
| Antideeltje | Antineutron | |
| Ontdekt | James Chadwick (1932) | |
| Massa | 1,67493 × 10−27 kg 939,565 MeV/c2 1,008665 u | |
| Vervalt naar | of anders | |
| Elektrische lading | 0 e | |
| Spin | ½ | |

Een neutron is een subatomair deeltje zonder elektrische lading dat voorkomt in atoomkernen. Het is opgebouwd uit drie quarks, namelijk twee downquarks en een upquark. Alle atoomkernen op een na bevatten naast een of meer protonen ook een of meer neutronen. De enige uitzondering is protium (1H, de meest voorkomende vorm van waterstof), waarvan de kern uit alleen één proton bestaat. De massa van het neutron is vrijwel gelijk aan die van het proton (het neutron is iets zwaarder), maar het neutron mist de positieve lading van het proton.
Ontdekking
[bewerken | brontekst bewerken]In 1920 had Ernest Rutherford gespeculeerd over het mogelijke bestaan van het neutron. Hij had een ongelijkheid gevonden tussen het atoomnummer en de atoommassa. Aanvankelijk werd dit verschil verklaard door aan te nemen dat de ontbrekende elektronen door protonen uit de kern waren geabsorbeerd en dus een neutrale proton-elektronconfiguratie vormden.
Rutherfords visie viel in 1927 in duigen. De wiskundige Paul Dirac verklaarde, als uitvloeisel van de kwantummechanica, dat zowel het proton als het elektron bleken rond te tollen en altijd met dezelfde snelheid. Op basis van wat nu bekendstaat als de 'stikstofanomalie' werd duidelijk dat een neutron geen combinatie van deze twee deeltjes kon zijn. Metingen lieten zien dat een stikstofatoom uit een even aantal ronddraaiende samengestelde deeltjes moest bestaan, maar massametingen bewezen dat er een oneven aantal 'neutronen' aanwezig waren. Het plaatje van Rutherford van de proton-elektronconfiguratie voldeed niet aan de feiten.
In 1931 ontdekten Walther Bothe en Herbert Becker van de universiteit van Heidelberg dat bij beschieting van beryllium met sterk energetische alfadeeltjes er een ongewoon doordringende straling werd geproduceerd. In eerste instantie werd gedacht dat dit gammastraling was, ondanks dat deze doordringender was dan gammastraling. De volgende belangrijke bijdrage werd gerapporteerd in 1932 door het echtpaar Frédéric en Irène Joliot-Curie. Uit hun experimenten bleek dat deze uitgezonden gammastralen zo sterk waren dat ze in staat waren protonen uit paraffine, een waterstofrijke materie, te stoten via het Compton-effect.
Naar aanleiding van deze publicatie voerde James Chadwick een serie van experimenten uit waarin hij aantoonde dat hij niet met gammastraling had te doen maar met het door Rutherford gepostuleerde neutrale deeltje. Reeds op 27 februari 1932, ruim een maand na het artikel van Joliot-Curie verscheen zijn antwoord in Nature: "Possible Existence of a Neutron".[1] Een uitgebreider artikel, nu met de zelfverzekerde titel "The Existence of a Neutron" verscheen drie maanden later in de Proceedings van de Royal Society.[2][3] Door beryllium-9 te beschieten met alfadeeltjes (9Be + α → 12C + n) kon hij de massa van het neutron bepalen op 1,66033×10−27 kg. In 1935 ontving Chadwick hiervoor de Nobelprijs voor Natuurkunde.
Eigenschappen
[bewerken | brontekst bewerken]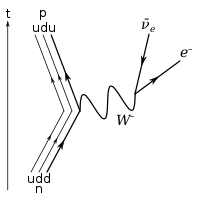
De rustmassa van een neutron is 1,008665 atomaire massa-eenheid (a.e.), dat is 1,67493 × 10−27 kg. Het deeltje kan vrijkomen bij kernsplitsing, bijvoorbeeld in kernreactoren en bij de explosie van een atoombom, maar het is in deze vrije toestand (dus buiten de atoomkern) niet stabiel. De gemiddelde vervaltijd (aangeduid met τ) is 14 minuten en 46 seconden (886 seconden). Via de zwakke kernkracht vervalt het tot een proton, een elektron en een elektron-antineutrino.
Dit is een voorbeeld van bètaverval (elektronenemissie wordt bètastraling genoemd). Het verschil in massa (1,3 MeV) tussen het neutron (939,6 MeV) en het iets lichtere proton (938,3 MeV) komt voor het grootste deel vrij als energie en wordt voor een kleiner deel (0,511 MeV) gebruikt voor het elektron.
Neutronen in onstabiele atoomkernen kunnen ook op deze wijze vervallen, echter binnen een atoomkern kunnen protonen ook veranderen in een neutron via invers bètaverval. Deze transformatie treedt op samen met de emissie van een anti-elektron (positron) en een elektron-neutrino.
De transformatie van een proton in een neutron binnen de atoomkern is ook mogelijk door elektroninvang.
Positroninvang door een neutron in atoomkernen die een overdaad aan neutronen bevat is ook mogelijk, maar wordt tegengewerkt doordat positronen worden afgestoten door de positief geladen atoomkern en daarnaast snel annihileren indien ze elektronen tegenkomen.
Neutronen die gevormd worden in een atoomkern zijn wel stabiel omdat de instabiliteit van een neutron wordt gebalanceerd met de instabiliteit die zou ontstaan in de kern als een neutron via bètaverval verandert in een proton. (Het proton zal deelnemen aan afstotende interacties met de andere protonen die reeds in de kern aanwezig zijn.) Dezelfde redenering verklaart ook waarom protonen – die stabiel zijn in de vrije ruimte – kunnen transformeren in neutronen indien ze gebonden zijn in een atoomkern.
Neutronen spelen een belangrijke rol in kernreacties:
Zij kunnen ook gebruikt worden voor structuuronderzoek:
De snelheid van een vrij neutron correspondeert met een bepaalde temperatuur, er wordt daarom wel gesproken van de neutronentemperatuur. Zie ook uranium.
Omdat een neutron neutraal is, moet waarneming van een neutron onrechtstreeks gebeuren met een neutrondetector.
Zie ook
[bewerken | brontekst bewerken]- ↑ (en) Chadwick, J. (1932). Possible Existence of a Neutron. Nature 129 (3252): 312. DOI: 10.1038/129312a0.
- ↑ (en) Chadwick, J. (1932). The Existence of a Neutron. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences 136 (830): 692. DOI: 10.1098/rspa.1932.0112.
- ↑ (en) Chadwick, J. (1933). Bakerian Lecture. The Neutron. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences 142 (846): 1. DOI: 10.1098/rspa.1933.0152.




