Kaliumchloraat
| Kaliumchloraat | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
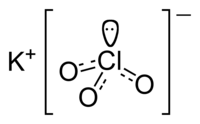
Structuurformule van kaliumchloraat
| |||||

| |||||
| Algemeen | |||||
| Molecuulformule | KClO3 | ||||
| IUPAC-naam | kaliumchloraat | ||||
| Andere namen | anforstan, Berthollets zout, fekabit, kaliumoxymuriaat | ||||
| Molmassa | 122,5495 g/mol | ||||
| SMILES | [O-]Cl(=O)=O.[K+]
| ||||
| InChI | 1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1
| ||||
| CAS-nummer | 3811-04-9 | ||||
| EG-nummer | 223-289-7 | ||||
| PubChem | 24187813 | ||||
| Wikidata | Q309328 | ||||
| Vergelijkbaar met | kaliumperchloraat, natriumchloraat | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H271 - H302 - H332 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P220 - P273 | ||||
| Opslag | Verwijderd houden van ontvlambare stoffen, hitte, vonken en open vlammen | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 2,32 g/cm³ | ||||
| Smeltpunt | 356 °C | ||||
| Kookpunt | (ontleedt) ± 400 °C | ||||
| Oplosbaarheid in water | 73 g/L | ||||
| Goed oplosbaar in | ethanol, water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Kaliumchloraat (KClO3) is het kaliumzout van chloorzuur. De stof komt voor als een wit kristallijn poeder, dat matig oplosbaar is in koud water maar goed oplosbaar is in heet water.
Het zout is een sterke oxidator en in staat zuurstofgas te produceren volgens de chemische reactie:
Synthese[bewerken | brontekst bewerken]
Kaliumchloraat kan eenvoudig door middel van elektrolyse worden bereid. Hiervoor is een anode nodig, die bestand is tegen het agressieve milieu in de cel. Chloorgas is namelijk erg corrosief. Geschikt anodemateriaal is titanium, dat gecoat is met een zogeheten mixed metal oxide-coating, die vaak ruthenium(IV)oxide bevat. Verder is grafiet ook wel bruikbaar, maar dit geeft erg veel vervuiling in de elektrolyt (koolstofdeeltjes komen los van de poreuze grafietelektrode). Het ideale anodemateriaal is platina, maar dat is relatief duur. De kathode kan vrijwel van elk geleidend materiaal worden gemaakt. De voeding moet minimaal enkele ampères kunnen leveren, en moet een uitgangsspanning van 5 volt hebben.
Wat er precies bij elektrolyse van een alkali-chloride-zout naar een chloraat-zout gebeurt, is nog steeds niet helemaal bekend. De volgende theorie is het aannemelijkst. Aan de anode treedt oxidatie op van chloride-ionen naar chloorgas:
Aan de kathode treedt reductie van water tot hydroxide-ionen en waterstofgas op:
Daarna volgt een reactie tussen het hydroxide-ion en chloorgas, waardoor het hypochloriet-anion wordt gevormd:
Vervolgens wordt het hypochloriet-anion geoxideerd tot het chloraat-anion. Deze reactie dient plaats te grijpen in zuur milieu, maar de oplossing wordt basisch door de gevormde hydroxide-anion. Daarom moet waterstofchloride (hierbij wordt giftig chloorgas gevormd) worden toegevoegd. De temperatuur moet minimaal 40 °C bedragen, opdat deze reactie plaatsvindt.
Toepassingen[bewerken | brontekst bewerken]
Kaliumchloraat wordt gebruikt in pyrotechnische sassen, alsmede in koppen van lucifers. Het mengsel met poedersuiker of andere gepoederde brandstoffen is heel brandbaar, maar niet explosief. Door het te kneden met vaseline in de verhouding 9:1 wordt het wel explosief, wanneer dit wordt geïnitieerd door een detonator.
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Het mengen van zwavel en kaliumchloraat levert potentieel gevaarlijke situaties door de vorming van zwavelzuur (H2SO4) aan de lucht. Zwavelzuur en kaliumchloraat zullen reageren tot chloorzuur (HClO3). Chloorzuur is een sterk anorganisch zuur, dat instabiel is boven concentraties van 30%. Het ontleedt tot chloordioxide, hetgeen spontaan kan exploderen, en het sterke perchloorzuur (HClO4). Kaliumchloraat is schadelijk bij opname door de mond.








