Enzymatische katalyse

Enzymatische katalyse is het proces waarbij een chemische reactie in de cellen van levende organismen wordt versneld of op gang wordt gebracht door daarvoor gespecificeerde enzymen. Enzymatische katalyse is voor alle levensvormen een biochemisch grondbeginsel omdat de reacties laat verlopen die nodig zijn voor hun metabolisme, homeostase en de synthese van alle biomoleculen waaruit zij bestaan.
Enzymatische katalyse vindt plaats in het actieve centrum van een enzymmolecuul: de plaats waar het substraat bindt. Het enzym kan deel uitmaken van een groot eiwitcomplex, en is soms verbonden met een cofactor (zoals NAD). De katalyse van biochemische reacties in cellen is essentieel voor de overleving van een organisme: ongekatalyseerde reacties bij lichaamstemperatuur en normale druk hebben een veel te lage reactiesnelheid.
Het mechanisme van enzymatische katalyse is in principe hetzelfde als iedere andere vorm van chemische katalyse. Enzymen zorgen ervoor dat de activeringsenergie van een reactie wordt verlaagd, door een of meerdere overgangscomplexen te vormen. Net als bij andere katalysatoren worden enzymen niet verbruikt tijdens de reactie, zodat het enzym blijvend kan functioneren.
Induced fit[bewerken | brontekst bewerken]

Enzymatische katalyse hangt af van het fysieke en chemische contact tussen het enzym en het substraat. Door de manier waarop een enzym is gevouwen ontstaat er een speciale pasvorm waarin alleen een zeer specifiek molecuul past. De structuur van het enzym en zijn substraat zijn geometrisch complementair.
Het induced fit model (model van geïnduceerde pasvorm), een vaak gebruikt model om interacties tussen enzym en subtraat te beschrijven,[1] stelt echter dat de binding tussen een enzym en het substraat niet alleen het gevolg is van een juiste pasvorm. Dit model stelt dat de initiële interactie tussen het enzym en substraat relatief zwak is, maar dat deze zwakke interacties snel leiden tot conformatieveranderingen van het enzym die de binding versterken. Met andere woorden: het substraat kan het actieve centrum van het enzym dermate vervormen, dat een nog correctere passing tot stand kan komen. Het model gaat uit van een dynamische interactie tussen het enzym en het substraat.[2]

De voordelen van het induced fit-mechanisme zijn vooral terug te voeren op het stabiliserende effect. Er zijn twee verschillende mechanismen van substraatbinding: uniforme binding, waarbij sterke substraatbinding optreedt, en differentiële binding, waarbij een sterke binding met het overgangscomplex optreedt. Het stabiliserende effect van uniforme binding verhoogt zowel de affiniteit van het substraat als van de overgangstoestand. Differentiële binding verhoogt alleen de overgangstoestandaffiniteit. Beide worden echter gebruikt door enzymen en ze zijn evolutionair toegesneden op het minimaliseren van de activeringsenergie. Enzymen die verzadigd zijn (zij met hoge affiniteit), hebben een differentiële binding nodig om de activeringsenergie te verlagen, terwijl enzymen die onvolledig aan kleine substraten zijn gebonden zowel differentiële- als uniforme binding kunnen gebruiken.[3]
De meeste enzymen gebruiken ‘differentiële binding’, dus de meeste substraten hebben een hoge enzymaffiniteit in de overgangstoestand. Differentiële binding wordt uitgevoerd door het mechanisme van induced fit: het substraat bindt eerst zwak, maar vervolgens verandert het enzym zijn conformatie waardoor de affiniteit naar de overgangstoestand toeneemt. Dan wordt de activeringsenergie verminderd om een reactie te laten verlopen. Het is echter belangrijk om te weten dat het concept van de geïnduceerde pasvorm geen argument is om enzymatische katalyse te verklaren. Het suggereert alleen dat de energiebarrière lager is in de gesloten vorm van het enzym, maar het vertelt ons niet waarom die barrière lager is.
Enzymatische reactiemechanismen[bewerken | brontekst bewerken]
De conformatieveranderingen die voorkomen bij enzymen hebben naast het omsluiten van het substraat nog een functie: ze brengen de katalytische residuen naar het actieve centrum, dicht bij de reactielocatie. Nadat binding heeft plaatsgevonden tussen substraat en residu, verlaagt een katalytisch mechanisme de activeringsenergie van het overgangscomplex, waardoor een nieuwe route wordt geopend waarlangs de reactie plaatsvindt. De processen van enzymatische katalyse zijn beschreven in verschillende mechanismen:
Plaats en oriëntatie[bewerken | brontekst bewerken]
De specifieke interacties tussen enzym en substraat zorgen ervoor dat de reactieve functionele groepen dicht bij elkaar liggen in een optimale moleculaire geometrie. Hierdoor wordt de reactiesnelheid verhoogt. Deze oriëntatie verlaagt de entropie van de reactanten en dit maakt de toevoegings- of overdrachtsreacties gunstiger.
Dit effect is vergelijkbaar met een effectieve concentratietoename van de reagentia. De binding van de reagentia aan het enzym geeft de reactie een intramoleculair karakter, wat een enorme verhoging geeft in reactiesnelheid. Zie onderstaand reactiemechanisme.
| Bijvoorbeeld: |
| Gelijksoortige reacties verlopen veel sneller als de reactie binnen het molecuul plaatsvindt. |

|
| De effectieve concentratie van acetaat in de intramoleculaire reactie wordt geschat op k2 / k1 = 2·105 molair. |
De situatie kan echter complexer zijn. Recente onderzoeken hebben aangetoond dat deze gebruikelijke voorbeelden van oriëntatie-effecten niet direct gerelateerd kunnen worden aan entropie-effecten van enzymen.[4][5]
Protondonor en protonacceptor[bewerken | brontekst bewerken]
Zuren en basen kunnen hun protonen afstaan en opnemen om de ladingen van de overgangstoestand te stabiliseren. Door dit mechanisme wordt meestal een nucleofiel- en elektrofiele groep geactiveerd, of de leaving group wordt gestabiliseerd. Histidine is een residu dat vaak betrokken is bij deze zuur-basereacties, omdat het een pKz heeft van ongeveer 7. Het aminozuur kan door deze neutrale zuurgraad zowel protonen afstaan als opnemen.
Bij reactiemechanismen met zuren en basen kunnen grote veranderingen voorkomen in de pKz. De pKz van het residu kan aanzienlijk worden beïnvloed door de omgeving. Zo kunnen residuen die basisch in oplossing zijn, protonen afgeven, en residuen die zuur in oplossing zijn, protonen accepteren. Zie onderstaand reactiemechanisme.
| Bijvoorbeeld: |
| De katalytische triade van een serineprotease. |
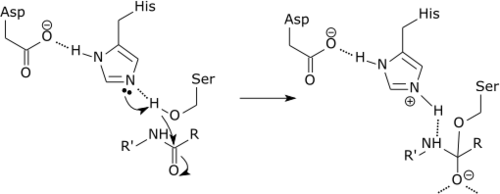
|
| Eerst neemt histidine een proton op van het serineresidu. Dit maakt van serine een nucleofiel die de amidebinding van het substraat aanvalt. In dit mechanisme wordt dus een proton van het basische serine (pKz 14) aan het zure histidine (pKz 6) gegeven. Dat is mogelijk door de nabijheid van het baseresidu. |
Elektrostatische katalyse[bewerken | brontekst bewerken]
Geladen overgangstoestanden kunnen ook worden gestabiliseerd doordat residuen in het actieve centrum ionaire bindingen vormen met het tussenproduct. Deze bindingen kunnen ofwel afkomstig zijn van de zure / basische zijketens die worden aangetroffen in aminozuren (zoals bij lysine, arginine, asparaginezuur of glutaminezuur), of afkomstig zijn van co-factoren zoals zink. Metaalionen zijn hiervoor zeer geschikt. Zij kunnen de pKz van water dermate verminderen dat er een effectief nucleofiel deeltje ontstaat.
Computersimulaties hebben aangetoond dat elektrostatische effecten verreweg de grootste bijdrage leveren aan enzymatische katalyse.[6] In het bijzonder is gevonden dat een enzym een lokale omgeving met zich mee kan brengen die meer polair is dan water, en dat de ionaire overgangstoestanden worden gestabiliseerd door vaste dipolen.
Normaal gesproken wordt bij het binden van substraat water uit het actieve centrum verdreven, waardoor de lokale diëlektrische constante wordt verlaagd tot die van een organisch oplosmiddel. Dit versterkt de elektrostatische interacties tussen het geladen (polaire) substraat en het actieve centrum. Bovendien is er aangetoond dat de ladingsverdelingen van het actieve centrum zodanig zijn gerangschikt dat ze de overgangstoestanden van gekatalyseerde reacties kunnen stabiliseren. In verschillende enzymen dienen deze ladingsverdelingen blijkbaar voor het begeleiden van polaire substraten naar hun bindingsplaats, zodat de snelheid van deze reacties nog groter wordt dan als de substraten via diffusie binden.
De grootte van het elektrostatische veld dat wordt uitgeoefend door het actieve centrum van het enzym is gecorreleerd aan de katalytische werking van het enzym. Elektrostatica blijkt een grote rol te spelen in de systematiek van enzymatische katalyse.[7][8] Zie onderstaand reactiemechanisme.
| Bijvoorbeeld: |
| Katalytisch mechanisme van carboxypeptidase. |

|
| Het tetraëdrische overgangscomplex wordt gestabiliseerd door een partiële ionaire binding tussen het zink-ion en de negatieve lading op de zuurstof. |
Covalente katalyse[bewerken | brontekst bewerken]
Bij covalente katalyse vormt het substraat een tijdelijke covalente binding met de residuen van het actieve centrum of met een co-factor. Door deze interactie ontstaat een extra covalent tussenproduct die de activeringsenergie van latere overgangstoestanden vermindert. In het laatste stadium van de reactie moet de covalente binding worden verbroken om het enzym te regenereren. Dit mechanisme wordt gebruikt bij de katalytische triade van bepaalde enzymen, zoals bij protease (waaronder chymotrypsine en trypsine behoren). Bij proteasen wordt een acyl-enzymtussenproduct gevormd. Een ander mechanisme van covelente katalyse kenmerkt zich door de vorming van schiff-basen met behulp van een vrije aminogroep uit het lysineresidu. Dit gebeurt bijvoorbeeld bij het enzym aldolase tijdens glycolyse.
Sommige enzymen gebruiken co-factoren zonder aminozuurverbindingen, zoals pyridoxaalfosfaat (PLP) of thiamine-pyrofosfaat (TPP), om covalente tussenproducten met reactantmoleculen te vormen.[9][10] Dergelijke covalente tussenproducten kunnen de activeringsenergie van latere overgangstoestanden verlagen, vergelijkbaar met hoe covalente tussenproducten gevormd uit aminozuurresiduen stabilisatie mogelijk maken, maar de capaciteiten van co-factoren maken het mogelijk dat enzymen reacties uitvoeren die met residuen niet mogelijk waren. Enzymen die gebruik maken van dergelijke co-factoren omvatten onder andere het PLP-afhankelijke enzym aspartaat-aminotransferase en het TPP-afhankelijke enzym pyruvaatdehydrogenase.[11]
Metaalion katalyse[bewerken | brontekst bewerken]
Metaalionen in het actieve centrum kunnen deelnemen aan enzymatische katalyse door ladingsverdelingen die tijdens de reactie ontstaan te stabiliseren. Vanwege de positieve lading van een metaal kunnen alleen negatieve ladingen worden gestabiliseerd.[12] Metaalionen zijn echter in het voordeel bij enzymatische katalyse omdat ze niet worden beïnvloed door schommelingen in de pH.[13] Daarnaast kunnen ze water ioniseren door te functioneren als een lewiszuur.[14] Metaalionen kunnen oxidatie en reductie mogelijk te maken in eiwitten. Ook daarmee worden enzymatische reacties op gang gebracht.[15]
Bindingsspanning[bewerken | brontekst bewerken]
Bindingsspanning (bind strain) is het belangrijkste effect van induced fit-binding, waarbij de affiniteit van het enzym naar de overgangstoestand groter is dan naar het substraat zelf. Het veroorzaakt structuurveranderingen in het enzym waardoor de substraatbinding spanningen ondergaat en daardoor dichter naar de conformatie van de overgangstoestand wordt gerekt. Het energieverschil tussen het substraat en de overgangstoestand wordt hierdoor verlaagd en de reactie wordt gekatalyseerd. Naast bindingsspanning binnen het substraat, kan bindingsspanning ook in het enzym zelf voorkomen om residuen in het actieve centrum te activeren.
Bindingsspanning is echter voor de grondtoestand destabiliserend in plaats van het stabiliserend voor de overgangstoestand.[16] Bovendien zijn enzymen zeer flexibel en kunnen ze geen groot spanningseffect toepassen.[17]
| Bijvoorbeeld: |
| Substraat-, gebonden substraat- en overgangstoestandconformatie van lysozym. |
| Het substraat wordt, wanneer het bindt, vervormd naar de zogenaamde stoelconformatie. |
Diffusiviteit van enzymen[bewerken | brontekst bewerken]
Onderzoek heeft uitgewezen dat niet-gebonden enzymen heftiger bewegen, en dus sneller diffunderen, bij toenemende substraatconcentratie en toenemende reactie-enthalpie.[18] Bovendien wordt gesuggereerd dat deze toename in diffusiviteit wordt veroorzaakt door de kortdurig verplaatsing van het massamiddelpunt van het enzym, wat een "terugslageffect" oplevert dat het enzym voortstuwt.[19]
Zie ook[bewerken | brontekst bewerken]
Referenties
- ↑ Koshland D.E. (February 1958). Application of a Theory of Enzyme Specificity to Protein Synthesis. Proc. Natl. Acad. Sci. U.S.A. 44 (2): 98–104. PMID 16590179. DOI: 10.1073/pnas.44.2.98.
- ↑ Prinsen J, van der Leij F (2015). De bouwstenen van het leven. Wageningen Academic Publishers, pp. 71. ISBN 978-90-8686-270-2. Gearchiveerd op 30 juni 2023.
- ↑ Anslyn E.V. Dougherty D.A. (2006). Modern Physical Organic Chemistry. University Science Books. ISBN 1-891389-31-9.
- ↑ Stanton R.V. Perakyla M. Bakowies D. Kollman P.A. (1998). Combined ab initio and Free Energy Calculations To Study Reactions in Enzymes and Solution: Amide Hydrolysis in Trypsin and Aqueous Solution. J. Am. Chem. Soc. 120 (14): 3448–3457. DOI: 10.1021/ja972723x.
- ↑ Kuhn B. Kollman P.A. (2000). QM-FE and Molecular Dynamics Calculations on Catechol O-Methyltransferase: Free Energy of Activation in the Enzyme and in Aqueous Solution and Regioselectivity of the Enzyme-Catalyzed Reaction. J. Am. Chem. Soc. 122 (11): 2586–2596. DOI: 10.1021/ja992218v.
- ↑ Warshel A. Sharma P.K. Kato M. Xiang Y. Liu H. Olsson M.H.M. (2006). Electrostatic Basis of Enzyme Catalysis. Chem. Rev. 106: 3210–3235. PMID 16895325. DOI: 10.1021/cr0503106.
- ↑ "How Enzymes Work". Gearchiveerd op 7 oktober 2021.
- ↑ "Extreme electric fields power catalysis in the active site of ketosteroid isomerase", [1]
- ↑ Toney, M. D. "Reaction specificity in pyridoxal enzymes." Archives of biochemistry and biophysics (2005) 433: 279-287
- ↑ Micronutrient Information Center, Oregon State University. Gearchiveerd op 21 maart 2015. Geraadpleegd op 15 februari 2018.
- ↑ Donald Voet & Judith Voet (2004). Biochemistry. John Wiley & Sons Inc., 986–989, & p. 604–606. ISBN 0-471-25090-2.
- ↑ (en) Piccirilli JA. Vyle JS. Caruthers MH. Cech TR. (7 januari 1993). Metal ion catalysis in the Tetrahymena ribozyme reaction. Nature 361 (6407): 85–88. DOI: 10.1038/361085a0.
- ↑ BENDER, MYRON L. (1 januari 1962). Reactions of Coordinated Ligands. AMERICAN CHEMICAL SOCIETY. DOI:10.1021/ba-1963-0037.ch002, 19–36. ISBN 0841200386.
- ↑ Fife TH. Przystas TJ. (1 februari 1985). Divalent metal ion catalysis in the hydrolysis of esters of picolinic acid. Metal ion promoted hydroxide ion and water catalyzed reactions. Journal of the American Chemical Society 107 (4): 1041–1047. ISSN: 0002-7863. DOI: 10.1021/ja00290a048.
- ↑ Stadtman, E. R. (1 januari 1990). Metal ion-catalyzed oxidation of proteins: biochemical mechanism and biological consequences. Free Radical Biology & Medicine 9 (4): 315–325. ISSN: 0891-5849. PMID 2283087. DOI: 10.1016/0891-5849(90)90006-5.
- ↑ Jencks, William P. (1987). Catalysis in Chemistry and Enzymology, reprint. Dover Publications, New York. ISBN 9780486654607.
- ↑ Warshel A. Levitt M. (1976). Theoretical Studies of Enzymatic Reactions: Dielectric Electrostatic and Steric Stabilization of the Carbonium Ion in the Reaction of Lysozyme. J. Mol. Biol. 103 (2): 227–49. PMID 985660. DOI: 10.1016/0022-2836(76)90311-9.
- ↑ Muddana, Hari S., Sengupta, Samudra, Mallouk, Thomas E. (28 January 2010). Substrate Catalysis Enhances Single-Enzyme Diffusion. Journal of the American Chemical Society 132 (7): 2110–1. PMID 20108965. PMC 2832858. DOI: 10.1021/ja908773a.
- ↑ Riedel, Clement, Gabizon, Ronen, Wilson, Christian A. M. (8 January 2015). The heat released during catalytic turnover enhances the diffusion of an enzyme. Nature 517: 227–30. PMID 25487146. PMC 4363105. DOI: 10.1038/nature14043.
