Koolstof-zuurstofbinding
De koolstof-zuurstofbinding is een covalente binding tussen koolstof en zuurstof en een van de meest voorkomende bindingen in de organische chemie en de biochemie (op de koolstof-waterstofbinding na).[1] Zuurstof heeft 6 valentie-elektronen en deelt bij voorkeur twee elektronen met koolstof, waarbij de overgebleven 4 niet-bindende-elektronen in 2 vrije elektronenparen worden geplaatst. De eenvoudigste vertegenwoordigers van deze verbindingen kunnen gezien worden als organische derivaten van water: de alcoholen.
Een C-O-binding is sterk gepolariseerd, de elektronen zijn in de richting van het zuurstofatoom verschoven. Het grote verschil in elektronegativiteit tussen beide elementen is hier debet aan. Bindingslengten voor alifatische koolstofatomen naar zuurstof liggen in de grootte-orde van 143 pm, waarmee ze korter zijn dan C-N- of C-C-bindingen. Kortere enkele C-O-bindingen kunnen worden waargenomen in de carbonzuren (136 pm). Dit is te wijten aan het gedeeltelijk dubbelbindingskarakter. Langere bindingen treden op in epoxiden (147 pm).[2] De bindingsenergie van de C-O-binding is ook groot in vergelijking met C-N of C-C. Zo wordt voor de C-O-binding in methanol een waarde van 382 kJ/mol (bij 298 K) gevonden tegen 365 kJ/mol in methylamine en 370 kJ/mol in ethaan.[3]
Koolstof en zuurstof kunnen ook dubbele bindingen vormen. Deze verbindingen worden aangeduid als carbonylverbindingen. Het betreffen als dusdanig aldehyden, ketonen, esters, carbonzuren en tal van andere carbonylverbindingen. De bindingslengte van de C-O dubbele binding ligt rond 123 pm in carbonylverbindingen. De C=O-bindingen in acylhalogeniden hebben een partieel drievoudig karakter en zijn bijgevolg extra kort: 117 pm. Verbindingen met een formele C-O-drievoudige binding bestaan niet, al kan op kwantummechanische overwegingen in een aantal verbindingen, met name koolstofmonoxide de C-O wel als drievoudige binding beschreven worden. De bindingsenergie voor deze drievoudige binding is zelfs groter dan die voor de drievoudige binding tussen twee stikstofatomen.[4]
In furanen draagt zuurstof bij aan het pi-elektronsysteem via één gevuld p-orbitaal: furaan is bijgevolg aromatisch.
Reacties[bewerken | brontekst bewerken]
Belangrijke reacties in de koolstof-zuurstofbindingsvorming zijn:
- Williamson-ethersynthese
- Nucleofiele acylsubstituties
- Elektrofiele additie aan alkenen
- De Paterno-Buchi-reactie is het carbonylequivalent van een metathesereactie
Functionele groepen met zuurstof[bewerken | brontekst bewerken]
Koolstof-zuurstofbindingen worden gevonden in de volgende functionele groepen:
| Stofklasse | Bindingsorde | Brutoformule | Structuurformule | Voorbeeld |
|---|---|---|---|---|
| Alcoholen | 1 | R3C-OH | 
|
Ethanol |
| Ethers | 1 | R3C-O-CR3 | 
|
Di-ethylether |
| Peroxiden | 1 | R3C-O-O-CR3 | 
|
Di-tert-butylperoxide |
| Esters | 1 | R3C-CO-O-CR3 | 
|
Ethylacrylaat |
| Carbonaatesters | 1 | R3C-O-CO-O-CR3 | 
|
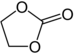 Ethyleencarbonaat |
| Ketonen | 2 | R3C-CO-CR3 | 
|
Aceton |
| Aldehyden | 2 | R3C-CHO | 
|
 Acroleïne |
| Furanen | 1,5 | 
|
 Furfural | |
| Pyryliumzouten | 1,5 | 
|
 Anthocyanines |
[bewerken | brontekst bewerken]
Navigatie Koolstof-elementbinding
Bronnen, noten en/of referenties
|
