Rhodizonzuur: verschil tussen versies
vertaling uit het Engels |
(geen verschil)
|
Versie van 8 mrt 2022 18:12
| Mee bezig Aan dit artikel of deze sectie wordt de komende uren of dagen nog druk gewerkt.
Klik op geschiedenis voor de laatste ontwikkelingen. |
| Rhodizonzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
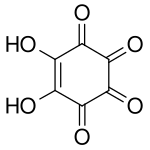
| ||||
Structuurformule van rhodizonzuur
| ||||

| ||||
Ruimtelijk model van rhodizonzuur
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Andere namen | dihydroxydiquinoyl dioxydiquinon | |||
| Molmassa | 170.20 g/mol | |||
| SMILES | C1(=C(C(=O)C(=O)C(=O)C1=O)O)O
| |||
| CAS-nummer | 118-76-3 | |||
| PubChem | 67050 | |||
| Wikidata | Q2823301 | |||
| Fysische eigenschappen | ||||
| Smeltpunt | 130 - 132 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Rhodizonzuur is een chemische vebrinding met de formule , of met iets meer nadruk op de structuur ervan: . Het kan beschouwd worden als het tweevoudig enol én het viervoudig keton van cyclohexeen, meer precies als: 5,6-dihydroxy-cyclohex-5-een-1,2,3,4-tetron.
Rhodizonzuur wordt meestal verkregen als dihydraat: . Zoals bij meer cyclische polyketonen wordt dit dihydraat beter beschreven als: 2,3,5,5,6,6-hexahydroxycyclohex-2-een-1,4-dion. Twee van de oorspronkelijke dubbelgebonden zuurstofatomen zijn vervangen door geminale hydroxylgroepen. Het oranje tot dieprode en zeer hygroscopische watervrije zuur wordt verkregen via sublimatie van het dihydraat bij lage druk.[1][2]
Zoals veel enolen, bij voorbeeld vitanmine C, staat rhodizonzuur makkelijk zijn protonen af: pKz1 = 4.378 ± 0.009, pKz2 = 4.652 ± 0.014 bij 25 °C),[3] waarbij achtereenvolgens , (waterstofrhodizinaat) en , rhodizinaat, ontstaan. Het laatste ion is aromatisch en symmetrisch. De dubbele bindiong en de negatieve ladingen zijn gedelocaliseerd en gelijkmatig over de 6 C=O - eenheden verdeeld. De kleuren van rhodizinaten lopen uiteen van van diverse tinten rood naar gelig en paars.
Rhodizonzuur is toegepast in herkenningsreactiesa voor barium, lood en andere metalen.[4] Vooral de natriumrhodinaat-test wordt gebruikt om gunshot residuen, die lood bevatten, te detecteren op het lichaam of de kleding van het slachtoffer of de verdachte[5] en onderscheid te maken tussen wonden veroorzaakt door kogels enerzijds en pijlen anderzijds. Dit laatste kan een rol spelen bij de handhaving van jachtreglementen.[6]
Geschiedenis
Rhodizonzuur werd ontdekt door de Australische chemicus Johann Heller in 1837 als een van de reactieproducten die ontstonden bij het verhitten van kaliumcarbonaat en houtskool.[7][8][9] De naam is afgeleid van het Grieks: ῥοδίζω (rhodizō, "rood kleuren"),[10] naar aanleiding van de kleur van de zouten.
Bronnen, noten en/of referenties
|





