Aromaticiteit
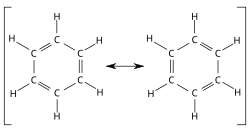
Aromaticiteit is in de organische chemie de benaming voor het opmerkelijke fenomeen dat kenmerkend is voor een reeks verbindingen, de aromatische verbindingen of aromaten. Aromaten bestaan uit geconjugeerde ringsystemen van pi-bindingen, vrije elektronenparen en/of lege orbitalen, waardoor deze verbindingen een grotere stabiliteit bezitten dan op grond van alleen de stabilisatie van de conjugatie te verwachten is. Aromaticiteit kan worden beschouwd als een manifestatie van zowel de cyclische delokalisatie van elektronen als van chemische resonantie. Om aromaticiteit te bezitten moet een chemische verbinding zowel een conjugatie als een resonantie hebben. Een chemische verbinding van dit type wordt een aromatische verbinding genoemd.
De term "aromatisch" is afkomstig van het feit dat vele benzeenverbindingen beschouwd worden als aangenaam geurende stoffen.
Theoretische achtergrond[bewerken | brontekst bewerken]
Het verschijnsel is een rechtstreeks gevolg van het elkaar overlappen van de orbitalen, ofwel het feit dat elektronen vrij kunnen bewegen te midden van de cirkelvormig gerangschikte atomen die door middel van zowel enkele als dubbele bindingen aan elkaar vastzitten. De bindingsstructuur van het molecuul als geheel kan dan worden gezien als een hybride vorm van enkele en dubbele bindingen.[1][2][3]
Zoals in alle resonantiediagrammen wordt door middel van een dubbele pijl aangegeven dat de verschillende mogelijke structuren geen aparte entiteiten vormen maar alleen in theorie bestaan, aangezien de perfect hexagonale structuur van het benzeenmolecuul betekent dat de bindingen alle dezelfde lengte hebben, die een soort gemiddelde van enkele en dubbele bindingen vormt. Dit laatste kan het beste worden weergegeven door middel van een circulaire pi-binding, waarin de dichtheid van de elektronen gelijkmatig is verdeeld over de pi-bindingen die zich boven en onder het aromatische ringsysteem bevinden. Men zou dit kunnen voorstellen als 2 elektronenwolken in de vorm van een ring, die zich boven en onder de eigenlijke ringstructuur bevinden.
Geschiedenis[bewerken | brontekst bewerken]
De term aromatisch werd in deze betekenis voor het eerst gebruikt in 1855 door August Wilhelm von Hofmann voor fenylgroepen met een radicaal.[4]
Het model van een cyclohexatrieenstructuur voor benzeen werd in 1865 uitgewerkt door Friedrich Kekulé, op basis van het idee dat de molecuulstructuur van benzeen bestaan uit een ring van zes koolstofatomen die onderling verbonden zijn door middel van afwisselend een en twee gemeenschappelijke elektronenparen. Het feit dat deze bindingen elkaar voortdurend afwisselen is een fundamenteel kenmerk van chemische resonantie. In de decennia daarna is deze voorgestelde structuur door de meeste chemici geaccepteerd. Tussen 1897 en 1906 werd het model van Kekulé verder verfijnd door Joseph John Thomson, die tevens de ontdekker van het elektron is. De uiteindelijke verklaring voor het buitengewoon stabiele karakter van benzeenmoleculen wordt toegeschreven aan Robert Robinson, die in 1925 de term "aromatisch sextet" bedacht[5], maar kan waarschijnlijk verder worden herleid tot een artikel uit 1890 van Henry Edward Armstrong[6].
Kenmerken[bewerken | brontekst bewerken]
Een aromatische verbinding bevat een reeks covalente bindingen met de volgende kenmerken:
- Een gedelokaliseerd en geconjugeerd systeem van pi-bindingen, gewoonlijk een alternering van enkele en dubbele bindingen
- Een coplanaire structuur, waarin alle atomen zich binnen hetzelfde vlak bevinden
- Een sp2-hybridisatie van de ringvormende atomen (meestal koolstof)
- De atomen zijn in één of meer ringsystemen gerangschikt
- Het aantal gedelokaliseerde pi-elektronen voldoet aan de regel van Hückel, dat wil zeggen dat het aantal deelbaar is door 2, maar geen veelvoud is van 4. De standaardformule hiervoor is 4n + 2 elektronen, waarbij geldt: n = 0, 1, 2, 3, ... Een aromatische verbinding bezit dus 2, 6, 10, 14, ... elektronen die gedelokaliseerd zijn.
Chemische verbindingen die aan al deze voorwaarden voldoen, worden aromatisch genoemd. Indien niet wordt voldaan aan de regel van Hückel, maar wel aan de andere voorwaarden, dan noemt men de structuur anti-aromatisch.
Toepassingen van de regel van Hückel[bewerken | brontekst bewerken]
Cyclo-octatetraeen[bewerken | brontekst bewerken]
Cyclo-octatetraeen is een cyclisch tetraeen (viervoudig cycloalkeen), dat is afgeleid van cyclo-octaan. De structuur bestaat uit een achtring, waarin alternerend 4 enkelvoudige en 4 dubbele bindingen zijn opgenomen. Het aantal pi-elektronen in de ring bedraagt bijgevolg 8. De regel van Hückel is niet van toepassing op cyclo-octatetraeen omdat het molecuul geen vlakke structuur aanneemt. Het molecuul is daarom noch aromatisch, noch anti-aromatisch, en het heeft de eigenschappen van normale alkenen. Zou het molecuul wel een vlakke structuur hebben, dan zou het volgens de regel van Hückel anti-aromatisch zijn.

Heterocyclische verbindingen[bewerken | brontekst bewerken]
Veel heterocyclische verbindingen bezitten een aromatisch karakter. De belangrijkste zijn furaan, pyrrool, imidazool, thiofeen en pyridine. Dit zijn telkens voorbeelden van systemen met 6 π-elektronen.
Pyridine is een analoge verbinding van benzeen. Het vrij elektronenpaar op stikstof bezet in de ringstructuur een sp2-orbitaal, dat loodrecht staat op het vlak van de ring. Het maakt dus deel uit een het geconjugeerde π-systeem. De verbinding is vlak, alle atomen in de ring zijn sp2-gehybridiseerd en er is voldaan aan de regel van Hückel. Pyridine is een aromatische verbinding.
Voor de overige verbindingen, die een vijfring bevatten, is er een gelijkaardig systeem aanwezig. Ook hier zijn telkens 6 elektronen aanwezig, die deel uitmaken van het aromatische π-systeem. Bijgevolg moet ieder heterocyclisch atoom in de ring (zuurstof, stikstof of zwavel) sp2-gehybridiseerd zijn. Bij furaan en thiofeen, waarvan respectievelijk het zuurstof- en zwavelatoom 2 vrije elektronenparen bezitten, lijkt dit tegenstrijdig met de regels voor de hybridisatie van atomen. Men verwacht een sp3-hybridisatie (2 σ-bindingen en 2 vrije elektronenparen). Dit is niet correct, aangezien 1 elektronenpaar wordt opgenomen in een p-orbitaal, dat geconjugeerd is met de andere 4 p-orbitalen. Hierdoor bezitten ook deze verbindingen een aromatisch karakter. Het andere vrije elektronenpaar bezet een sp2-hybridorbitaal dat in het vlak van de ring ligt en niet deelneemt aan de conjugatie.
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|
