Vinylchloride
| Vinylchloride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
Structuurformule van vinylchloride
| |||||
| Algemeen | |||||
| Molecuulformule | C2H3Cl | ||||
| IUPAC-naam | chlooretheen | ||||
| Andere namen | ethyleenchloride, etheenchloride | ||||
| Molmassa | 62,50 g/mol | ||||
| SMILES | ccCl
| ||||
| CAS-nummer | 75-01-4 | ||||
| EG-nummer | 200-831-0 | ||||
| Wikidata | Q338869 | ||||
| Beschrijving | Kleurloos gas | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H220 - H280 - H350 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P210 - P308+P313 - P410+P403 | ||||
| Carcinogeen | ja | ||||
| Opslag | Recipiënt stevig gesloten houden, verwijderd van hitte, vonken en open vlammen | ||||
| VN-nummer | 1086 | ||||
| ADR-klasse | klasse 2.1 | ||||
| LD50 (ratten) | (oraal) 500 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | gasvormig | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,911 g/cm³ | ||||
| Smeltpunt | −154 °C | ||||
| Kookpunt | −13,4 °C | ||||
| Vlampunt | −61 °C | ||||
| Dampdruk | 3,4 × 105 Pa | ||||
| Oplosbaarheid in water | 3,424 g/L | ||||
| Slecht oplosbaar in | water | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH |
−28,45 kJ/mol | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
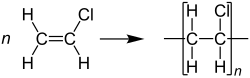
Vinylchloride of chlooretheen (IUPAC-naam) is een gechloreerde organische verbinding, met als brutoformule C2H3Cl. De stof komt voor als een kleurloos gas, dat met moeite oplosbaar is in water. Vinylchloride is het monomeer van polyvinylchloride (pvc), een veelvuldig toegepaste thermoplastisch polymeer.
Synthese[bewerken | brontekst bewerken]
De klassieke productie van vinylchloride bestaat uit twee stappen. Eerst wordt etheen in reactie gebracht met dichloor, waardoor 1,2-dichloorethaan gevormd wordt:
1,2-dichloorethaan kan ook bereid worden door oxychlorering, dit is de reactie van etheen met waterstofchloride en zuurstofgas:
Vervolgens wordt 1,2-dichloorethaan in een oven bij ongeveer 500°C gekraakt tot vinylchloride en waterstofchloride. Ongeveer 30% van de wereldwijde chloorproductie wordt hiervoor gebruikt:
Het Britse chemiebedrijf ICI ontwierp een proces op basis van ethaan.[1] In dit proces reageert ethaan in één stap met dichloor en zuurstofgas bij hoge temperatuur in de gasfase, op een vaste katalysator op basis van zilver en mangaan. De reacties verlopen met behulp van radicalen.
Een alternatieve methode is de additie van waterstofchloride aan ethyn. Als katalysator wordt traditioneel kwik(II)chloride op een koolstofdrager gebruikt, maar moderne katalysatoren op basis van goudcomplexen zijn superieur en vermijden het gebruik van giftig kwik.[2][3]
Gebruik[bewerken | brontekst bewerken]
Vinylchloride wordt vrijwel uitsluitend gebruikt voor de productie van pvc ofwel polyvinylchloride:
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Vinylchloride is carcinogeen en wordt onder andere gevormd door de gedeeltelijke afbraak van tetrachlooretheen en trichlooretheen in het milieu. Er is echter een bacterie ontdekt (Dehalococcoides ethenogenes) die, onder de juiste omstandigheden, deze verbindingen geheel onschadelijk maakt.
Externe links[bewerken | brontekst bewerken]
 vinylchloride - International Chemical Safety Card
vinylchloride - International Chemical Safety Card- (en) MSDS van vinylchloride
- (en) Gegevens van vinylchloride in de GESTIS-stoffendatabank van het IFA
Bronnen, noten en/of referenties
|






![{\displaystyle {\ce {C2H4Cl2->[500^{\circ }C]H2C=CHCl{}+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3224c98b3db0542ebd0e652f5d804aedf47eaf48)