Tetrodotoxine
| Tetrodotoxine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
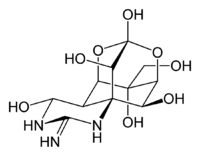
Structuurformule van tetrodotoxine
| ||||
| Algemeen | ||||
| Molecuulformule | C11H17N3O8 | |||
| IUPAC-naam | octahydro-12-(hydroxymethyl)-2-imino-5,9:7,10a-dimethano-10aH-[1,3]dioxocino[6,5-d]pyrimidine-4,7,10,11,12-pentol | |||
| Andere namen | maculotoxine, TTX, tarichatoxine | |||
| Molmassa | 319,27 g/mol | |||
| CAS-nummer | 4368-28-9 | |||
| EG-nummer | 224-458-8 | |||
| PubChem | 20382 | |||
| Wikidata | Q379842 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H300 - H310 - H330 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P301+P310 - P302+P350 - P304+P340 - P310 - P361 | |||
| Omgang | Stof niet inademen, vernevelen of verdampen. Voorkom contact met de ogen, de huid of kleding. Gebruik alleen in een chemische zuurkast. | |||
| Opslag | Bewaren op een koele, droge plaats. Bewaren in een goed gesloten container. | |||
| LD50 (muizen) | (intraveneus) 7300 ng/kg (oraal) 0,334 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Smeltpunt | 220 °C | |||
| Goed oplosbaar in | verdund azijn- of zwavelzuur | |||
| Slecht oplosbaar in | ethanol, di-ethylether | |||
| Onoplosbaar in | organische oplosmiddelen | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tetrodotoxine (TTX) is een sterk neurotoxine. De naam is afgeleid van de vissenorde die het vergif bij zich draagt, namelijk de Tetraodontiformes. Over het algemeen bevindt het TTX zich in de kogelvis en de blauwgeringde octopus in verschillende organen. Voorbeelden zijn de huid, de lever en speekselklieren. De vrouwelijke kogelvis is giftiger dan de mannelijke. Dit komt doordat een deel van het TTX zich bevindt in de ovaria. De hoeveelheid TTX in een kogelvis hangt ook van het seizoen af. In het voortplantingsseizoen is de TTX-concentratie het hoogst.[1]
Men dacht altijd dat TTX endogeen was, dus dat dieren het zelf produceren. Er zijn binnen een bepaalde soort veel verschillen in toxiciteit, die niet genetisch verklaarbaar zijn. Uit experimenten bleek dat diverse bacteriën in staat zijn TTX te produceren. Enkele voorbeelden van deze bacteriën zijn Pseudomonas-soorten,[2] Photobacterium phosphoreum en Staphylococcus-soorten. Ook zijn er twee verschillende mogelijkheden beschreven voor het ontstaan van TTX in dieren. Bij de eerste route wordt het gif door bepaalde bacteriën gemaakt in sediment en wordt het doorgegeven in de voedselketen, met als gevolg dat het gif zich ophoopt in organismen hoger in de voedselketen. De tweede route die beschreven is zegt dat het gif een product is van een symbiose of een parasitaire vorm van micro-organisme die zich in hogere organismen bevinden.[2]
TTX werkt op de natriumkanalen van de zenuwen en blokkeert daar de doorstroom van zenuwsignalen. TTX is zeer giftig, een dosis van 24 milligram is al voldoende om een mens te doden.[3]
In de Oosterschelde en de Nederlandse kustwateren is in 2015 een (voor Nederland) nieuwe soort snoerworm ontdekt die tetrodotoxine bevat.[4] In 2016 is ook in mosselen uit de Oosterschelde tetrodotoxine aangetroffen in concentraties die boven de grenswaarde van 20 µg/kg uitkomen. Eerder was dit ook al in Britse mosselen en oesters het geval. Het is onduidelijk wat de bron van het gif is.[5][6]
Geschiedenis[bewerken | brontekst bewerken]
Het is reeds lang bekend dat de kogelvis erg giftig is. De Egyptenaren hadden ca. 2700 jaar voor Christus al wetten die mensen verboden vissen te eten die geen vinnen en schubben hadden, of schelpdieren, waarschijnlijk ter bescherming tegen TTX. Dit hebben wetenschappers geconcludeerd omdat de zeedieren die TTX bevatten en daar in de buurt hebben geleefd, geen vinnen en schubben hadden of schelpdieren waren. Op 7 september 1774 noteerde kapitein Cook in zijn logboek dat hij en zijn zeelieden zich zwak voelden en last hadden van gevoelloosheid na het eten van de lever van een kogelvis. Ze hadden de resten van de vis (voornamelijk de huid) aan dieren aan boord gevoerd. Deze vonden wel de dood, waarschijnlijk omdat ze een relatief hogere dosis binnen kregen.[1]
Rond 1911 werd bekend dat TTX de giftige stof was in fugu. De actieve stof is gevonden in de ovaria van de fugu. Ongeveer veertig jaar later (1950) werd de stof voor het eerst uit deze ovaria geïsoleerd. In 1963 werd tarichatoxine in Californische watersalamanders vergeleken met TTX door Mitsuru Takata van de universiteit van Osaka.[7] Hieruit bleek dat het om hetzelfde molecuul ging en dat TTX dus niet alleen in bepaalde vissen zat, maar ook in watersalamanders.[8] Een paar jaar later werd ontdekt dat ook kikkers en de blauwgeringde octopussen dit gif kunnen bevatten. In 1970 werd namelijk verklaard dat in de meeste pijlgifkikkers het hoofdgif TTX was, en dat het gif dat de blauwgeringde octopus produceert met zijn speekselklieren, maculotoxine, ook gelijk is aan TTX. Nog later werd TTX ook gevonden in bepaalde weekdieren, sommige krabsoorten en enkele zeesterren. Tot slot is in 1978 de kristallijne vorm van TTX geïsoleerd.[1]
Omdat in Japan kogelvis vaak gebruikt wordt voor fugu, zijn hier sinds 1958 strenge wetten aan verbonden. Koks moeten een driejarige opleiding doorlopen en worden daarna nog steeds streng gecontroleerd. Het kleinste foutje tijdens een dergelijke opleiding kan genoeg zijn om een student geen diploma uit te reiken. Slechts 30% van de opgeleide mensen krijgt een diploma om fugu in de horeca te mogen bereiden. Daardoor zijn er sinds die tijd nog nauwelijks ongelukken gebeurd in de horeca. Er zijn nog wel 50 tot 100 gevallen per jaar bekend met een dodelijke afloop. Deze ongelukken gebeuren over het algemeen thuis, bij mensen die het gerecht willen bereiden, maar hier niet goed in slagen.[9]
Structuur[bewerken | brontekst bewerken]
Tetrodotoxine bevat een guanidiniumgroep. De structuur wordt gestabiliseerd door het verdelen van de lading over drie resonantiestructuren. Deze groep is waarschijnlijk belangrijk voor de affiniteit voor natriumkanalen, zie werkingsmechanisme. Tevens is er een pyrimidine-ring in de structuur van TTX te herkennen en een aantal gefuseerde ringsystemen met hydroxylgroepen, belangrijk voor het stabiliseren van de binding aan de Na+-receptor.
Synthese[bewerken | brontekst bewerken]
Synthese in vitro[bewerken | brontekst bewerken]
In 1972 is tetrodotoxine voor het eerst in vitro gesynthetiseerd. Deze racemische synthese is een 15 staps proces, genaamd de Kishi-Goto pathway.[10] Meer recent zijn er ook syntheses ontworpen die een enantiomeer-zuiver product opleveren.[11]
Biosynthese[bewerken | brontekst bewerken]
De natuurlijke synthese van tetrodotoxine, zoals deze in levende organismen plaatsvindt, is nog niet volledig opgehelderd. Er is een redelijk brede steun voor de hypothese dat micro-organismen verantwoordelijk zijn voor de productie van TTX.[12][13][14][15] Tot deze micro-organismen behoren de Vibrio-bacteriën, in het bijzonder de V. alginolyticus,[14] maar ook de Pseudomonas sp.[16] Deze micro-organismen leven in symbiose met een verscheidenheid aan dieren, die hierdoor TTX bevatten. Aanwijzingen voor het bestaan van deze symbiose zijn o.a.:
- Kogelvissen die in gevangenschap worden grootgebracht, bevatten geen tetrodotoxine, totdat ze weefsel van een TTX-producerende vis worden gevoerd[17]
- De blauwgeringde octopus uit Australië, die TTX verzamelt in zijn speekselklieren, is een gastheer van TTX-producerende bacteriën[17]
- Kogelvissen bevatten V. alginolyticus bacteriën in hun darmen, die daar TTX aanmaken[14]
Er zijn verschillende studies gedaan naar de grondstoffen voor de productie van tetrodotoxine, maar tot een definitieve, algemeen geaccepteerde uitkomst heeft dit nog niet geleid. In het artikel van Kotaki et al. wordt de hypothese geponeerd dat TTX gevormd wordt uit arginine en isopentenyl-PP.[12] Dit wordt geconcludeerd uit de vondst van een TTX-derivaat dat twee zuurstofatomen in het koolstofskelet mist, wat duidt op een stapsgewijze oxidatie van een alicyclische verbinding, zoals al eerder voorgesteld is door Yasumoto et al.[18] Er is ook nog een andere hypothese waarbij arginine en apiose-type C5 suiker de grondstoffen zijn.[12][19] Dit wordt door Kotaki et al. verworpen, op basis van de vondst van het gedeoxideerde TTX-derivaat. Aangezien TTX door zeer uiteenlopende bacteriën geproduceerd wordt, gaat men er in ieder geval van uit dat TTX opgebouwd kan worden uit veelvoorkomende precursors.[12]
Werkingsmechanisme[bewerken | brontekst bewerken]
De toxische werking van TTX ligt in het feit dat deze stof met hoge affiniteit bindt aan spannings-afhankelijke natriumkanalen in spier- en zenuwcellen. De meeste onderzoekers gaan ervan uit dat TTX de kanalen fysiek blokkeert. TTX is dodelijk zodra hierdoor de ademhalingsspieren van het middenrif verlamd raken. Het werkt dus niet direct op de hartspier.[20]
TTX blokkeert natriumkanalen van spier- en zenuwcellen. Er treedt een reversibele een-op-een-interactie op tussen TTX en de buitenkant van het ionkanaal. Waarschijnlijk vormt de relatief kleine guanidiniumgroep een complex en komt de rest van het molecuul als een kurk vast te zitten in het kanaal. Dit is aannemelijk, omdat losse guanidinium ionen normaal gesproken vrij door natriumkanalen heen kunnen diffunderen. TTX bindt aan zes zuurstofatomen van de selectiviteitsfilter van het kanaal. Het vormt zo vijf waterstofbruggen en een interactie tussen de positieve lading van TTX en een negatief geladen carboxyl groep van het kanaal.[21]
Tetrodotoxine wordt veel gebruikt in studies naar de werking en selectiviteit van natriumkanalen. Natriumkanalen spelen een essentiële rol in de signaaltransductie tussen zenuwcellen. Eén molecuul tetrodotoxine werkt op één natriumkanaal. Het blokkeert het ontstaan van een actiepotentiaal, maar heeft geen effect op de rustpotentiaal.[1]
Toxiciteit[bewerken | brontekst bewerken]
Tetrodotoxin is een van de meest giftige stoffen die men kent en is extreem gevaarlijk bij inname, inhalatie of opname via de huid. Aanraking met de ogen of huid kan irritatie veroorzaken.[22] Acute toxiciteit is bij dieren getest om zo de acute toxische dosis, de LD50, te bepalen.
| Toedieningswijze | Acute toxische dosis |
|---|---|
| Orale Inname LD50 | |
| Muis | 334 (μg/kg)[3] |
| Inhalatie LD50 | |
| Mens | 2 (μg/kg)[23] |
| Intraperitoneaal LD50 | |
| Muis | 8 (μg/kg)[3] |
| Kikker | 14 (μg/kg)[3] |
| Intraveneus LD50 | |
| Muis | 7,3 (μg/kg)[3] |
| Subcutaan LD50 | |
| Muis | 8 (μg/kg)[3] |
| Intracerebraal LD50 | |
| Muis | 0,6 (μg/kg)[3] |
De acute toxiciteit is niet bij mensen getest. Ervan uitgaande dat de toxiciteit bij mensen gelijk is zou een orale inname van 24 milligram of 0,5 milligram intraveneus al voldoende zijn om een persoon van 70 kg te doden. Bij inhalatie is slechts 0,15 milligram al voldoende. De mortaliteit van TTX is moeilijk te bepalen, maar bedraagt tot ongeveer 50%, zelfs met moderne ondersteunende zorg.[24]
Voor zover bekend is er geen verschil in toxiciteit bij verschillende rassen. Intoxicatie komt meer voor bij Japanse mensen door hun eetgewoonten.
Intoxicatie en symptomen[bewerken | brontekst bewerken]
Intoxicatie met tetrodotoxine kan een zeer onaangename dood tot gevolg hebben. Symptomen ontwikkelen zich doorgaans binnen 15 tot 30 minuten tot enkele uren, waarbij het zelfs tot 20 uur kan duren voordat de eerste effecten zich voordoen. Een enkel geval is waargenomen waarbij de intoxicatie al na 17 minuten de dood tot gevolg had.[1] De patiënt sterft meestal door totale verlamming van de ademhalingsspieren. Welke symptomen voorkomen en de duur van deze symptomen verschilt per individu en is ook afhankelijk van de ingenomen dosis.
Beginnende symptomen zijn een licht doof gevoel in de lippen en tong. Dit kan gevolgd worden door hoofdpijn, zweten, speekselvloed (sialorrhoe), misselijkheid in combinatie met braken, maag- en darmpijn en diarree. Hierna ontwikkelen zich tintelingen (parasthesieën) in het gelaat en de ledematen, wat een licht en ‘zwevend’ gevoel geeft. Afname van de motorische functies en coördinatie, verminderde reflexen (hyporeflexie) en functieverlies van de hersenzenuwen zullen hierop volgen.[1]
De volgende uren zullen spiertrekkingen (fasciculaties) en verlamming optreden, in combinatie met een verminderd spraakvermogen en bewustzijnsverlies. De patiënt vertoont hierbij vaak zeer lage bloeddruk (hypotensie), benauwdheid en cyanose. Vergevorderde verlamming volgt snel, wat kan leiden tot totale verlamming van de ademhalingsspieren. Ten slotte ontwikkelen zich hartritmestoornissen (bijvoorbeeld bradycardie), verstoring van het centraal zenuwstelsel en epileptische insulten. Bij ernstige vergiftiging kunnen patiënten verlies van alle reflexen ontwikkelen en in een diepe coma terechtkomen.[24]
Volledige ademstilstand en daardoor eventuele hartstilstand hebben de dood tot gevolg. Dit gebeurt meestal binnen 4 tot 6 uur, waarbij gevallen variërend van 17 minuten tot 20 uur zijn voorgekomen.[24]
Het kan voorkomen dat de patiënt volledig helder en bij bewustzijn is tot vlak voor de dood.[1]
Behandeling[bewerken | brontekst bewerken]
Behandeling van TTX-intoxicatie bestaat vooral uit symptoombestrijding, omdat er geen tegengif bekend is. Men bouwt na intoxicatie ook geen tolerantie of immuniteit op tegen het gif.[1]
Het belangrijkste is het stabiliseren van de ademhaling met eventuele beademing. Verwijdering van het gif moet na inname zo snel mogelijk gebeuren. Als het gif nog niet is uitgebraakt kan het gebruik van maag- of darmspoeling theoretisch gezien nuttig zijn. Dit kan problemen veroorzaken bij ademhaling of schade aan de slokdarm geven, daarom kan toediening van actieve kool overwogen worden om het gif te inactiveren. Een infuus kan aangelegd worden om de bloeddruk te verhogen, maar om de bloeddoorstroming te behouden kunnen inotropische middelen nodig zijn die de hartspierkracht versterken. Alpha adrenerge agonisten zouden hiervoor beter werken. Atropine kan toegediend worden om bradycardie te behandelen, in combinatie met voldoende beademing.[1] Als een patiënt de eerste 24 uur overleeft, zal deze meestal binnen een paar dagen volledig herstellen.[24]
Het gebruik van acetylcholinesterase remmende stoffen heeft wisselende successen gehad bij patiënten met TTX-intoxicatie. Er zijn gevallen bekend waarbij de neurologische werking van deze patiënten verbeterde na toediening van acetylcholinesteraseremmers.[25][26] Andere gevallen melden geen verbetering na toediening.[27][28] antihistaminica en steroïden zijn ook toegepast zonder gunstige uitwerking.[28]
Een dierstudie met het gebruik van monoklonale antilichamen tegen TTX is toegepast bij muizen.[29] Deze antilichamen bleken levensreddend te zijn bij muizen die zowel voor en na de inname van een dodelijke dosis TTX behandeld werden. Voor de mens is hier nog niets over te zeggen aangezien verder onderzoek nog nodig is. In een andere dierstudie is 4-aminopyridine (een kaliumkanaalblokker) gebruikt bij cavia’s die behandeld waren met tetrodotoxine of saxitoxine.[30] De cavia’s vertoonden een grote verbetering wat betreft ademhaling, hartfunctie en zenuwfunctie. Ook hiervoor zijn geen menselijke studies gaande.
Medische toepassingen[bewerken | brontekst bewerken]
Het is mogelijk dat een vorm van TTX gebruikt kan worden om hartritmestoornissen te behandelen. Er wordt hier dan gebruikgemaakt van de eigenschap van TTX dat deze snel Na+ kanalen kan blokkeren. Onderzoek heeft al uitgewezen dat TTX gebruikt kan worden om pijn te behandelen. Dit werd in Japan in 1930 al toegepast. Gebruik kan worden gemaakt van TTX bij bijvoorbeeld kanker[31] of migraine.
Een onderzoek naar TTX bij kanker gerelateerde pijn is al uitgevoerd. Bij dit onderzoek is bij patiënten twee- tot driemaal daags TTX toegediend. Dit werd vier dagen aangehouden en vervolgens een periode voor observatie. Het resultaat was dat bij 17 van de 31 behandelingen de pijn gereduceerd was door de behandeling. Deze werking bleef ook aan voor minimaal twee weken. Binnen die studie was de hoogst tolereerbare dosis 30 μg intramusculair, twee keer per dag.[32]
Wetgeving[bewerken | brontekst bewerken]
In Verordening (EG) 853/2004 15 staat in hoofdstuk V (Gezondheidsnormen voor visserijproducten) onder E (Voor de volksgezondheid schadelijke toxines):
- Visserijproducten afkomstig van giftige vis van de volgende families mogen niet in de handel worden gebracht: Tetraodontidae, Molidae, Diodontidae en Canthigasteridae.
- Visserijproducten die biotoxines, zoals ciguatoxine of spierverlammende toxines bevatten, mogen niet in de handel worden gebracht.[33]
Trivia[bewerken | brontekst bewerken]
Ian Fleming, de schrijver van de verhalen over James Bond, was bekend met de giftige effecten van tetrodotoxine. In “From Russia, with love”[34] wordt Bond geprikt met een naald en valt neer op de grond. In “Dr. No”[35] wordt onthuld dat er tetrodotoxine op de naald zat. Door het toepassen van kunstmatige beademing en behandeling als voor een curare-vergiftiging blijft Bond in leven.[36] In de Bondfilm "Octopussy" houdt een antagonist van Bond een kleine blauwgeringde octopus in een aquarium die na de glasbreuk van de tank vrijkomt en een vijand van Bond doodt.
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|

