Aceton
| Aceton | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van aceton
| ||||
| ||||
Molecuulmodel van aceton
| ||||
| Algemeen | ||||
| Molecuulformule | C3H6O | |||
| IUPAC-naam | Propanon | |||
| Andere namen | Dimethylketon | |||
| Molmassa | 58,08 g/mol | |||
| SMILES | CC(=O)C
| |||
| InChI | 1/C3H6O/c1-3(2)4/h1-2H3
| |||
| CAS-nummer | 67-64-1 | |||
| PubChem | 180 | |||
| Wikidata | Q49546 | |||
| Beschrijving | Kleurloze vloeistof met kenmerkende geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 - H319 - H336 | |||
| EUH-zinnen | EUH066 | |||
| P-zinnen | P210 - P280 - P305+P351+P338 - P337+P313 - P403+P235 | |||
| Opslag | Brandveilig. Gescheiden van sterk oxiderende stoffen. | |||
| VN-nummer | 1090 | |||
| MAC-waarde | 500 ppm; 750 mg/m3[1] | |||
| LD50 (ratten) | 5800[2] mg/kg | |||
| LD50 (konijnen) | 5300 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar[2] | |||
| Kleur | kleurloos[2] | |||
| Dichtheid | (bij 20°C) 0,79[2] g/cm³ | |||
| Smeltpunt | −94,8[3] °C | |||
| Kookpunt | 56[3] °C | |||
| Vlampunt | < −20[2] °C | |||
| Dampdruk | 2,28 × 104[2] Pa | |||
| Goed oplosbaar in | water[2] | |||
| Brekingsindex | 1,359 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Aceton (ook bekend onder de namen dimethylketon, DMK en propanon) is een kleurloze vloeistof die veel als oplosmiddel wordt gebruikt (onder andere nagellakverwijderaar in het dagelijks leven). Het is de eenvoudigste organische verbinding die een ketongroep bevat.
Aceton is een vluchtige en brandbare vloeistof. Het smeltpunt ligt bij −94,8 °C en het kookpunt is 56,53 °C. In het laboratorium wordt het soms gebruikt om glaswerk na het wassen goed te drogen (afspoelen met aceton om het water te verwijderen, en dan even wachten of droge lucht doorblazen om de aceton de kans te geven te verdampen).
Alhoewel aceton licht irriterend is, is huidcontact minder erg dan bij vele andere oplosmiddelen. Door zowel zijn oplossend vermogen voor organische stoffen als zijn oplosbaarheid in water, is aceton wel in staat door de huidbarrière (vet) te dringen. Eventueel op de huid aanwezige stoffen kunnen dan ook, opgelost in aceton, het lichaam binnendringen. Aceton werkt ook desinfecterend. Bij iemand die diabetes mellitus heeft, kan in het lichaam aceton ontstaan, wat tot gezondheidsschade kan leiden.
Synthese[bewerken | brontekst bewerken]
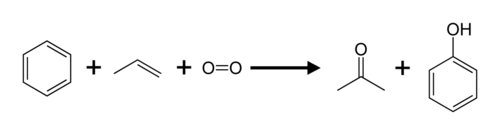
Aceton wordt direct of indirect bereid uit propeen. De industrieel meest gebruikte productiemethode is het cumeenproces:
Hierbij wordt benzeen gealkyleerd met propeen en ontstaat er cumeen (isopropylbenzeen). Het cumeen wordt op zijn beurt via radicalaire oxidatie omgezet tot het intermediair cumeenhydroperoxide. Dit peroxide reageert verder tot fenol en aceton.
Een alternatieve methode voor de productie van aceton is het Wackerproces. Hierbij wordt propeen direct geoxideerd met een Pd(II)/Cu(II)-katalysator tot vorming van aceton.
Biosynthese[bewerken | brontekst bewerken]
Bij de verbranding van vetzuren door decarboxylatie ontstaan ketolichamen. Hiervan is acetoacetaat er één; deze stof kan spontaan vervallen tot aceton, dat uitgescheiden wordt met de urine of het ademhalen. Bijgevolg kan men, wanneer de hoeveelheid suiker in het bloed van een suikerpatiënt (suikerziekte) niet adequaat wordt geregeld, soms aceton in zijn/haar adem ruiken.
Externe links[bewerken | brontekst bewerken]
| Bronnen, noten en/of referenties |