| Trifenylbismutaan
|
| Structuurformule en molecuulmodel
|

|
Structuurformule van trifenylbismutaan
|
| Algemeen
|
| Molecuulformule
|


|
| IUPAC-naam
|
Trifenylbismutine
|
| Molmassa
|
440,31 g/mol
|
| CAS-nummer
|
603-33-8
|
| PubChem
|
11774
|
| Wikidata
|
Q4463253
|
| Beschrijving
|
Witte vaste stof
|
| Waarschuwingen en veiligheidsmaatregelen
|
| EG-Index-nummer
|
210-033-4
|
| Fysische eigenschappen
|
| Aggregatietoestand
|
Vast
|
| Kleur
|
Wit
|
| Dichtheid
|
1,585 g/cm³[1][2]
|
| Smeltpunt
|
77,6 °C[3]
|
| Kookpunt
|
242 °C (14 Torr)[1]
|
| Oplosbaarheid in water
|
Practisch onoplosbaar[3]
|
| Goed oplosbaar in
|
Dichloormethaan, Chloroform, Benzeen, Tolueen, Di-ethylether, THF, Ethylacetaat[3]
|
| Slecht oplosbaar in
|
Alkoholen[3]
|
| Thermodynamische eigenschappen
|
ΔfHog
|
600,6 kJ/mol[2]
|
ΔfHos
|
489,7 kJ/mol[2]
|
Cop,m
|
330,2 J/mol·K[2]
|
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar).
|
|
|
Trifenylbismutaan, ook wel trifenylbismutine, is een organometaalverbinding van bismut met de brutoformule  , of met wat meer nadruk op de structuur van de verbinding:
, of met wat meer nadruk op de structuur van de verbinding:  . De stof wordt in de organische synthese toegepast. Op basis van zijn molaire massa is de verbinding het zwaartse lid van de trifenylderivaten van de stikstofgroep waarvan de andere leden trifenylamine, trifenylfosfaan, trifenylarsaan en trifenylstibaan zijn. Naast de trifenylverbindingen zijn voor de zwaardere leden van deze groep ook pentafenylvarianten bekend: pentafenylarsoraan, -stiboraan en -bismoraan.[4]
. De stof wordt in de organische synthese toegepast. Op basis van zijn molaire massa is de verbinding het zwaartse lid van de trifenylderivaten van de stikstofgroep waarvan de andere leden trifenylamine, trifenylfosfaan, trifenylarsaan en trifenylstibaan zijn. Naast de trifenylverbindingen zijn voor de zwaardere leden van deze groep ook pentafenylvarianten bekend: pentafenylarsoraan, -stiboraan en -bismoraan.[4]
De synthese van trifenylbismutaan verloopt via de reactie van bismut(III)chloride met fenylmagnesiumbromide in een etherische oplossing.[3][5]
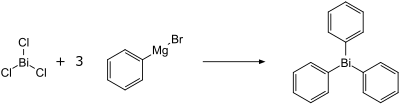
Op analoge wijze kan ook de reactie met fenyllithium gerealiseerd worden.[6]
 is een witte, kristallijne vaste stof[7], die bij 77,6 °C smelt.[3] De molaire Verbrandingsenthalpie voor de vaste stof bedraagt −10003,5 kJ·mol−1 voor de reactie:[2]
is een witte, kristallijne vaste stof[7], die bij 77,6 °C smelt.[3] De molaire Verbrandingsenthalpie voor de vaste stof bedraagt −10003,5 kJ·mol−1 voor de reactie:[2]

Trifenylbismutaan is in vergelijking met het pyrofore trimethylbismutaan lucht- en hydrolyse stabiel. Oxidatie naar de overeenkomstige bismutoxy-verbinding  lukt alleen met sterke oxidatoren als kaliumpermanganaat of waterstofperoxide.[4]
lukt alleen met sterke oxidatoren als kaliumpermanganaat of waterstofperoxide.[4]
Met chlorides reageert de stof onder vorming van difenylbismutchloride en fenyl(M)chlorides:[8]





Met interhalogenen of halogeen-pseudohalogeenverbindingen ontstaan difenylbismuthalogenides en fenyl(pseudo)halogenides. Het elektronegatievere deel van het inter(pseudo)halogeen koppelt aan bismut.[8]




Oxidatieve chlorering met sulfurylchloride  levert trifenylbismutdichloride op. Reactie daarvan met een Grignard-reagens als fenylmagnesiumbromide leidt tot pentafenylbismoraan[4] dat als een violette vaste stof geïsoleerd kan worden.[9]
levert trifenylbismutdichloride op. Reactie daarvan met een Grignard-reagens als fenylmagnesiumbromide leidt tot pentafenylbismoraan[4] dat als een violette vaste stof geïsoleerd kan worden.[9]


Trifenylbismutaan en pentafenylbismoraan geven onder uitwisseling van een fenyl-kation aanleiding tot een tetrafenylbismutoniumzout:[9][10]
![{\displaystyle {\ce {(C6H5)3Bi + (C6H5)5Bi -> [(C6H5)4Bi]+[(C6H5)4Bi]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adfb809cb9861024c1c195c9f42c9b6241c2286f)
In de organische chemie wordt  gebruikt in de glycolsplitsing en als reagens om een fenylgroep aan alcoholen en amines te koppelen. Fotochemisch kunnen reacties waarbij fenylradicalen betrokken zijn geïnitieerd worden.[3]
gebruikt in de glycolsplitsing en als reagens om een fenylgroep aan alcoholen en amines te koppelen. Fotochemisch kunnen reacties waarbij fenylradicalen betrokken zijn geïnitieerd worden.[3]

Bronnen, noten en/of referenties
- ↑ a b Sicherheitsdatenblatt American Element[1], Stand 15. Mai 2015.
- ↑ a b c d e Steele, W.V.: The standard enthalpies of formation of the triphenyl compounds of the group V elements. 2. Triphenylbismuth and the Ph-Bi mean bond-dissociation energy in J. Chem. Thermodyn. 11 (1979) S. 187–192, {{doi:10.1016/0021-9614(79)90170-8}}.
- ↑ a b c d e f g e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Triphenylbismuthine, abgerufen am 17. Mai 2019.
- ↑ a b c Elschenbroich, Ch.; Salzer, A.: Organometallchemie, Teubner Taschenbücher Chemie, 3. Auflage, B. G. Teubner Stuttgart 1993, ISBN 978-3-519-33501-6, doi:10.1007/978-3-322-96804-3, S. 183–196.
- ↑ Blicke, F.F.; Oakdale, U.O.; Smith, F.D.: Distibyls. I. Tetraphenyldistibyl. Attempts to Obtain Tetraphenyldibismuthyl in J. Am. Chem. Soc. 53 (1931) S. 1025–1029, doi:10.1021/ja01354a027.
- ↑ Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3. umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87823-0, S. 601.
- ↑ Hitomi Suzuki, Naoki Komatsu, Takuji Ogawa, Toshihiro Murafuji, Tohru Ikegami, Yoshihiro Matano: Organobismuth Chemistry, Elsevier, 1st edition 2001, ISBN 978-0-444-20528-5, S. 13, 20.
- ↑ a b Henry. Gilman, Harry L. Yale (1942-04). Organobismuth Compounds.. Chemical Reviews 30: 281–320.
- ↑ a b Eintrag zu Bismut-organische Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. April 2022.
- ↑ Wittig, G.; Clauß, K.: Pentaphenyl-wismut in Justus Liebigs Annalen der Chemie 578 (1952) 136–146, DOI:10.1002/jlac.19525780116.
|



















![{\displaystyle {\ce {(C6H5)3Bi + (C6H5)5Bi -> [(C6H5)4Bi]+[(C6H5)4Bi]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adfb809cb9861024c1c195c9f42c9b6241c2286f)

