Wnt-signalering

Wnt-signalering[1] (spreek uit: wint-signalering) omvat intracellulaire signaaltransducties die bepalend zijn voor differentiatie, proliferatie, migratie en polariteit van cellen tijdens de vroege embryonale ontwikkeling. De signalering is evolutionair gezien oud en is sterk geconserveerd gebleven in alle Metazoa (dieren). Wnts zijn glycoproteïnen die door cellen afgescheiden worden en zich vervolgens als ligand binden aan een membraanreceptor van dezelfde of een naburige cel. Binding van Wnt aan de receptor zet een signaaltransductieketen in gang, die uiteindelijk leidt tot modulatie van genexpressie.
Bij de mens bestaat het Wnt-systeem uit 19 genen, wat aangeeft dat de signaalregulatie en haar functie zeer complex zijn.[2] Samen met een vijftiental receptoren en co-receptoren is het aantal mogelijke combinaties met negentien Wnts enorm, wat het onderzoek naar de specifieke effecten bemoeilijkt.[3] De Wnt-eiwitten spelen een cruciale rol bij de aanleg van de lichaamsas in het vroege embryo. Ze bepalen de positionering van de ledematen in gewervelden, de vleugels in insecten en de parapodia in wormen.
De ligand Wnt en haar receptor[bewerken | brontekst bewerken]
De naam Wnt is samengesteld uit de namen van twee genen waarmee het homoloog is. Het gen van Drosophila melanogaster dat codeert voor de ontwikkeling van de vleugels wordt Wingless genoemd omdat mutatie leidt tot het verlies van de vleugels. Het tweede deel van de naam is bepaald door de homoloog in gewervelde dieren en is integrated ofwel int. Nadat de glycoproteine Wnt is gesynthetiseerd, wordt deze veresterd in het endoplasmatisch reticulum, wat resulteert in de covalente binding van palmitoleïnezuur aan een serine. Het Wnt-eiwit wordt vervolgens uitgescheiden via het celmembraan. Eenmaal buiten de cel, binden de uitgescheiden Wnt-eiwitten aan het N-terminale extracellulaire domein van de Frizzled (Fz)-receptor op het celmembraan. Daarmee wordt de intracellulaire signalering geactiveerd teneinde de genexpressie te moduleren. Elk van de 19 Wnts is een cysteïne-rijk eiwit met een lengte van 350-400 aminozuren, met een N-terminale signaalsequentie die er voor zorgt dat het eiwit door de cel uitgescheiden wordt[4] De eiwitten hebben zowel een autocriene als paracriene functie en kunnen respectievelijk de eigen cellen of naastliggende cellen moduleren.
Van de Fz-receptor familie komen er bij zoogdieren tien verschillende varianten voor.[4] Het Fz-eiwit is een proteïne met zeven transmembrane spanwijdten die homoloog zijn aan G-proteïne gekoppelde receptoren. Naast de interactie tussen Wnt en Fz zijn er ook co-receptoren nodig voor het doorgeven van Wnt-signalering.
Morfogenen[bewerken | brontekst bewerken]
Wnt-signalering maakt deel uit van morfogenen. Gedurende embryonale inductie wordt het eiwit Wnt afgescheiden door inducerende cellen en vormt een gradiënt langs de cellen en door de embryonale weefsels. Het gradiënt zo gecreëerd door deze signaaleiwitten, induceert patroonvorming (patterning) in de weefsels. Dit aflopende gradiënt vormt namelijk diverse drempelwaarden waarboven en waaronder verschillende genen tot uitdrukking komen. Op deze wijze ontstaat er op verschillende afstanden van de signaalbron een ruimtelijke patroonvorming van genexpressie.[5]
De neurale plaat van de zebravis is een morfogenetisch systeem waarin de Wnt/β-catenine-signalering een belangrijk morfogeen is dat de antero-posteriore-as bepaalt. Bij de zebravis wordt de Wnt/β-catenine-signalering tot expressie gebracht aan de embryonale rand waarna het verspreidt naar de eerste cellen van de neurale plaat. Dicht bij de rand worden de cellen blootgesteld aan hoge concentraties Wnt-liganden en vormen vervolgens de ruithersenen en het ruggenmerg. De cellen die daarentegen lagere concentraties ontvangen dragen bij aan het weefsel van de middenhersenen en de voorhersenen. Deze ontwikkeling van de neurale plaat bij de zebravis is een schoolvoorbeeld van het in 1960 door de ontwikkelingsbioloog Lewis Wolpert beschreven Franse vlagmodel.[5] Andere morfogenen zijn EGF, FGF en TGF-β.
De verschillende Wnt-signaleringsroutes[bewerken | brontekst bewerken]

- De β-catenine-afhankelijke signalering (canoniek) induceert proliferatie, differentiatie en maturatie van cellen. Bovendien regelt deze signalering de specificaties voor de lichaams-as. Deze wordt canoniek genoemd omdat ze de belangrijkste en de meest voorkomende van de Wnt-signaleringsroutes is.
- De β-catenine-onafhankelijke signalering (niet-canoniek), die onderverdeeld kan worden in:
- Planaire celpolariteit is een signaleringsroute die de expressie van genen als RhoA moduleren, met activatie van profiline dat het eiwit actine van het cytoskelet ruimtelijk bestuurt waarmee de polariteit van de cel[a] bepaald wordt en migratie geactiveerd wordt.
- Wnt/Ca2+ signalering activeert eveneens de polymerisatie van actine.
Deze routes kunnen elkaar soms versterken of juist verzwakken wat ook wel kruisactivering genoemd wordt.[4][6] Van deze drie signaleringsroutes is de canonieke β-catenine-afhankelijke het best onderzocht. Deze Wnt-signalering wordt in de bovenste figuur en in de volgende paragrafen toegelicht. Behalve deze bekende signaleringsroutes zijn er ook een aantal andere routes aan het licht gekomen. Deze routes kunnen gedeeltelijk overlappen met componenten van de planaire celpolariteit en Wnt/Ca2+ signalering, maar kunnen andere uitkomsten hebben.
De canonieke β-catenine-afhankelijke signalering[bewerken | brontekst bewerken]
Activering[bewerken | brontekst bewerken]
Wnt bindt zich aan receptoren Fz die zich in het membraan van omliggende cellen bevinden, met name bij stamcellen. Daar bindt Wnt zich via palmitoleïnezuur aan de receptor Fz en aan de andere zijde aan een coreceptor (LRP), waardoor een drievoudig complex ontstaat. Dit Wnt-frizzled-LRP-complex recruteert het intracellulaire Disheveled-eiwit (DVL) naar het intracellulaire domein van de frizzled-receptor en inactiveert het vernietigingscomplex (Axin, GSK3, APC, CK1) dat in actieve toestand β-catenine fosforyleert. Het β-catenine dat zo geen fosforylatie en ubiquitinatie heeft ondergaan, komt nu de celkern binnen en bindt zich aan de transcriptiefactor TCF1, waardoor de expressie wordt geïnduceerd van genen die betrokken zijn bij celdeling en proliferatie, zoals c-Myc en CyclinD.[4]
Deactivering[bewerken | brontekst bewerken]
In afwezigheid van Wnt kan de frizzled-receptor geen complex vormen met de coreceptor (LRP). In plaats daarvan bindt de LRP-coreceptor zich aan remmende receptoren. Zodoende is het vernietigingscomplex actief en fosforyleert het β-catenine. Het gefosforyleerde β-catenine wordt geubiquitineerd en afgebroken door het proteolytische proteasoom. In de celkern fungeert TCF-1 als een transcriptionele repressor, samen met de corepressor Groucho, om genexpressie te onderdrukken.[2][4]
Effecten[bewerken | brontekst bewerken]
Wnt-signalering heeft vele uiteenlopende effecten. De verschillende signaleringsroutes kunnen elkaar ook versterken of juist dempen. Gedurende de embryonale ontwikkeling kan Wnt-signalering embryonale stamcellen in hun pluripotente staat behouden.[7] Tijdens de gastrulatie daarentegen, veroorzaakt Wnt-signalering een down-regulatie van cadherine waardoor de cellen van het epiblast zich los kunnen maken om te migreren en de epitheel-mesenchymatische transitie (EMT) te ondergaan. Naast het belang van Wnt-signalering voor stamcellen, is ze ook onmisbaar gebleken voor de ontwikkeling van T-lymfocyten in de thymus.[3]
De ontregeling van Wnt-signalering heeft zeer ernstige gevolgen voor het zich ontwikkelende embryo en veroorzaakt geboorteafwijkingen waaronder de meest voorkomende een defecte neurale buissluiting, de spina bifida. Defecte Wnt-signalering is ook een oorzakelijke factor voor een aantal menselijke pathologieën, met name borstkanker, darmkanker, huidkanker en skeletafwijkingen.[2] De signaalroute is ook belangrijk in diabetes en hartziekten.[4] Ongecontroleerde Wnt-signalering is ook in verband gebracht met ziekten als maagkanker, osteoporose en neurodegeneratieve aandoeningen.
Wnt-proteïnen bij verschillende soorten[bewerken | brontekst bewerken]
| Species | Wnt-proteïnen |
|---|---|
| Homo sapiens | WNT1, WNT2, WNT2B, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A, WNT9B, WNT10A, WNT10B, WNT11, WNT16 |
| Mus musculus (Dezelfde proteïnen als in H. sapiens) | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt9A, Wnt9B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Xenopus | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt11R |
| Danio rerio | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Drosophila | Wg, DWnt2, DWnt3/5, DWnt 4, DWnt6, WntD/DWnt8, DWnt10 |
| Hydra | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| C. elegans | mom-2, lin-44, egl-20, cwn-1, cwn-2 [8] |
Afbeeldingen[bewerken | brontekst bewerken]
-
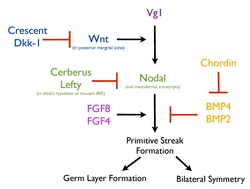
Een ingewikkeld netwerk van signalen en signaleringsroutes waarin de rode strepen een remmende werking aanduiden terwijl de zwarte pijlen de vorming van de primitiefstreep stimuleren.
-
Wnt 8c-expressie, gevolgd met in situ hybridisatie tijdens de vorming van de sikkel van Koller en de primitiefstreep in het embryo van de kip. In opeenvolgende stadia worden RNA’s van Wnt8c (A, D, G) en Chordin (B, E, H) tot expressie gebracht. Wnt zien we eerst in de Area Opaca (AO) vervolgens onderaan en daarna langs de primitiefstreep. In (C, F, I) is de groei waar te nemen door de (kleine) snelheidspijlen te volgen. Zwarte pijlen geven het voorste uiteinde van de primitiefstreep aan.
Zie ook[bewerken | brontekst bewerken]
- Embryonale inductie
- Organogenese
- Morfogenese
- Signaaltransductie
- Embryogenese
- Gastrulatie
- Primitiefstreep
Noten
Referenties
|