Actine

Actine is een eiwit dat onderdeel is van het cytoskelet in de eukaryote cel. Actinemoleculen maken onderdeel uit van actinefilamenten (ook wel microfilamenten genoemd), een polymeer van actinemonomeren. Actinefilamenten hebben een helixvorm met een diameter van 5 tot 9 nm (nanometer) en een spoed van 25 nm. (Spoed betekent hier dat over de lengte van 25 nm de helix één hele draai maakt.) Ze geven de cel vorm en maken het mogelijk dat de cel zich kan bewegen. In spiercellen zorgen ze samen met myosine voor samentrekking, waardoor spieren kracht uit kunnen oefenen. Bij de deling van een dierlijke cel spelen actine en myosine een rol bij de insnoering van de cel tot twee nieuwe.
Bij de gewervelden worden drie hoofdgroepen van actine-isovormen onderscheiden: alfa, bèta en gamma. De alfa-actinen komen voor in de spieren en zijn een hoofdbestanddeel van het contractieapparaat. De bèta- en gamma-actinen komen bij de meeste celtypen voor in het cytoskelet en zorgen voor bewegingsprocessen binnen de cel, zoals de verplaatsing van organellen.
 |
 |
Polymerisatie van actine-monomeren[bewerken | brontekst bewerken]
De polymerisatie (het aaneenrijgen) van actine-monomeren tot actine-filamenten kan zeer dynamisch plaatsvinden, afhankelijk van wat nodig is.
G-actine bindt het nucleotide ATP (adenosinetrifosfaat). Dit monomeer kan zich nu aan andere actinemoleculen binden - polymeriseren, waarbij ATP onder afsplitsing (hydrolyse) van een fosfaatrest overgaat in ADP (adenosinedifosfaat). De gevormde keten van actinemonomeren vormen zo de filamenteusevorm van het actinefilament, ook F-actine genoemd. Het filament bestaat uit twee ketens gepolymeriseerde G-actine-monomeren, die zich helix-vormig met elkaar verstrengelen.[1] De doorsnede bedraagt 7 nm. In de cel zijn beide vormen in evenwicht, waarbij monomeren hoofdzakelijk in een complex met actine-bindenden proteïnen voorkomen.
Elk actinefilament heeft een (+)-eind en een (-)-eind. ATP-actine bindt bij voorkeur aan het (+)-eind waardoor het filament aan dit eind groeit. Het ATP wordt vervolgens tot ADP gehydrolyseerd, waardoor de bindingssterkte tot de naburige actinen minder wordt. Aan het (-)-eind verloopt de hydrolyse van ATP tot ADP sneller dan de aanhechting van een nieuw ATP-actine, zodat ADP-actine dissocieert en het filament aan deze kant korter wordt. Actinemonomeren binden echter ATP sterker dan ADP, wisselen daardoor het nucleotide uit en kunnen weer aan het (+)-eind aangehecht worden. Deze snelle kringloop is voor de beweging van de cel belangrijk.[2]
Talrijke begeleidingsproteïnen sturen de polymerisatie- en afbraak. In spieren worden de filamenten bijvoorbeeld door het tropomyosine gestabiliseerd, dat zich aan de gehele lengte van een filament hecht.
Bepaalde proteïnen bedekken ook de einden van de filamenten en verhinderen of bevorderen zo de verlenging of de verdere afbraak. Andere proteïnen verhinderen of bevorderen de polymerisatie van G-actine of zorgen ervoor dat het F-actine wordt afgebroken. De proteïnen cofiline en ADF (actine depolymeriserende factor) bijvoorbeeld gaan aan het (-)-eind zitten en bevorderen hierdoor de dissociatie van actine. Het proteïne profiline daarentegen bevordert het vastmaken aan het (+)-eind. De binding van zowel cofiline als ook profiline wordt door het actinegebonden nucleotide bepaald.[3]
Ook posttranslationele modificaties van actine nemen aan de polymerisering deel. Zo krijgt ieder vijfde actine-monomeer in fibroblasten een arginylering, waardoor een verhoogde stabiliteit van de actinefilamenten wordt verkregen. Hierbij krijgt bèta-actine voorrang.[4] Bij de arginylering wordt het aminozuur arginine aan het N-terminale einde van proteïnen vastgemaakt.
Aanpassings- en verbindingsproteïnen[bewerken | brontekst bewerken]

Een grote groep van begeleidingsproteïnen, die ook als actinebindende proteïnen gekenmerkt worden, verknopen netvormig de actinefilamenten met elkaar en met andere proteïnen. Fimbrine, villine (binnengeraamte van de microvilli), filamine en espine vormen dwarsverbindingen, waardoor een mechanisch stijve bundel ontstaat. α-Actinine vormt ook een bundel, die met myosine verstijfd wordt. Het filamine vormt wederom een driedimensionaal net onder de celmembraan.
Actinefilamenten staan straalsgewijs in verbinding met twee celcontacten, de adhesie contact en het focale contact. Daarbij worden ze via adapterproteïnen aan de proteïnestructuren van de contacten verankerd. Verantwoordelijk daarvoor zijn onder andere weer het α-actinine, het vinculine en het taline. De proteïnen ezrine, radixine, moesine (ERM-proteïnen) maken voor korte tijd dynamische bindingen met het plasmamembraan, bijvoorbeeld bij verandering van de celvorm en bij actieve celbewegingen.
Bepaalde proteïnegroepen vormen een mechanisch stabiele verbinding tussen het onder de celmembraan liggend actinenet en het membraan. Deze wegens verscheidene erfelijke aandoeningen ook klinisch belangrijke proteïnen zijn dystrofine (o. a. in de spieren, bij mutaties van het dystrofine-complex ontstaat spierdystrofie) en spectrine (o.a. verantwoordelijk voor de vorm van erytrocyten, dat bij een defect leidt tot bijvoorbeeld congenitale sferocytose). Het betreffen lange, dunnere proteïnen die hun taken in complexen met talrijke andere proteïnen vervullen.
Myosine is het moleculair motorproteïne van actine. Het kopgedeelte van myosine bindt zich aan het actinefilament en gebruikt ATP-hydrolyse voor het verkrijgen van de benodigde energie om langs het filament te "lopen" richting het haakvormige (+)eind (met uitzondering van the myosine VI, dat zich beweegt naar het puntige (-)eind).
Samentrekking van de spier[bewerken | brontekst bewerken]
Het hier beschreven voorbeeld toont de beweging in de spier van het conventionele myosine II, waarbij de actine- en myosinedraden in elkaar geschoven worden. Het verloop is bij de onconventionele myosinen in principe hetzelfde, behalve dat hierbij een myosine-dimeer met zijn vracht langs een actinedraad „wandelt“. Daarbij bindt een myosinekop afwisselend, zodanig dat het lijkt alsof „een voet na de andere“ naar voren verplaatst wordt. De beweging verloopt gericht daar myosine op de actinedraad slechts in één richting wandelen kan. In de regel loopt myosine in de richting van het plus-eind van een actinedraad. Een uitzondering hierop is het myosine VI, dat zich in tegengestelde richting beweegt. Verschillende onconventionele myosine-klassen kunnen in beide richtingen langs het actine bewegen.
-
Tropomyosine bindt aan actine op de troponineplaats, waardoor de binding van myosine geblokkeerd wordt.
-
Troponine bindt aan calcium, waardoor tropomyosine los laat van het actine en myosine aan het actine kan binden.
-
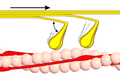
Dwarsverbindingcyclus (crossbridgecyclus) fase 1 - Myosine (geel) bindt aan actine (roze) op troponineplaats onder opname van Ca2+-ionen. De aangeduide hoek is ongeveer 90°.
-
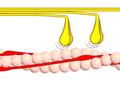
Dwarsverbindingcyclus fase 2 - Myosinekopjes (geel) vallen voorover en glijden zo langs het actine (roze). ATP gaat daarbij over in ADP en fosfaat. De aangeduide hoek is ongeveer 50°.
-
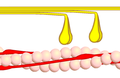
Dwarsverbindingcyclus fase 3 - Myosinekopjes (geel) laten los onder opname van ATP van het actine (roze).
-
Dwarsverbindingcyclus fase 4 - Myosine (geel) in rust. Actine (roze).
Functies[bewerken | brontekst bewerken]
Stabiliteit[bewerken | brontekst bewerken]
Actine vormt als bestanddeel van het cytoskelet onder het plasma membraan een dicht, stijf, driedimensionaal corticaal (buitenste laag) net, dat door de boven genoemde verbindingsproteïnen tot een net gevormd is. Op bepaalde, specifieke celplaatsen is het netwerk versterkt, bijvoorbeeld bij de membraanuitstulpingen (microvilli, pseudopodiën (schijnvoetjes) en synapsen) alsook bij bepaalde celcontacten (zonulae adhaerentes, zonulae occludentes) en dragen zo bij aan de vorm en stabiliteit van cellen en weefsels.
Verankering en transportweg[bewerken | brontekst bewerken]
Vele transmembraanproteïnen (kanalen, pompen, receptoren, celadhesieproteïnen) worden direct of indirect door het corticale netwerk op hun plaats gehouden. Functioneel bij elkaar horende proteïnen worden daardoor ook ruimtelijk dicht bij elkaar gehouden. Langs het actine net gaat ook het korte afstandtransport door myosine van vesikels naar het membraan, terwijl het lange afstandtransport van microtubuli door de motorproteïnen dyneïne en kinesine overgenomen wordt. Daarbij neemt myosine gedeeltelijk de aangeleverde vracht over van dyneïne/kinesine.
Celbeweging[bewerken | brontekst bewerken]
Vele eukaryotische cellen hebben een hoge mate van beweeglijkheid om bijvoorbeeld indringers in het lichaam onschadelijk te maken en wonden te helen, zoals fagocyten. Veel eencelligen zoals amoeben zijn zeer beweeglijk. Deze beweeglijkheid komt hoofdzakelijk door twee processen:
- de gerichte actinepolymerisatie in de richting van de beweging (geregeld door een aantal regulatoren die op signalen van de buitenkant van de cel reageren) en
- de actine-myosine-interactie in fibrillenbundels (stress fibers), contraherende trekdraden, die door de cel lopen en vormgevende elementen met de basis verbinden.
Voor het waarnemen van de celomgeving en voor het inslaan van een nieuwe bewegingsrichting, speelt de vorming van celuitstulpingen zoals filopodiën en lamellipodiën een belangrijke rol. Deze worden door actinefilamenten gevormd en gestabiliseerd.
Contractie[bewerken | brontekst bewerken]
De spiercontractie, alsook alle macroscopische lichaamsbewegingen en die van de organen (b. v. darmperistaltiek), is gebaseerd op de actine-myosine-wisselwerking. Daarbij zijn talrijke actinefilamenten, myosine II en andere proteïnen op een specifieke manier geordend.
Bronnen, noten en/of referenties
|