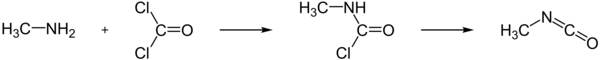Methylisocyanaat
| Methylisocyanaat | ||||||
|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||||

| ||||||
Structuurformule van methylisocyanaat
| ||||||
| Algemeen | ||||||
| Molecuulformule | C2H3NO | |||||
| IUPAC-naam | methylimino-oxomethaan | |||||
| Andere namen | methylcarbonimide, isocyanatomethaan, methylcarbylamine | |||||
| Molmassa | 57,05132 g/mol | |||||
| SMILES | CN=C=O
| |||||
| InChI | 1/C2H3NO/c1-3-2-4/h1H3
| |||||
| CAS-nummer | 624-83-9 | |||||
| EG-nummer | 210-866-3 | |||||
| PubChem | 12228 | |||||
| Wikidata | Q410431 | |||||
| Beschrijving | Vluchtige, kleurloze vloeistof | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
| ||||||
| H-zinnen | H225 - H361 - H330 - H311 - H301 - H334 - H317 - H335 - H315 - H318 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | geen | |||||
| Omgang | Niet inademen, contact en blootstelling vermijden | |||||
| Opslag | Stevig gesloten houden verwijderd van hitte, vonken en open vlammen; onder stikstofatmosfeer bewaren en nooit in contact laten komen met water | |||||
| EG-Index-nummer | 615-001-00-7 | |||||
| VN-nummer | 2480 | |||||
| MAC-waarde | 0,024 mg/m³ | |||||
| LD50 (ratten) | (huid) 2780 mg/kg (subcutaan) 261 mg/kg | |||||
| LD50 (konijnen) | (subcutaan) 126 mg/kg | |||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | vloeibaar | |||||
| Kleur | kleurloos | |||||
| Dichtheid | 0,967 g/cm³ | |||||
| Smeltpunt | −17 °C | |||||
| Kookpunt | 39 °C | |||||
| Vlampunt | −7 °C | |||||
| Zelfontbrandings- temperatuur | 534 °C | |||||
| Dampdruk | (bij 20°C) 46.400 Pa | |||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
| ||||||
Methylisocyanaat is een organische verbinding met als brutoformule CH3NCO. De stof komt voor als een kleurloze, zeer brandbare vloeistof, die hevig reageert met water.
Als methylisocyanaat in contact komt met lucht verspreidt ze zich razendsnel (zoals bij de gasramp in Bhopal in India van 1984). De damp is ongeveer 2 keer zo zwaar als lucht en verspreidt zich dus over de grond. Menging met de lucht erboven verloopt traag door het verschil in dichtheid.
Synthese[bewerken | brontekst bewerken]
Op industriële schaal wordt methylisocyanaat bereid door reactie van monomethylamine met fosgeen, waarbij eerst het intermediair N-methylcarbamoylchloride wordt gevormd. Na afsplitsing van waterstofchloride door verhitting tot 100-200 °C ontstaat daarbij het isocyanaat:
Toepassingen[bewerken | brontekst bewerken]
Methylisocyanaat wordt gebruikt voor het produceren van carbamaten. Dit gebeurt door reactie met een alcohol:
De reactie met amines (zowel primaire als secundaire) levert een methylureumderivaat:
Verder wordt het ingezet bij de bereiding van pesticiden (zoals carbaryl en aldicarb) en allerlei plastics.
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Inademing van methylisocyanaat kan onder meer leiden tot longoedeem. Het effect van methylisocyanaat op longen en slijmvliezen is terug te voeren op het feit dat de stof wordt gehydrolyseerd tot een onstabiel carbamidezuur:
Dit wordt gevolgd door vorming van monomethylamine onder afsplitsing van koolstofdioxide. Dit gevormde monomethylamine is zeer schadelijk voor de luchtwegen, omdat het zich als base gedraagt en de pH verhoogt. Bovendien wordt het benodigde water in deze reactie onttrokken aan het long- of slijmvliesweefsel.