Pentamethylstibine
| Pentamethylstibine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
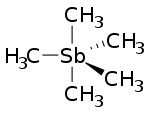
| ||||
Structuurformule van pentamethylstibine
| ||||
| Algemeen | ||||
| Molecuulformule | of | |||
| IUPAC-naam | Pentamethystiboraan | |||
| Andere namen | pentamethyl-λ5-stibane | |||
| SMILES | C[Sb](C)(C)(C)C
| |||
| CAS-nummer | 15120-50-0 | |||
| EG-nummer | 239-173-4 | |||
| PubChem | 123354 | |||
| Wikidata | Q30682550 | |||
| Beschrijving | Kleurloze vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| EG-Index-nummer | 239-173-4 | |||
| Fysische eigenschappen | ||||
| Smeltpunt | -19 °C | |||
| Kookpunt | 160 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Pentamethylstibine of pentamethylstiboraan is een organometaalverbinding waarin antimoon aan vijf methylgroepen gebonden is. De formule is dan ook , of met meer nadruk op de structuur: . Het is een voorbeeld van een hypervalente verbinding. De moleculaire vorm is een driehoekige bipiramide.[1] Verwante verbindingen zijn bijvoorbeeld pentapropenylstibine en pentafenylstibine . Binnen de stikstofgroep zijn ook pentamethylarsine en pentamethylbismutine bekend.
Synthese[bewerken | brontekst bewerken]
Pentamethylstibine kan verkregen wordne uit de reactie van trimethylstibinedibromide met twee equivalenten methyllithium. [2]
Een andere benadering gaat uit van trimethylstibine dat eerst wordt omgezet in het trimethyldichloride. Deze laatste stof wordt dan, ook, met metyhyllithium in de pemtamethylverbinding omgezet.[3]
Eigenschappen[bewerken | brontekst bewerken]
Pentamethylstibine is onder standaard condities een kleurloze vloeistof.[2] In vaste vorm kristalliseert het in het orthorombisch kristalstelsel in de ruimtegroep Ccmm. De dimensies van de eenheidscel zijn: a=663,0 pm b=1100,4 pm c=1109,0 pm. Per eenheidscel zijn er vier moleculen aanwezig. Het voliume van de eenheidscel is 809.1·106 pm3.[2] In de trigonale bipiramide zijn 3 equatoriale posities voor de methylgroepen en twee axiale. De lengte van de b-C-binding is voor de equatoriale koolstofatomen 2143 pm, voor de axiale 222 pm. De C-Sb-C bindingshoek tussen twee equatoriale koolstofatomen is 120°, tussen equatoriaal en axiaal geldt een hoek van 90°. DE positie van de methylgroepen ligt niet vast, zelfs bij -100 °C is de uitwisseling zo snel dat in het Proton-NMR slechts één signaal te zien is voor de waterstof-atomen.[3] In vergelijking met pentamethylbismutine is het stibine stabieler: het vrije elektronenpaar is in antimoon beter beschikbaar voor bindingen dan in bismut, waar relativistische aspecten, afscherming door de f-elektronen en de lanthanidencontractie dat paar erg inert maken.[2] Pentamethylstibine kan als vloeistof in schoon glaswerk bij kamertemperatuur bewaard worden.[4]
Pentamethylstibine smelt bij -19 °C. Bij zijn kooktemperatuur, 160 °C, ontleedt het, maar deze reactie kan ook explosief verlopen.[4]
In het ultraviolette deel van het spectrum heeft absorptiebanden bij 238 en 250 nm.[4]
Reacties[bewerken | brontekst bewerken]
- Methyllithium
- In THF reageert pentamethylstibine met methyllithium tot het kleurloze lithiumhexamethylstibaat. De solvatatie van lithium door THF speelt hierin een belangrijke rol:[2]

- Silsesquioxanes
- Met silsesquioxanen (zie voorbeeld hiernaast[noot 1] onder vorming van tetramethylstibonium-ionen. Met (de structuur hiernaast) bijvoorbeeld ontstaat . Dit is een snelle reactie als er meer dan 2 hydroxylgroepen in het silsesquioxaan voorkomen.[5]
- Fosforzuur, Fosfonzuren en onderfosforigzuren
- Met deze zuren worden tetramethylstiboniumverbindingen gevormd, onder gelijktijdige uitstaat van methaan:[6]
- Stannoceen
- Met stannoceen reageert pentamethylstibine ook onder vorming van stibonium-ionen, maar in tegenstelling tot de reacties met de fosforhoudende zuren treedt hier ook een verschuiving op in de liganden rond zink, er ontstaat bis(tetramethylstibonium)tetracyclopentadienylstannaat. Ten tijde van de ontdekking van deze reactie was dit de eerste reactie waarbij een anion op basis van een organotin(II)verbinding ontstond:[7]
- Zwakke zuren
- Met veel zwakke zuren reageert onder vorming van het stibonium-ion of een derivaat daarvan. Als zwakke zuren kunnen water, alcoholen, thiolen, fenolen, carbonzuren, waterstoffluoride, thiocyaanzuur, waterstofazide, difluorfosforzuur en thio-onderfosforigzuur.[8]
- Halogenen
- Met halogenen reageert pentamethylstibine met het uitwisselen van een of twee methylgroepen tegen het halogeen.[8]
- Lewiszuren
- Ook met lewiszuren worden tetramethylstibonoimzouten gevormd, waaronder en .[8]
- Siliciumdioxide of silicagel
- Met siliciumdioxide of silicagel reageert aan het opppervlak, waarbij -groepen ontstaan. Bij verwarmen boven de 250 °C ontleedt deze verbinding, waarbij trimethylstibine vrijkomt en een methylgroep op het silica-oppervlak gebonden blijft.[9]
| Bronnen, noten en/of referenties
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Pentamethylantimony op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Noten in de tekst
Verwijzingen in de tekst
|











![{\displaystyle {\ce {(CH3)5Sb\ +\ Ch3Li\ ->[{\ce {THF}}]\ Li_{(THF)}[Sb(CH3)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0bd5310b243638b73ce84b1a8c45bb27542e2f12)

![{\displaystyle {\ce {[Sb(CH3)4^{-}]3[(cyclo-C6H11)7Si7O9(O)3^{3-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/33b5deee5edd1638996dbe8d88e8e0cd91f3b8e9)
![{\displaystyle {\ce {H3PO4\ +\ (CH3)5Sb\ ->\ [Sb(CH3)4^{+}][P(O)(OH)2O^{-}]\ +CH4\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5877029cc01bbe8c6310ce341964cfc9096f6f5e)
![{\displaystyle {\ce {(C6H5)P(O)(OH)2\ +\ (CH3)5SbSb\ ->\ [(CH3)4Sb^{+}][(C6H5)P(O)2(OH)^{-}]\ +CH4\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c721089d2703e143a85184b40d39a2bedf8039e7)
![{\displaystyle {\ce {(C6HY5)2P(O)OH\ +\ (CH3)5SbSb\ ->\ [(CH3)4Sb^{+}][(C6H5)2P(O)2^{-}]\ +CH4\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8361128dcd8da27a9c42fd83b8ea0b9bcf0d0971)
![{\displaystyle {\ce {2Sb(CH3)5\ 2Sn(C5H5)2\ ->\ [Sb(CH3)4^{+}]2[Sn(C5H5)4^{2-}]\ +\ Sn(CH3)2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98b301dffa852bf50e1ae5df39da109f534c58c9)
![{\displaystyle {\ce {[Sb(CH3)4^{+}][TlBr3^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46499b4091769ebb4d1637ba0396cd15e3e3ead0)
![{\displaystyle {\ce {[Sb(CH3)4^{+}][Sb(CH3)Cl5^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07c22a6d211acfb5a7b2aa440f786f82a442adc0)
