Waterstofazide
| Waterstofazide | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
Structuurformule van waterstofazide
| |||||
| Algemeen | |||||
| Molecuulformule | HN3 | ||||
| IUPAC-naam | waterstofazide | ||||
| Molmassa | 43,02804 g/mol | ||||
| SMILES | N=[N+]=[N-]
| ||||
| InChI | 1S/HN3/c1-3-2/h1H
| ||||
| CAS-nummer | 7782-79-8 | ||||
| EG-nummer | 231-965-8 | ||||
| PubChem | 24530 | ||||
| Wikidata | Q408925 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H200 - H319 - H335 - H370 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P202 - P260 - P261 - P264 - P270 - P271 - P280 - P281 - P304+P340 - P305+P351+P338 - P307+P311 - P312 - P321 - P337+P313 - P372 - P374 - P380 - P401 - P403+P233 - P405 - P501 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 1,09 g/cm³ | ||||
| Smeltpunt | −80 °C | ||||
| Kookpunt | 37 °C | ||||
| Evenwichtsconstante(n) | pKa = 4,6 | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Waterstofazide is een anorganische verbinding van stikstof en waterstof, met als brutoformule HN3.
Synthese[bewerken | brontekst bewerken]
Waterstofazide kan onder andere bereid worden door de voorzichtige oxidatie van hydrazine met een waterige oplossing van salpeterzuur (bij 40 °C):
Een alternatieve methode is de reactie van hydrazine met salpeterigzuur:
Een gedeelte van het ontstane waterstofazide gaat echter verloren door reactie met salpeterigzuur:
In de praktijk kan het bereid worden als stockoplossing in tolueen, door een bifasische systeem van natriumazide in water en tolueen te behandelen met zwavelzuur. De tolueenfase kan dan gedecanteerd en in situ gebruikt worden.
Eigenschappen[bewerken | brontekst bewerken]
Waterstofazide is in waterige oplossing een zwak anorganisch zuur. In DMSO bedraagt de zuurconstante (pKa) 7,9.
In zuivere vorm is waterstofazide een gevaarlijke verbinding, omdat de zuivere stof tot explosies kan leiden. Bovendien is ze toxisch.
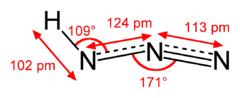
In de dampvorm bestaat de verbinding uit een lineair azidegedeelte, met een waterstofatoom onder een hoek van 110°52'. De twee N-N-bindingen zijn niet even lang. De drievoudige binding is 113 pm lang en de dubbele 124 pm. Het azidegedeelte wordt gekenmerkt door de aanwezigheid van twee resonantiestructuren:
Op dit zuur zijn zouten en esters gebaseerd die aziden genoemd worden.
Toepassingen[bewerken | brontekst bewerken]
Waterstofazide wordt hoofdzakelijk in de organische synthese toegepast om een azidefunctie in een organische verbinding te introduceren (via een Mitsunobu-reactie op een alcohol) of om via een 1,3-dipolaire cycloadditie een 1,2,3-triazool te bereiden. Voor toepassing bij dergelijke reacties kan het op relatief veilige wijze bereid worden door een bifasische systeem van water, waarin natriumazide is opgelost, en tolueen te behandelen met zwavelzuur. Het gevormde waterstofazide lost goed op in de tolueenfase, die kan gedecanteerd worden en gebruikt worden voor een specifieke transformatie.
Daarnaast kunnen uit waterstofazide talrijke anorganische zouten bereid worden, zoals natriumazide, kaliumazide, zilverazide of lood(II)azide. Deze verbindingen zijn stuk voor stuk zeer schokgevoelige stoffen.







