Methaan
| Methaan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van methaan
| ||||
| Algemeen | ||||
| Molecuulformule | CH4 | |||
| IUPAC-naam | methaan | |||
| Andere namen | moerasgas, grauwvuurgas, mijngas | |||
| Molmassa | 16,04 g/mol | |||
| SMILES | C
| |||
| CAS-nummer | 74-82-8 | |||
| Wikidata | Q37129 | |||
| Beschrijving | Brandbaar gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220 - H280[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P410+P403[1] | |||
| Omgang | Verwijderd houden van hitte, vonken en open vuur | |||
| Opslag | Brandveilig en koel bewaren. Verluchting langs de vloer en het plafond. | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | (gas, 25 °C, 1 atm) 0,656 × 10−3 g/cm³ (gas, 0 °C, 1 atm) 0,716 × 10−3 g/cm³ | |||
| Smeltpunt | −182,48 °C | |||
| Kookpunt | −164 °C | |||
| Vlampunt | −188 °C | |||
| Zelfontbrandings- temperatuur | 537 °C | |||
| Oplosbaarheid in water | (bij 20°C) 0,0227 g/L | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−74,81 kJ/mol | |||
| S |
83,7 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Methaan (CH4) is de eenvoudigste koolwaterstof en behoort tot de groep der alkanen. Het bezit een tetraëdrische moleculaire geometrie. Het centrale sp3-gehybridiseerde koolstofatoom is volledig verzadigd. Methaan is bij kamertemperatuur en bij atmosferische druk een gas. Het werd in 1778 ontdekt door Alessandro Volta.
Methaan, ook bekend onder de naam moerasgas, is het voornaamste bestanddeel van aardgas. Aardgas wordt in de natuur aangetroffen in samenhang met aardolie en andere fossiele brandstoffen, en heeft een vergelijkbare geologische oorsprong, ontstaan uit vergane resten organisch materiaal.
Ontstaan en bronnen[bewerken | brontekst bewerken]
Methaan kan ontstaan uit verschillende natuurlijke processen (aardkorst, zeebodem, draslanden en venen) of uit antropogene bronnen (fossiele industrie, bio-industrie, vuilnisbelten). Hoewel vrij nauwkeurig gemeten kan worden hoeveel methaan jaarlijks wordt uitgestoten, is het veel moeilijker precies na te gaan welke de bronnen zijn.[2]
Geologische bronnen[bewerken | brontekst bewerken]
De twee belangrijkste routes voor geologische methaanproductie zijn:
- organisch (thermisch gegenereerd, of thermogeen) . Thermogeen methaan komt voor door het uiteenvallen van organische materie bij hoge temperaturen en hoge druk in diepe sedimentaire lagen. Het meeste methaan in sedimentatiebekkens is thermogeen; daarom is thermogeen methaan de belangrijkste bron van aardgas.
- anorganisch of abiotisch, dit betekent dat methaan wordt gevormd uit anorganische verbindingen, zonder biologische activiteit, hetzij door magmatische processen of via water-rots-reacties die optreden bij lage temperaturen en drukken, zoals bij de vorming van serpentiniet.
Biologische bronnen[bewerken | brontekst bewerken]
Methaan ontstaat onder andere bij afbraak van organische stoffen door bacteriën onder anaerobe (zuurstofloze) omstandigheden. Anaerobe omstandigheden komen veelal in moerasbodems voor. Ook in zuurstofarme grond wordt onder andere door de afbraak van dode plantenwortels methaan gevormd. Ook bij bosbranden kan methaan ontstaan door verhitting van organische stof.
Veeteelt[bewerken | brontekst bewerken]
Herkauwers, maar vooral runderen, leveren met hun boeren en winden een grote bijdrage aan de wereldwijde uitstoot van methaangassen. Juist een hoog aandeel ruwvoer zorgt voor deze methaanproductie in de pens door middel van fermentatie door de bacteriën. De veeteelt zou zelfs bijna 40% van de menselijke uitstoot van methaan vertegenwoordigen.[3] Door aanpassingen van de samenstelling van krachtvoer zijn er mogelijkheden om dit te verminderen, alsmede met uitgekiend graslandbeheer.[4][5] Ook het gericht kruisen van rassen zou helpen.[3] In de omgeving van rundveehouderijen is dan ook een verhoogde concentratie van methaan aanwezig. Er zijn gevallen bekend waarin stallen in brand vlogen door een verhoogde concentratie methaan.[6]
Zeebodem[bewerken | brontekst bewerken]
Het grootste deel van de diepere zeebodem is anoxisch omdat zuurstof wordt onttrokken door aërobe micro-organismen in de bovenste paar centimeters van het sediment. In de zeebodem produceren methanogenen methaan dat door andere organismen wordt gebruikt, of in gashydraten wordt opgesloten. Deze andere organismen die methaan voor energie gebruiken, staan bekend als methanotrofen (methaaneters), en zijn de belangrijkste reden waarom weinig methaan uit de zeebodem het zeeoppervlak bereikt.
Industriële bronnen[bewerken | brontekst bewerken]
Methaanproductie[bewerken | brontekst bewerken]
Methaan wordt geproduceerd door hydrogenering van kooldioxide in een Sabatierreactie. Methaan is ook een bijproduct van de hydrogenering van koolmonoxide in het Fischer-Tropsch proces. Voor praktische toepassingen wordt methaangas verkocht in stalen cilinders.
Uit anaerobe vergisting van biologische afvalstoffen wordt methaan gewonnen voor productie van groene stroom of warmtekrachtkoppeling.
Fossiele energiebedrijven[bewerken | brontekst bewerken]
Bij de productie, verwerking en transport van fossiele energiebronnen (olie, aardgas, steenkool) komt methaangas vrij. En bij de fracking van schaliegas en schalieolie zou de uitstoot nog groter zijn.[7] Het aandeel van de fossiele industrie in de methaanuitstoot zou volgens onderzoek uit 2020 in het verleden sterk onderschat zijn geweest.[8] Met behulp van infraroodcamera's vonden Amerikaanse milieu-onderzoekers methaanlekken in de meeste van de 150 bezochte olie- en gasinstallaties in zeven Europese landen. Het rapport, uit 2021, concludeert dat het niet om toevallige lekken gaat, wellicht te wijten aan het ontbreken van controles en meldplicht.[9][10]
Chemie[bewerken | brontekst bewerken]
Moleculaire structuur[bewerken | brontekst bewerken]
Een methaanmolecule bestaat uit een centraal koolstofatoom met daarom vier waterstofatomen, gerangschikt volgens een symmetrische tetraëder. Deze symmetrie bepaalt in belangrijke mate de eigenschappen van methaan. Zo leidt de symmetrie ertoe dat methaan strikt apolair is, waardoor het gasvormig en weinig reactief is onder standaard omstandigheden.
Deze symmetrie kan theoretisch worden voorspeld met MO-theorie, en is ook experimenteel aangetoond met onder andere röntgendiffractie en UV/VIS-spectroscopie. Deze ontdekkingen hebben geleid tot de vorming van het hybridisatiemodel. Het koolstofatoom in methaan is sp3-gehybridiseerd. Dientengevolge zijn de koolstof-waterstofbindingen in methaan zeer sterk en verloopt bijvoorbeeld de deprotonering bijzonder moeizaam (de pKa van methaan ligt namelijk boven de 50).
Reacties[bewerken | brontekst bewerken]
Methaan is net als alle alkanen weinig reactief. Eigenlijk reageert het alleen met sterke oxidatoren zoals zuurstof(verbranding) of de halogenen. Een andere belangrijke reactie is stoomreforming.
Verbrandingsreacties[bewerken | brontekst bewerken]
De verbranding is als volgt:[11] (vormingsenthalpie ΔfHo = −891 kJ · mol−1)
Als er niet genoeg zuurstof is, zal de verbranding onvolledig zijn en ontstaat ook koolstofmonoxide (CO):
Of ook cokes:
Chloormethaanproductie[bewerken | brontekst bewerken]
Chloormethanen worden gemaakt door radicalaire reactie met chloorgas:[12]
Stoomreforming[bewerken | brontekst bewerken]
Methaan bevat de hoogste H/C verhouding van alle koolwaterstoffen, en daarom wordt methaan vaak gebruikt om waterstof te produceren. Hierbij worden methaan (doorgaans aardgas) en stoom onder verhoogde druk en temperatuur over een metalen katalysator geleid:
Deze reactie wordt vooral toegepast in het Haber-Boschproces, waarbij grote hoeveelheden waterstof nodig zijn voor de productie van ammoniak, en bij vergassing van biomassa om synthesegas te produceren.
Synthese[bewerken | brontekst bewerken]
Methaan kan worden gevormd uit gemakkelijk afbreekbare organische stoffen, zoals azijnzuur:
Natriumacetaat kan ook samen met natriumhydroxide methaan vormen:
Methaan kan ook uit koolstofdioxide en waterstofgas gevormd worden volgens de langzaam verlopende sabatierreactie:
Methaanhydraat[bewerken | brontekst bewerken]
Sedimenten op de oceaanbodems en in permafrostgebieden aan de onderzijde van de bevroren bodemlaag bevatten heel grote methaanvoorraden: methaan dat onder hoge druk een clatraat of insluitverbinding vormt met water (ijs), methaanhydraat of methaanijs, waarin methaan als gashydraat in vaste vorm aanwezig is. Soms ontsnapt een deel van dit methaan in gasvorm naar de oppervlakte. De methaanclatraten zouden, vanwege de grote omvang van de voorraden, potentieel een belangrijke energiebron kunnen vormen, maar de winning ervan op de bodem van de oceaan is met de huidige stand der techniek nog zeer moeilijk.
Klimaat[bewerken | brontekst bewerken]
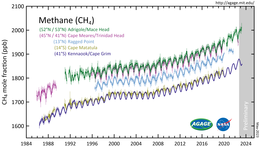
Atmosferisch methaan is schadelijk voor het klimaat, omdat het bijdraagt aan het versterkte broeikaseffect. Het is als broeikasgas ongeveer 25 keer zo sterk als koolstofdioxide.[13] Sinds 1750 is de hoeveelheid methaan in de lucht meer dan verdubbeld, waarbij sedert 2010 waarden van meer dan 1.800 ppb (1,85 ppm) worden gemeten. De stijging is voornamelijk te wijten aan de landbouw en het gebruik van fossiele brandstoffen.[14] Methaan heeft 0,5°C bijgedragen aan de netto opwarming van de aarde van 1,1°C sinds het pre-industriële tijdperk.[15] De levensduur van methaan in de atmosfeer is om en nabij de tien jaar. Hierdoor heeft vermindering van uitstoot al relatief snel effect.
Er wordt gevreesd dat stijging van de temperatuur op aarde zal leiden tot het ontdooien van de permafrost. Dit zou kunnen leiden tot het vrijkomen van grote hoeveelheden methaan en een verdere toename van het broeikaseffect. Amerikaanse onderzoekers van NOAA stelden tot hun verrassing een sterke toename vast van door bevers gemaakte poelen in de periode 2000-2020 in de toendra van Alaska. Kennelijk was de beverpopulatie door de opwarming van de Aarde in noordelijke richting opgeschoven. De ophoping van water in de vele poelen heeft er echter sterk bijgedragen tot de dooi van de permafrost.[16] Russische onderzoekers waren in 2021 bijzonder verontrust door zeer omvangrijke “gasbellen” van methaan in Siberië, ongetwijfeld het gevolg van de dooi van de permafrost:[17]
- in de Oost-Siberische Zee vond een onderzoeksschip een zestal “kraters” met een atmosferische methaanconcentratie van 16-32 ppm, dat is tot 15 maal het planetaire gemiddelde van 1,85 ppm
- in het Baikalmeer walmde methaan uit meer dan 20 onderwaterputten
- op de schiereilanden Jamal en Gyda werden reusachtige permafrostkraters ontdekt, naast een groot aantal kleinere methaanputten
- de Batagaika-krater wordt nog wijder, met instorting van permafrost aan de randen.
Tijdens de klimaatconferentie in Glasgow in 2021 hebben meer dan 100 landen niet-bindende afspraken gemaakt, in de zogenoemde Global Methane Pledge, om de mondiale uitstoot van methaan terug te dringen met 30 procent in 2030 ten opzichte van 2020.[18]
Volgens de Global Methane Tracker, een rapport dat het Internationaal Energieagentschap uitbrengt over de industriële uitstoot van methaan, was de energiesector in 2022 verantwoordelijk voor 135 miljoen ton aan methaanemissies in de atmosfeer, slechts een beetje minder dan de recorduitstoot van 2019[19]. De energiesector neemt ongeveer 40 % van de methaanuitstoot voor zijn rekening en bekleedt daarmee, wat de menselijke activiteit op aarde betreft, de tweede plaats na de landbouw. De ontginning en verwerking van steenkool, olie en aardgas zorgt telkens voor ongeveer 40 miljoen ton uitstoot terwijl bijna 5 miljoen ton afkomstig is van lekkende infrastructuur. Ongeveer 10 miljoen ton uitstoot wordt veroorzaakt door de onvolledige verbranding van biomassa, gebruikt voor verwarming en koken.
Toch zijn er volgens het Energieagentschap enorme, onbenutte, kansen om deze uitstoot te reduceren. Zowat 70 % van de industriële emissies zou kunnen worden teruggedrongen met bestaande technologieën. In de olie- en gassector kunnen de emissies met 70 % omlaag als vertrouwde en welbekende maatregelen zoals lekopsporing en reparaties worden toegepast en lekkende apparatuur wordt geüpgraded. Ook in de steenkoolsector kan meer dan de helft van de uitstoot worden opgevangen, eventueel ook door affakkeling of oxidatie wanneer recuperatie van energie niet mogelijk is. Ook door te zorgen voor wereldwijde toegang tot propere kookapparaten en moderne verwarming kunnen emissies ten gevolge van onvolledige verbranding worden aangepakt, hetgeen gunstige effecten zou hebben op de menselijke gezondheid.
Zie ook[bewerken | brontekst bewerken]
Externe links[bewerken | brontekst bewerken]
 methaan - International Chemical Safety Card
methaan - International Chemical Safety Card- (en) Gegevens van methaan in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van methaan
- Methaangas op Mars (Kennislink-artikel)
- (en) Bonding in methane










![{\displaystyle {\ce {CH4{}+2H2O->[{\text{katalysator}}]CO2{}+4H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4e289283232fa93071ff45fde8e1f7f179d4432)


