2,5-dimethylfuraan
| 2,5-dimethylfuraan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van 2,5-dimethylfuraan
| ||||
| Algemeen | ||||
| Molecuulformule | C6H8O | |||
| IUPAC-naam | 2,5-dimethylfuraan | |||
| Andere namen | dimethylfuraan, DMF | |||
| Molmassa | 96,13 g/mol | |||
| SMILES | Cc1ccc(o1)C
| |||
| InChI | 1/C6H8O/c1-5-3-4-6(2)7-5/h3-4H,1-2H3
| |||
| CAS-nummer | 625-86-5 | |||
| EG-nummer | 210-914-3 | |||
| PubChem | 12266 | |||
| Wikidata | Q209267 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 - H302 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Dichtheid | 0,8897 g/cm³ | |||
| Smeltpunt | −62 °C | |||
| Kookpunt | 92-94 °C | |||
| Vlampunt | −1[2] °C | |||
| Zelfontbrandings- temperatuur | 285,85[3] °C | |||
| Onoplosbaar in | water | |||
| Brekingsindex | 1,442[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
2,5-dimethylfuraan (kortweg: dimethylfuraan) is een heterocyclische verbinding met als brutoformule C6H8O. De naam van de stof wordt vaak afgekort tot DMF, al moet bij het gebruik van deze afkorting wel opgelet worden dat verwarring met dimethylformamide niet kan optreden. Dit furaanderivaat biedt perspectieven als biobrandstof: de productie vanuit cellulose is relatief eenvoudig.
Productie[bewerken | brontekst bewerken]
Fructose kan worden omgezet in 2,5-dimethylfuraan via een katalytisch biomassa-naar-vloeistofproces. Hydroxymethylfurfural is in deze omzetting een belangrijke tussenstap.[4][5] Fructose op zijn beurt kan verkregen worden uit glucose, de bouwsteen van cellulose.[6][7]
2,5-dimethylfuraan als biobrandstof[bewerken | brontekst bewerken]
Als biobrandstof heeft 2,5-dimethylfuraan een aantal gunstige eigenschappen:
- Chemisch gezien is de stof stabiel.
- De energiedichtheid is 40% groter dan die van ethanol, waarmee het vergelijkbaar is met benzine.
- De verdamping van 2,5-dimethylfuraan, noodzakelijke stap in de zuivering na productie, kost slechts 2/3 van de energie die voor een gelijke hoeveelheid ethanol nodig is,[4][8] hoewel het kookpunt zo'n 14 °C hoger ligt.
- 2,5-dimethylfuraan is onoplosbaar in water, wat omgekeerd betekent dat geen vocht uit de atmosfeer geabsorbeerd wordt.
De mogelijkheid om 2,5-dimethylfuraan snel en efficiënt te produceren op basis van fructose uit fruit en wortelgewassen, of uit glucose afkomstig uit zetmeel en cellulose - stoffen die ruim voorhanden zijn in de natuur - maken 2,5-dimethylfuraan een aantrekkelijke biobrandstof, hoewel een aantal veiligheidsaspecten nog wel opgelost moeten worden. Bio-ethanol en biodiesel vormen vooralsnog het leeuwendeel van de vloeibare biobrandstoffen.
De stoichiometrische lucht/brandstofverhouding voor 2,5-dimethylfuraan is 10,72 waar ethanol een waarde heeft van 8,95 en benzine 14,56 noteert.[3] Dit wil zeggen dat bij de verbranding van 2,5-dimethylfuraan ongeveer 33% minder lucht nodig is dan voor dezelfde hoeveelheid benzine, en ongeveer 20% meer lucht dan voor ethanol.
De specifieke energie van 2,5-dimethylfuraan bedraagt 33,7 MJ/kg, een middenwaarde vergeleken met ethanol (26,9 MJ/kg) en benzine (43,2 MJ/kg).[3] Het octaangetal van 2,5-dimethylfuraan is 119.[3] De verdampingswarmte bij 20 °C is 31,91 kJ/mol.[3] In een één-cilindermotor blijken 2,5-dimethylfuraan en benzine met hetzelfde rendement te verbranden.[9]
Andere toepassingen[bewerken | brontekst bewerken]
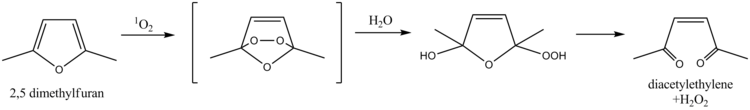
Met behulp van 2,5-dimethylfuraan kan singletzuurstof worden aangetoond, een eigenschap die wordt gebruikt deze vorm van zuurstof aan te tonen in oppervlaktewater. De bepaling berust op de diels-alderreactie tussen singletzuurstof en 2,5-dimethylfuraan, gevolgd door hydrolyse, waarbij uiteindelijk 3-hexeen-2,5-dion (in onderstaande figuur als diacetyletheen aangeduid) en waterstofperoxide worden gevormd. Ook het verwante furfurylalcohol is voor dit doel toegepast.[10]
2,5-dimethylfuraan is ook voorgesteld als interne standaard voor proton-NMR. Het geeft twee singletten in zijn 1H-NMR-spectrum: een bij 2,2 (de methylgroepen) en een bij 5,8 ppm (de vinylische protonen) ten opzichte van TMS. De onderlinge intensiteitsverhouding van de twee signalen komt goed overeen met de verwachte waarde en ook de positie geeft weinig problemen (overlap) met andere signalen.
2,5-dimethylfuraan is met een kookpunt van 92 °C (geen te snelle verdamping) als oplosmiddel goed bruikbaar. Dit kookpunt is toch zo laag dat 2,5-dimethylfuraan ook makkelijk via indampen of met behulp van een rotatiefilmverdamper uit een reactiemengsel te verwijderen is.[11]
2,5-dimethylfuraan in voedsel[bewerken | brontekst bewerken]
2,5-dimethylfuraan ontstaat tijdens de thermische ontleding van sommige suikers en is in zeer kleine hoeveelheden in gekaramelliseerde suikers aangetroffen.[12]
Toxicologie[bewerken | brontekst bewerken]
Samen met hexaan-2,5-dion en 4,5-dihydroxy-2-hexanon speelt 2,5-dimethylfuraan een rol in het menselijk metabolisme van hexaan. Als zodanig speelt het een rol in de neurotoxiciteit van dit alkaan.[13]
2,5-dimethylfuraan is aangetoond als een van de componenten in sigarenrook, die een (wel is waar klein) negatief effect hebben op de trilharen van longen en bronchi. Deze trilharen hebben een functie bij het verwijderen van lichaamsvreemde deeltjes.[14] De concentratie 2,5-dimethylfuraan in bloed kan gebruikt worden als biomarker van het rookgedrag.[15]
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|