Isotoop
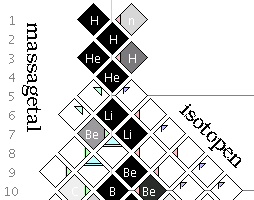
Isotopen zijn atomen van hetzelfde chemische element, en dus met hetzelfde aantal protonen, waarin de aantallen neutronen in de atoomkern verschillend zijn. Volgens gangbare modellen bestaat een atoom uit een atoomkern met daaromheen een wolk van elektronen. De kern bestaat uit een aantal protonen en een aantal neutronen. Het aantal protonen bepaalt het atoomnummer van het element en ook de chemische eigenschappen. Het aantal neutronen bepaalt onder meer de stabiliteit van de kern en, samen met het aantal protonen, de atoommassa. Twee atomen met hetzelfde aantal protonen maar een verschillend aantal neutronen noemt men isotopen van hetzelfde element. Als de elementen niet gespecificeerd worden, spreekt men van een nuclide.
De term is een samentrekking van twee Griekse woorden: isos (gelijk) en topos (plaats). Hiermee wordt benadrukt dat verschillende isotopen van hetzelfde element dezelfde plaats innemen in het periodiek systeem.
Massagetal en atoomnummer[bewerken | brontekst bewerken]
De chemische eigenschappen van een atoom worden vrijwel uitsluitend bepaald door het atoomnummer (Z), dus het aantal protonen. Het is daardoor vrijwel onmogelijk isotopen van hetzelfde element met chemische middelen van elkaar te scheiden.
De massa van het atoom wordt vrijwel geheel door de massa van de atoomkern bepaald. Dit aantal wordt weergegeven in het massagetal (A). Verschillende isotopen van hetzelfde element hebben hetzelfde atoomnummer maar dus altijd een verschillend massagetal (atoommassa).
Vanaf atoomnummer 20 komen enkel isotopen in de natuur voor waarvan het aantal neutronen groter is dan het aantal protonen. Met uitzondering van enkele lichtere isotopen (21H, 63Li, 105B, 147N en de semi-stabiele isotopen 4019K, 5023V, 13857La, 17671Lu en 180m173Ta) komen isotopen met zowel een oneven aantal protonen als een oneven aantal neutronen niet in de natuur voor. Dit wordt het odd-even effect genoemd.[1]
Van veel elementen komt in de natuur een "mengsel" van isotopen voor. De verhouding waarin isotopen voorkomen in een monster kan heel nauwkeurig worden bepaald met behulp van massaspectrometrie.
Voorbeeld: chloor[bewerken | brontekst bewerken]
Het element chloor bijvoorbeeld heeft atoomnummer 17. Alle chlooratomen hebben dus 17 protonen in de kern, maar in de natuur komen twee isotopen voor: driekwart van de atomen heeft 18 neutronen, de rest heeft 20 neutronen. Het massagetal is dus 17 + 18 = 35 of 17 + 20 = 37. De isotopen worden geschreven als 3517Cl en 3717Cl of als 35 Cl en 37 Cl of als Cl-35 en Cl-37. Met deze notatievormen is het niet nodig het aantal protonen en neutronen apart te vermelden, immers het symbool Cl staat in het periodieke systeem op de 17e plaats en heeft dus per definitie 17 protonen.
Chemie[bewerken | brontekst bewerken]
De chemische eigenschappen van isotopen van een element zijn bij benadering gelijk aan elkaar; slechts bij zeer nauwkeurige meting blijken er toch wel wat verschillen te zijn, dit heet het kinetisch-isotoopeffect. Vooral bij lichte elementen kunnen de chemische en meer nog de natuurkundige eigenschappen wel wat verschillen: zo is bijvoorbeeld het smeltpunt van ijs van zwaar water (D2O) ongeveer 4 °C in plaats van 0 °C. De sterkte van de waterstofbinding is afhankelijk van de isotoop van waterstof en dit heeft zelfs biochemische gevolgen omdat het het vouwen van eiwitten verandert. Organismes kunnen niet op puur zwaar water leven.
Biologie[bewerken | brontekst bewerken]
Aan de verhouding van de koolstofisotopen 126C en 136C van een plant kan worden gezien welke vorm van fotosynthese de plant gebruikt. De hoeveelheid 146C (een radio-isotoop van koolstof) wordt weer gebruikt om de ouderdom van koolstofbevattende organische resten te schatten tot enige tienduizenden jaren in het verleden (met C14-datering).
Radioactiviteit[bewerken | brontekst bewerken]
Bij het woord isotoop wordt vaak aan radioactiviteit gedacht. Inderdaad zijn er van elk element wel isotopen die niet stabiel zijn en na enige tijd veranderen door een proces van radioactief verval. Zulke isotopen worden radio-isotopen genoemd. Door het radioactief verval ontstaan uiteindelijk stabiele isotopen, meestal van een ander element dan het uitgangsmateriaal. Meer algemeen geldt dat isotopen kunnen verschillen qua mogelijke kernreacties, dus ook qua reactie op de inval in de atoomkern van een deeltje.
Links naar de isotopen per element[bewerken | brontekst bewerken]
| 1 | 18 | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | 2 | Periodiek systeem | 13 | 14 | 15 | 16 | 17 | He | |||||||||
| 2 | Li | Be | De links verwijzen naar isotopen per element | B | C | N | O | F | Ne | |||||||||
| 3 | Na | Mg | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | Al | Si | P | S | Cl | Ar |
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | ↓ | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | ↓↓ | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Lanthaniden | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| Actiniden | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
Zie ook[bewerken | brontekst bewerken]
- Isotopentabel (compleet)
- Isotopentabel (in delen)
- Isobaar (kernfysica)
- Isotoon (kernfysica)
- Isotopoloog
- Isotopomeer
| Bronnen, noten en/of referenties |
