Thio-ureum
| Thio-ureum | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
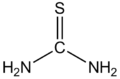
| |||||
Structuurformule van thio-ureum
| |||||
| Algemeen | |||||
| Molecuulformule | CH4N2S | ||||
| IUPAC-naam | thio-ureum | ||||
| Andere namen | thiocarbamide | ||||
| Molmassa | 76,12 g/mol | ||||
| SMILES | C(=S)(N)N
| ||||
| CAS-nummer | 62-56-6 | ||||
| PubChem | 2723790 | ||||
| Wikidata | Q528995 | ||||
| Vergelijkbaar met | ureum | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H351 - H411 - H361d | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 - P280 | ||||
| Carcinogeen | ja | ||||
| EG-Index-nummer | 612-082-00-0 | ||||
| VN-nummer | 2811 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 1,405 g/cm³ | ||||
| Smeltpunt | 182 °C | ||||
| Matig oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Thio-ureum, in de Engelssprekende landen ook bekend als Antu, is een organische verbinding bestaande uit koolstof, stikstof, zwavel en waterstof, met als brutoformule CH4N2S of (NH2)2CS, waarmee de structuur beter wordt weergegeven.
De verbinding lijkt qua structuur veel op ureum, met het belangrijke verschil dat het zuurstofatoom in ureum vervangen is door een zwavelatoom (vandaar het voorvoegsel thio- in de naam). De verschillen in eigenschappen tussen ureum en thio-ureum zijn gering en kunnen ten grote dele worden verklaard uit het verschil in elektronegativiteit tussen het zuurstof- en het zwavelatoom. Thio-ureum is een veel gebruikt reagens in de organische synthese. Een belangrijke toepassing van thio-ureum is het gebruikt in de synthese van pyrimidines, die op hun beurt worden gebruikt als bouwstenen voor herbicides, fungices en insecticides, maar ook in de synthese van medicijnen. Deze pyrimidines kunnen gesynthetiseerd worden door thio-ureum te condenseren met β-dicarbonyl-verbindingen.
De naam "thio-ureum" verwijst ook naar de groep verbindingen met als algemene structuur: (R1R2N)(R3R4N)C=S. Als groep zijn de thio-urea verwant aan de thioamiden, bijvoorbeeld RC(S)NR2, waarin R gelijk kan zijn aan methyl, ethyl, etc. De twee R-groepen hoeven niet gelijk te zijn of kunnen zelfs tot een ring aan elkaar gekoppeld zijn.
Structuur en binding
Thio-ureum is een vlakke molecule. De bindingsafstand voor de C=S-binding is voor een groot aantal, onderling ook sterk verschillende derivaten, bijna constant: 160±10 pm. Deze kleine spreiding geeft aan dat de C=S-binding nauwelijks betrokken is bij andere structuurelementen in het molecule.
Thio-ureum komt voor in twee tautomere vormen:

| |
| Thio-ureum | Isothio-ureum |
Synthese van thio-ureum
Wereldwijd ligt de jaarproductie van thio-ureum op ongeveer 10.000 ton. 40% daarvan wordt in Duitsland gemaakt, nog eens 40% in China. De resterende 20% wordt in Japan gemaakt. Thio-ureum kan gemaakt worden uit ammoniumthiocyanaat, daarmee is de synthese van de stof vergelijkbaar met die van ureum door Wöhler. De industriële synthese verloopt via de reactie van waterstofsulfide met Calciumcyaanamide onder Koolstofdioxide.[bron?]
Er zijn vele toepassingen voor thio-ureum en zijn derivaten.. N,N-ongesubstitueerde thio-urea worden doorgaans bereid door reactie van het corresponderende cyanamide met LiAlHSH met 1 mol.l−1 HCl in watervrije ether. LiAlHSH wordt gemaakt via een reactie tussen zwavel en LiAlH4.[bron?]

Toepassingen van thio-ureum
Peroxiden kunnen met behulp van thio-ureum tot de overeenkomstige diolen gereduceerd worden.[1] Het intermediair in deze synthese is het instabiele epidioxide. Alleen bij −100 °C is deze tussenstof aantoonbaar. Een epidioxide lijkt veel op een epoxide maar bevat twee, in plaats van één zuurstofatoom in de brug. Het epidioxide wordt door thio-ureum tot diol gereduceerd.

Het reducerend vermogen van thio-ureum wordt ook toegepast na ozonolyse. In het reducerend vervolg op de ozonolyse ontstaan carbonylverbindingen.[2] Dimethylsulfide is op zich genomen ook een goed reagens voor deze reactie, maar aan dit reagens zit "een luchtje" wat in combinatie met de hoge vluchtigheid (b.p. 37 °C) de balans snel doet doorslaan naar thio-ureum, een reukloze, niet vluchtige (ten gevolge van zijn polariteit) verbinding.

Thio-ureum wordt veel toegepast in de omzetting van alkylhalides in thiolen. Deze reactie verloopt via een isothiuroniumzout.[3] De reactie verloopt dankzij het gemak waarmee zwavel nucleofiele reacties aangaat en instabiliteit tegen hydrolyse van het gevormde isothiuroniumzout:
- CS(NH2)2 + RX → RSC(NH2)2+X−
- RSC(NH2)2+X− + 2 NaOH → RSNa + OC(NH2)2 + NaX
- RSNa + HCl → RSH + NaCl
In principe kunnen alkalisulfiden (natrium- en kaliumsulfide ook gebruikt worden om alkylhalogenides om te zetten in thiolen, maar bij de reactie van thio-ureum treedt de vorming van dialkylsulfiden, met de daaropvolgende scheidingsproblemen, niet op.

Thio-urea worden als bouwstenen gebruikt in de synthese van pyrimidines. Zo worden thio-urea met β-dicarbonylverbindingen omgezet naar de pyrimidines.[4] De aminogtroep in het thio-ureum reageert eerst met een van de carbonylgroepen, waarna ringsluiting en tautomerisatie de reactie afmaken. Na ontzwavelen ontstaat het pyrimidine.

Op gelijksoortige wijze worden aminothiazolen uit alfa-halo-ketonen en thio-ureum gemaakt.[5]

In een andere veelgebruikte toepassing wordt thio-ureum gebruikt als de bron voor zwavel in de bereiding van de semiconductor cadmium(II)sulfide. Een slurry van 1 gram cadmium(II)sulfaat (1,3 mmol), 0,5 gram thio-ureum (6,6 mmol) en 0,1 gram SiO2 (1,7 mmol) wordt gedurende 3 in een ultrasoonbad (kamertemperatuur, gewone lucht) behandeld. De eerst kleurloze slurry verandert in een gele, de kleur van cadmium(II)sulfide (CdS).
Thio-ureum wordt gebruikt in de productie van vlamvertragend schuim en versneller van het vulcanisatieproces. Thio-ureum wordt als toevoeging bij diazopapier gebruikt (licht-gevoelig fotokopiepapier). Het vloeibare schoonmaakmiddel voor zilver TarnX is in principe een oplossing van thio-ureum. Een vervanger van cyanide in het uitloogproces van zilver en goud kan verkregen worden via selectieve oxidatie van thio-ureum, waarbij ook het smelten van het nmetaal achterwege kan blijven.[6]
Veiligheid
Thio-ureum wordt als mogelijk kankerverwekkend en mutageen voor mensen beschouwd,[7]
Studies geven aan dat blootstelling aan thio-ureum kunnen leiden tot vergroting van de schildklier. In ratten is de relatie aangetoond tussen chronische blootstelling en tumoren in de lever. Mogelijk zijn er ook gevolgen voor het beenmerg.
De stof mag in Groot-Brittannië niet meer als gewasbeschermingsmiddel gebruikt worden.[8]
Literatuur
- The Chemistry of double-bonded functional groups edited by S. Patai. pp 1355–1496. John Wiley & Sons. New York, NY, 1977. ISBN 0-471-92493-8.
Externe links
- ↑ C. Kaneko, A. Sugimoro, and S. Tanaka (1974). A facile one-step synthesis of cis-2-cyclopentene and cis-2-cyclohexene-1,4-diols from the corresponding cyclodienes. Synthesis 1974: 876. DOI: 10.1055/s-1974-23462.
- ↑ Gupta, D., Soman, G., and Dev, S. (1982). Thiourea, a convenient reagent for the reductive cleavage of olefin ozonolysis products. Tetrahedron 38: 3013. DOI: 10.1016/0040-4020(82)80187-7.
- ↑ (en) A.J. Speziale (1963) - Ethanedithiol, Organic Syntheses, 4, p. 401
- ↑ (en) H.M. Foster & H.R. Snyder (1963) - 4-Methyl-6-hydroxypyrimidine, Organic Syntheses, 4, p. 638
- ↑ Dodson, R. M., and King, L. C. (1945). The reaction of ketones with halogens and thiourea. J. Am. Chem. Soc. 67: 2242. DOI: 10.1021/ja01228a059.
- ↑ Anthony Esposito. “Peñoles, UAM unveil pilot thiourea Au-Ag leaching plant - Mexico”. Business News Americas (July 13, 2007).
- ↑ artikel Engelse Wikipedia
- ↑ Chemicals Regulation Directorate, Banned and Non-Authorised Pesticides in the United Kingdom. Geraadpleegd op 1 december 2009.



