Lithiumaluminiumhydride
| Lithiumaluminiumhydride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
Structuurformule van lithiumaluminiumhydride
| |||||

| |||||
Kristalstructuur van lithiumaluminiumhydride
| |||||

| |||||
Lithiumaluminiumhydride
| |||||
| Algemeen | |||||
| Molecuulformule | LiAlH4 | ||||
| IUPAC-naam | lithiumaluminiumhydride | ||||
| Andere namen | lithiumtetrahydridoaluminaat | ||||
| Molmassa | 37,954298 g/mol | ||||
| SMILES | [Al-]([H])([H])([H])[H].[Li+]
| ||||
| InChI | 1S/Al.Li.4H/q-1;+1;;;;
| ||||
| CAS-nummer | 16853-85-3 | ||||
| PubChem | 21226445 | ||||
| Wikidata | Q409574 | ||||
| Beschrijving | Witte kristallen | ||||
| Vergelijkbaar met | natriumboorhydride | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H260 - H314 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P223 - P231+P232 - P280 - P335+P334 - P370+P378 - P402+P404 | ||||
| Hygroscopisch? | ja | ||||
| Opslag | Luchtdicht en goed gesloten bewaren. Zo droog mogelijk opslaan. | ||||
| EG-Index-nummer | 001-002-00-4 | ||||
| VN-nummer | 1410 | ||||
| ADR-klasse | Gevarenklasse 4.3 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 0,917 g/cm³ | ||||
| Smeltpunt | (ontleding) 150 °C | ||||
| Vlampunt | 125 °C | ||||
| Goed oplosbaar in | di-ethylether, tetrahydrofuran | ||||
| Onoplosbaar in | chloroform, benzeen, petroleumether | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | monoklien | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH |
−119[1] kJ/mol | ||||
| C |
2,01[1] J/mol·K | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Lithiumaluminiumhydride (LAH) is een anorganische ionaire verbinding van lithium, aluminium en waterstof, met als brutoformule LiAlH4. De stof komt voor als hygroscopische en corrosieve witte kristallen, die hevig reageren met water.
Lithiumaluminiumhydride werd ontdekt en voor het eerst beschreven door Finholt, Bond en Schlesinger in 1947.[2] Het is een belangrijke verbinding in zowel de organische als de anorganische chemie. Het speelt onder meer een rol bij organische syntheses, waar het wordt gebruikt bij reductie van uiteenlopende chemische verbindingen, waaronder ketonen, esters, carbonzuren en amiden.
Onderzocht wordt of lithiumaluminiumhydride kan dienen om waterstof op te slaan. Het komt niet in de natuur voor, ook niet in minerale vorm.
Synthese[bewerken | brontekst bewerken]
Lithiumaluminiumhydride werd voor het eerst bereid door reactie van lithiumhydride (LiH) en aluminiumchloride:[2][3]
Deze methode wordt nu nog maar zelden toegepast, omdat het toevoegen van een overmaat aan aluminiumchloride leidt tot de vorming van aluminiumhydride. De huidige industriële synthese vindt plaats door middel van vorming van natriumaluminiumhydride. Eerst reageren metallisch natrium, aluminium en waterstofgas met elkaar onder hoge druk en temperatuur:[4]
Vervolgens wordt het gevormde natriumaluminiumhydride in metathesereactie gebracht met lithiumchloride:[4]
Dit proces levert een groot percentage LAH op: er blijft nog ongeveer 1% LiCl in het LAH achter.[4]
De grootste producent van lithium en lithiumaluminiumhydride is het Duitse bedrijf Chemetall GmbH. De productie verloopt grotendeels ten behoeve van academisch onderzoek.
Structuur en eigenschappen[bewerken | brontekst bewerken]
Algemene eigenschappen[bewerken | brontekst bewerken]
In zuivere vorm is lithiumaluminiumhydride een witte kristallijne en pyrofore vaste stof, maar door onzuiverheden kan het grijs verkleuren.[3][5] De onzuiverheden kunnen verwijderd worden door herkristallisatie in di-ethylether. Om grove onzuiverheden te verwijderen is een Soxhlet-apparaat nodig. Toch kan ook het onzuivere product gebruikt worden in organische synthese, gezien de onzuiverheden (anorganische zouten) in de meeste gevallen niet veel kwaad doen aan het verloop van de reactie zelf.
Sommige monsters commercieel verkrijgbare LAH bevatten een hoeveelheid minerale olie om nevenreacties met vochtige lucht te voorkomen (het polaire water lost immers niet op in de apolaire olie, waardoor het LAH onbereikbaar is voor het vocht). LAH kan ook in oplossing worden verkregen. Het zuivere product is erg gevoelig voor vocht en water.[5] In contact met water zal het ontleden. Hierbij komen onder meer lithiumhydroxide en waterstofgas vrij:
De enthalpie van deze reactie bedraagt −714 kJ/mol bij 298 K.[1]
Kristalstructuur[bewerken | brontekst bewerken]
Lithiumaluminiumhydride kan worden opgevat als een ionaire verbinding tussen het lithium-ion (Li+) en het tetraëdrische tetrahydroaluminaat-ion (AlH4−). In de α-vorm wordt ieder lithium-ion omringd door 5 tetrahydroaluminaat-ionen. Het kristalliseert uit in een monoklien kristalstelsel en behoort tot ruimtegroep P21c. De parameters van de eenheidscel bedragen:
Onder invloed van hoge druk (> 2,2 GPa) treedt een faseverandering op naar de β-vorm.[6]
 |
Oplosbaarheid[bewerken | brontekst bewerken]
Lithiumaluminiumhydride is oplosbaar in verschillende ethers. Hoewel de oplosbaarheid in di-ethylether groter is dan die in THF, wordt deze laatste verbinding als oplosmiddel toch verkozen boven di-ethylether, omdat LAH spontaan ontleedt en polymeriseert in di-ethylether.[7] Een verzadigde oplossing van LAH in THF of di-ethylether kan enkel verkregen worden na een aantal dagen refluxen. Daarom wordt bij de meeste reacties gestaag zuiver LAH toegevoegd aan een onverzadigde oplossing.[1]
Onderstaande tabel geeft een overzicht van de oplosbaarheid van LAH in verschillende organische oplosmiddelen bij verschillende temperaturen:[7]
| Oplosbaarheid van LiAlH4 (mol/L) | |||||
|---|---|---|---|---|---|
| Temperatuur (K) | |||||
| Oplosmiddel | 273 | 298 | 323 | 348 | 373 |
| di-ethylether | – | 5,92 | – | – | – |
| THF | – | 2,96 | – | – | – |
| DME | 1,29 | 1,80 | 2,57 | 3,09 | 3,34 |
| diglyme | 0,26 | 1,29 | 1,54 | 2,06 | 2,06 |
| triglyme | 0,56 | 0,77 | 1,29 | 1,80 | 2,06 |
| tetraglyme | 0,77 | 1,54 | 2,06 | 2,06 | 1,54 |
| 1,4-dioxaan | – | 0,03 | – | – | – |
| dibutylether | – | 0,56 | – | – | – |
| methyl-tert-butylether | – | 0,168 | – | – | – |
Thermodynamische gegevens[bewerken | brontekst bewerken]
Onderstaande tabel geeft een overzicht van enkele thermodynamische gegevens voor reacties die een rol spelen bij de vorming van LiAlH4:[8][9]
| Reactie | ΔH° (kJ/mol) |
ΔS° (J/mol·K) |
ΔG° (kJ/mol) |
|---|---|---|---|
| −116,3 | −240,1 | −44,7 | |
| −25,6 | −170,2 | 23,6 | |
| 22 | – | – | |
| 3,46 | 104,5 | −27,68 |
Thermische ontleding[bewerken | brontekst bewerken]
Lithiumaluminiumhydride is bij kamertemperatuur metastabiel. Indien het lange tijd wordt opgeslagen, ontleedt het traag tot Li3AlH6 en LiH.[10] Dit proces kan versneld worden door aanwezigheid van katalytische elementen, zoals titanium, ijzer of vanadium. Bij verhitting zal LAH ontleden in 3 stappen:[10][11][12]
Reactie 1 wordt meestal geïnitieerd door het smelten van LAH bij een temperatuur van 423-443 K, wat leidt tot de vorming van Li3AlH6. Bij circa 473 K zal dit Li3AlH6 ontleden tot LiH, Al en H2 (reactie 2). Boven 673 K wordt LiAl gevormd (reactie 3). De eerste reactie is irreversibel. Reactie 3 is wel reversibel en heeft bij 773 K een evenwichtsdruk van ongeveer 0,25 bar.
Toepassingen[bewerken | brontekst bewerken]
Lithiumaluminiumhydride kent weinig industriële toepassingen. Het wordt voornamelijk in het laboratorium bij academisch onderzoek gebruikt. Soms wordt het op industrieel niveau aangewend bij reducties op grote schaal. Daarvoor dienen wel bepaalde voorzorgsmaatregelen te worden genomen:[1]
- De installatie moet volledig watervrij zijn.
- Er moet goede ventilatie aanwezig zijn om bepaalde vrijgekomen dampen of gassen onmiddellijk te verwijderen.
- De installatie moet voorzien zijn van explosie-vrije elektrische schakelingen, om ontsteking van eventueel vrijkomend waterstofgas te vermijden.
In de meeste gevallen zal echter getracht worden om een geschikt alternatief te zoeken voor het meestal lastig hanteerbare lithiumaluminiumhydride. Vooral de vochtgevoeligheid, de ontvlambaarheid en de irritatie na aanraking met huid of ogen zijn hier debet aan. Ook het werken met verzadigde oplossingen van LAH in ethers vormt vaak een probleem bij syntheses.
Watervrij maken van oplosmiddelen[bewerken | brontekst bewerken]
Oplosmiddelen die ingezet worden in reacties waarbij absoluut geen water (of beter: zure waterstofatomen of H+) aanwezig mag zijn, worden op laboratoriumschaal van LAH gedestilleerd. Eventueel aanwezig water reageert met LAH tot niet vluchtige verbindingen en blijft in het destillatieresidu; het oplosmiddel wordt zuiver als destillaat verkregen. Voor (zeer) hygroscopische oplosmiddelen geldt dat ze voorgedroogd moeten worden op bijvoorbeeld magnesium- of natriumsulfaat.
Reacties waarbij dit principe een rol speelt zijn onder andere:
- Wittig-reactie en zijn varianten, zoals de Horner-Wadsworth-Emmons-reactie
- Peterson-olefinering
Toepassingen in organische chemie[bewerken | brontekst bewerken]
Lithiumaluminiumhydride wordt vaak en voornamelijk gebruikt in de organisch chemie als reductor. Het is krachtiger (en dus reactiever) dan het vergelijkbare reagens natriumboorhydride, omdat de Al-H-binding zwakker is dan de B-H-binding. Hierdoor wordt het hydride (H−) bij LAH makkelijk afgestaan en is het bijgevolg een sterkere reductor. Lithiumaluminiumhydride kan niet worden ingezet om alkenen, alkynen of aromatische verbindingen te reduceren, enkel wanneer een alcoholfunctie zich dicht bij de dubbele of drievoudige binding bevindt.[13] Als oplosmiddel worden voornamelijk ether en THF gebruikt. Alcoholen, amines, gehalogeneerde verbindingen en sterke zuren moeten vermeden worden.
De hoeveelheid H− die per gram LAH kan gevormd worden bedraagt 105,4 × 10−3 mol.[1] Dit wordt het reductie-equivalent genoemd.
Reductie van carbonzuren, aldehyden en ketonen[bewerken | brontekst bewerken]
In laboratoria wordt het meestal in een oplossing van di-ethylether en in zuur milieu aangewend bij de reductie van carbonzuren,[14] aldehyden en ketonen[15] tot de overeenkomstige alcoholen:
Het reactiemechanisme verloopt voor de drie stofklassen middels een nucleofiele additie. Hierbij wordt de partieel gepolariseerde carbonylgroep (C=O-groep) gereduceerd tot een hydroxylgroep (OH-groep), door een nucleofiele aanval van het hydride op het carbonylkoolstof. Hierdoor komen de elektronen uit de dubbele C-O-binding op zuurstof te zitten, die daarmee volledig negatief geladen wordt. Een van de vrije elektronenparen op dit zuurstofatoom zal dan een binding aangaan met het elektrofiele waterstofion (H+), afkomstig van het zuur milieu. Hierbij wordt dan de hydroxylgroep gevormd.
Voor de reductie van carbonzuren wordt vrijwel altijd LAH gebruikt, maar aldehyden en ketonen kunnen ook door de mildere reductor natriumboorhydride worden gereduceerd. Zo worden α,β-onverzadigde ketonen gereduceerd tot allylalcoholen.[16]
Reductie van esters[bewerken | brontekst bewerken]
Esters worden gereduceerd tot primaire alcoholen:[17]
Het reactiemechanisme van deze reductie is iets anders dan dat bij andere carbonylverbindingen. Het verloopt middels een nucleofiele acylsubstitutie, gevolgd door een nucleofiele additie. Het nucleofiele hydride, afkomstig van LAH, addeert aan het elektrofiele carbonylkoolstof. Hierbij verschuiven de elektronen uit de dubbele binding naar zuurstof, waarbij een reactief intermediair tetraëdrisch complex met aluminium wordt gevormd. Dit intermediair complex is echter zeer onstabiel en de bindingselektronen van zuurstof naar het aluminiumatoom komen terug op zuurstof te zitten. Hierbij wordt, door elektronenverschuiving, het alkoxide afgesplitst, waarbij een intermediair aldehyde ontstaat. Bij de volgende stap zal een nieuw hydride adderen aan het carbonylkoolstof, waarbij opnieuw het reactieve aluminiumcomplex ontstaat. Het zuurstofatoom wordt bijgevolg opnieuw negatief geladen. Uiteindelijk vindt een klassieke zuur-basereactie plaats, waarbij een proton (H+) addeert aan het negatief geladen zuurstofatoom en op die manier een hydroxylgroep (-OH) wordt gevormd.
Opmerkelijk is dat esters wel door lithiumaluminiumhydride, maar niet door de analoge verbinding natriumboorhydride gereduceerd kunnen worden. Dit komt doordat esters
- minder reactief zijn tegenover nucleofielen dan aldehyden of ketonen. Daardoor is een reactiever reductiemiddel vereist.
- natriumboorhydride door de sterkere boor-waterstofbinding minder reactief is en dus niet geschikt als reductor.
De reactie van LAH met ethylacetaat wordt in het laboratorium gebruikt om resten LAH te vernietigen. Reiniging van reactievaten met waterige oplossingen om de anorganische zouten te verwijderen wordt onmogelijk door de risico's die verbonden zijn aan de warmte- en waterstofgasontwikkeling bij de reactie van LAH met het schoonmaakwater.
Reductie tot amines[bewerken | brontekst bewerken]
Op vergelijkbare wijze worden amiden,[18] nitroverbindingen,[19] nitrilen,[20] imines, oximen en aziden[21] gereduceerd tot amines. Eveneens kunnen quaternaire ammoniumzouten gereduceerd worden tot tertiaire amines.
Het reactiemechanisme is analoog aan dat van de reductie van esters: via een nucleofiele acylsubsitutie gevolgd door een nucleofiele additie. Echter, wanneer het reactieve intermediair complex met aluminium wordt gevormd, verschuift het elektronenpaar van stikstof naar de binding tussen het carbonylkoolstof en het stikstofatoom, waardoor het aluminium-alkoxide wordt afgesplitst en het stikstofatoom positief geladen wordt. Hierna zal een nieuw hydride adderen aan het carbonylkoolstof en zullen de π-elektronen uit de ontstane dubbele C-N-binding terug naar stikstof verhuizen, waardoor een amine wordt gevormd.[18]
Naast reductie met LAH, kunnen nitrilen ook gereduceerd worden via katalytische hydrogenering met palladium:
Reductie van alkylhalogeniden[bewerken | brontekst bewerken]
Lithiumaluminiumhydride wordt ook aangewend bij de reductie van alkylhalogeniden tot alkanen, hoewel deze reactie weinig wordt toegepast en uitsluitend bij academisch onderzoek wordt aangewend.[22][23] De alkyljodiden reageren het snelst, gevolgd door de alkylbromiden en de alkylchloriden. Primaire halogeniden zijn reactiever dan secundaire halogeniden, terwijl tertiaire halogeniden enkel onder welbepaalde omstandigheden kunnen reageren.[24]
Reductie van epoxiden[bewerken | brontekst bewerken]
Wanneer epoxiden worden gereduceerd met lithiumaluminiumhydride, zal steeds de minst (sterisch) gehinderde zijde van het epoxide worden aangevallen. Hierbij ontstaat meestal een secundair of tertiair alcohol.
Cyclohexeenoxide en diens derivaten worden gereduceerd tot axiale alcoholen.[25][26]
Alternatieve verbindingen[bewerken | brontekst bewerken]
Door de reactiviteit van de verbinding wordt LAH enkel in laboratoria en op kleine industriële schaal gebruikt. Op grote industriële schaal wordt natriumbis(2-methoxyethoxy)aluminiumhydride meer gebruikt.[27] De voornaamste verschillen met LAH is de selectieve reductie van nitrilen tot aldehyden en de reductie van aromatische aldehyden, zoals benzaldehyde. Bovendien is het makkelijker hanteerbaar, doordat het oplosbaar is in de meeste organische oplosmiddelen en inert in lucht.
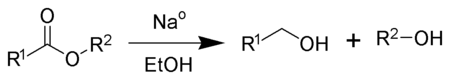
Bij de Bouveault-Blanc-reductie wordt als reductor-alternatief voor LAH het goedkopere natrium gebruikt. Tijdens de reactie wordt een ester omgezet tot twee verschillende alcoholen, met metallisch natrium in een alcohol (meestal ethanol):
Deze reductiereactie met natrium wordt op industriële schaal gebruikt voor de reductie van esters.[28][29][30]
Een partiële reductie van zuurchloriden met LAH tot het corresponderende aldehyde kan niet uitgevoerd worden, omdat LAH het zuurchloride volledig reduceert tot een primair alcohol. Het mildere lithiumaluminiumtri(tert-butoxy)hydride kan hiervoor wel gebruikt worden.
Tosylaten, esters of zouten van p-tolueensulfonzuur, kunnen door LAH worden gereduceerd, maar deze reductie is minder efficiënt dan de reductie met natriumcyanoboorhydride. Een oplossing van natriumcyanoboorhydride in hexamethylfosfortriamide is een effectieve, selectieve en milde methode om zowel tosylaten als alkylhalogeniden te reduceren.[31] Bovendien worden zelden alkenen als bijproduct gevormd, in tegenstelling tot de reductie met lithiumaluminiumhydride of natriumboorhydride in diglyme.[31]
Toepassingen in anorganische chemie[bewerken | brontekst bewerken]
Lithiumaluminiumhydride wordt in de anorganische chemie aangewend om met hoofdgroep- en transitiemetalen metaalhydriden te bereiden uit de overeenkomstige metaalhalogeniden. Een voorbeeld is de bereiding van aluminiumhydride, uitgaande van aluminiumchloride en LAH:
Dit werkt ook met alkalimetalen. Zo kan bijvoorbeeld natriumhydride (NaH) bereid worden uit natriumchloride (NaCl) middels onderstaande reactie:[32]
LAH reageert met tal van anorganische liganden, waarbij coördinatieverbindingen van aluminium gevormd worden. Een voorbeeld is de reactie van LAH met ammoniak:[32]
Enkele anorganische verbindingen, waaronder chroom(II)chloride, kunnen door reductie met LAH bereid worden:
Waterstofopslag[bewerken | brontekst bewerken]
Lithiumaluminiumhydride bestaat voor 10,6% (massaprocent) uit waterstof, wat het een potentiële opslag voor waterstof maakt, ten bate van voertuigen die werken met een brandstofcel. Deze hoge fractie waterstof heeft het onderzoek naar LAH als mogelijke waterstofopslag aangezwengeld. Het proces om een maximale hoeveelheid H2 uit LAH te verkrijgen verloopt in 3 stappen:
De theoretische waterstofopbrengst bedraagt 5,3% voor reactie 1. Voor zowel reactie 2 als 3 wordt 2,6% gevonden. voor reactie 2 en 2,6 voor reactie 3.[33] Er zijn echter nog een aantal problemen. Om werkelijk een optimale capaciteit te garanderen, moet het intermediair LiH gedehydrogeneerd worden tijdens de laatste reactie. Deze verbinding is thermodynamisch gezien zeer stabiel en de reactie vergt dan ook temperaturen boven 400 °C. Daardoor moet het proces gestopt worden na reactie 2. Dit verlaagt de capaciteit tot 7,96% waterstofgas. Een ander probleem is het recycleren van het ontlede LAH: hiervoor moet waterstof onder een zeer hoge druk van 10.000 bar gebracht worden, omdat LAH een relatief onstabiele verbinding is.[34] Dit zou gespecialiseerde apparatuur vergen, wat de kostprijs dan weer in de hoogte jaagt.
Vergelijkbare verbindingen[bewerken | brontekst bewerken]
Er bestaan een aantal analoge (stabielere en minder stabiele) verbindingen, die behoren tot de tetrahydroaluminaten: dit zijn anionen van aluminium, dat een extra hydride heeft gebonden via een coördinatief covalente binding. Ze dragen de brutoformule AlH4−. Zo kan het stabiele natriumaluminiumhydride bereid worden uit LAH, uitgaande van natriumhydride in THF:
Het analoog kaliumaluminiumhydride kan bereid worden uit kaliumhydride in diglyme:[35]
Magnesiumaluminiumhydride (ook wel magnesiumalanaat genoemd) kan eveneens bereid worden uit LAH, met magnesiumbromide als reagens:[36]
Zie ook[bewerken | brontekst bewerken]
Externe links[bewerken | brontekst bewerken]
- (en) MSDS van lithiumaluminiumhydride
- (en) Bereiding van lithiumaluminiumhydride
- (en) Gegevens van lithiumaluminiumhydride in de GESTIS-stoffendatabank van het IFA
Bronnen, noten en/of referenties
Literatuur
|
| Dit artikel is op 1 november 2010 in deze versie opgenomen in de etalage. |

















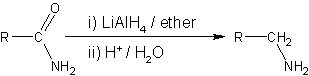



![{\displaystyle {\ce {LiAlH4 + NH3 -> Li[Al(NH2)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c59abaebf9eb0cd2ce760e412614ebd2efe2a797)




