Tetrafluoretheen
| Tetrafluoretheen | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
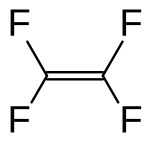
| |||||
Structuurformule van tetrafluoretheen
| |||||

| |||||
Molecuulmodel van tetrafluoretheen
| |||||
| Algemeen | |||||
| Molecuulformule | C2F4 | ||||
| IUPAC-naam | 1,1,2,2-tetrafluoroetheen | ||||
| Andere namen | perfluoretheen, perfluorethyleen, TFE | ||||
| Molmassa | 100,015013 g/mol | ||||
| SMILES | C(=C(F)F)(F)F
| ||||
| InChI | 1S/C2F4/c3-1(4)2(5)6
| ||||
| CAS-nummer | 116-14-3 | ||||
| EG-nummer | 204-126-9 | ||||
| PubChem | 8301 | ||||
| Wikidata | Q412460 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H220 - H280 - H350i - H371 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P210 - P410+P403 - P260 - P281 | ||||
| VN-nummer | 1081 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | gasvormig | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,00451 g/cm³ | ||||
| Smeltpunt | −142,5 °C | ||||
| Kookpunt | −75,6 °C | ||||
| Dampdruk | (bij 20°C) 2.950.000 Pa | ||||
| Oplosbaarheid in water | 0,179 g/L | ||||
| Slecht oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Tetrafluoretheen of tetrafluorethyleen is een zeer licht ontvlambare organische verbinding met als brutoformule C2F4. De stof komt voor als een kleurloos gas met een zoete geur, dat slecht oplosbaar is in water.
Het is het meest eenvoudige fluoralkeen. Zoals alle andere onverzadigde fluorkoolstoffen is het zeer vatbaar voor nucleofiele aanvallen.
Synthese[bewerken | brontekst bewerken]
Tetrafluoretheen wordt bereid vanuit chloroform, dat via waterstoffluoride gefluoreerd wordt tot chloordifluormethaan. Hieruit wordt via pyrolyse tetrafluoretheen en zoutzuur verkregen:[1]
Toepassingen[bewerken | brontekst bewerken]
De meest gebruikte en bekende toepassing van tetrafluoretheen is als het polymeer polytetrafluoretheen (PTFE) of teflon. Deze verbinding werd in 1938 toevallig ontdekt door de Amerikaanse scheikundige Roy Plunkett. Teflon is een plastic met de laagste wrijvingscoëfficiënt en wordt in die context gebruikt als anti-aanbaklaag in kookpannen, zoals de Tefal-pannen. Teflon is bovendien bijzonder weinig reactief en wordt daarom gebruikt in allerlei toepassingen voor opslag en transport van reactieve chemicaliën.
Een ander polymeerproduct van tetrafluoretheen is Fluon of ETFE, een afkorting voor ethyleen-tetrafluorethyleen-copolymeer. Dit is een copolymeer van etheen en tetrafluoretheen. ETFE is een thermoplastisch polymeer met goede tot zeer goede thermische, mechanische, elektrische en chemische eigenschappen. Het wordt onder andere gebruikt als isolatie van elektrische draden en kabels in veeleisende omgevingen zoals de lucht- en ruimtevaart en als bekledingsmateriaal van opslagtanks.
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Tetrafluoretheen is een zwak alkyleringsreagens en er wordt vermoed dat het een carcinogene stof is. Het is door het IARC ingedeeld in klasse 2B, wat betekent dat de stof carcinogeen voor de mens zou kunnen zijn. In de Europese stoffen database van het ECHA is aangegeven dat de stof door meerdere bedrijven als carcinogeen wordt beschouwd. Dit zou blijken uit dierproeven (CARC 1B). De stof is daarmee op basis van zogeheten zelfclassificatie door bedrijven een zogeheten zeer zorgwekkende stof (ZZS) volgens het Nederlandse prioritair stoffenbeleid. Tetrafluoretheen wordt het best gehanteerd in vacuüm omgeving en in een oplossing met een inert gas, omdat de stof snel explosief kan ontbinden tot zuiver koolstof en tetrafluormethaan. Bovendien kan het, wanneer het in contact met lucht komt, zeer snel exotherm polymeriseren.
Door adiabatische compressie kan tetrafluoretheen ook exploderen. Industriële recipiënten worden daarom eerst gevuld met distikstof onder hoge druk.
Zie ook[bewerken | brontekst bewerken]
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|





