Selenol
Een selenol is het seleenanaloog van een alcohol en een thiol. De functionele groep is eenvoudigweg opgebouwd uit seleen en waterstof, waarbij aan het seleenatoom nog een alkyl- of arylgroep is gekoppeld. Selenolen worden in de vakliteratuur soms ook aangeduid met de termen selenomercaptaan of selenothiol. Ze vormen een belangrijke groep van organoseleenverbindingen.
Synthese[bewerken | brontekst bewerken]
Selenolen worden meestal bereid door reactie van het overeenkomstig organolithiumreagens of Grignard-reagens met elementair seleen. Een voorbeeld is de synthese van benzeenselenol door de reactie van fenylmagnesiumbromide met seleen in di-ethylether, gevolgd door afwerking met verdund waterstofbromide:[1]
Structuur en eigenschappen[bewerken | brontekst bewerken]
Een selenol is structureel verwant met een thiol, maar door de grotere atoomstraal van seleen is de bindingslengte tussen koolstof en seleen zo'n 8% langer: 196 pm. Een consequentie hiervan is dat de binding zwakker is en dus makkelijker geoxideerd wordt.[2] Bovendien staat een selenol zeer gemakkelijk een proton (H+) af; ze zijn zo'n 1000 keer zuurder dan de overeenkomstige thiolen. Zo bedraagt de pKa van methaanselenol (CH3SeH) 5,2. Ter vergelijking: die van het methaanthiol (CH3SH) bedraagt 8,3 en die van methanol (CH3OH) bedraagt 15,5. Methaanselenol is daarmee net iets minder zuur dan zuiver azijnzuur.
De bindingshoek C-Se-H bedraagt 90° en is dus - in tegenstelling tot alcoholen en thiolen - sterk gebogen. De bindingshoek is vergelijkbaar met die in waterstofselenide. Dit is te wijten aan de zeer hoge bijdrage van het p-orbitaal van seleen aan de binding.
Het kookpunt van selenolen is iets hoger dan dat van thiolen, wat te wijten is aan een grotere bijdrage van de intermoleculaire krachten. De vluchtige selenolen hebben een zeer indringende en onaangename geur.
Reacties[bewerken | brontekst bewerken]
Selenolen vormen, zoals thiolen, ook gemakkelijk metaalzouten: selenolaten. Wanneer een zwaar metaal (bijvoorbeeld lood) als tegenion wordt gebruikt, dan zijn deze zouten veel makkelijker en veiliger te bewaren dan de selenolen op zich. Natrium- en kaliumselenolaten kunnen gevormd worden door verhitten van het overeenkomstig selenol met metallisch natrium of kalium in een organisch oplosmiddel als benzeen, tolueen of xyleen.
Selenolen worden door luchtzuurstof tot diseleniden geoxideerd, die gekenmerkt worden door een Se-Se-binding (vergelijkbaar met de zwavelbrug).
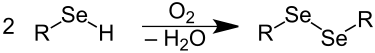
Daarnaast ondergaan ze ook een soort Williamson-ethersynthese, waarbij een organisch selenide (R-Se-R') wordt gevormd.

Voorkomen en toepassingen[bewerken | brontekst bewerken]
Selenolen kennen weinig commericieel interessante toepassingen, omdat ze zeer toxisch zijn en omdat de Se-H-binding zeer gevoelig is voor hydrolyse. De geconjugeerde basen kennen een aantal toepassingen in de organische synthese.
Enkele selenolen zijn echter belangrijke in een aantal biochemische processen. In zoogdieren zijn 3 enzymen aangetroffen waarin selenolen vervat zitten. De selenolen maken telkens deel uit van het aminozuur selenocysteïne.[2]
Bronnen, noten en/of referenties
|

