Primitiefstreep


arg. Kiemschijf.
pr. Primitiefstreep. gc. germinal crescent (kiemhalveboogvormige gebied)

De primitiefstreep is een zichtbare, morfologische lineaire band van cellen, op de achterste epiblast en oriënteert zich langs de voorste en achterste embryo-as. Geïnitieerd door signalen van de onderliggende hypoblast, is de vorming van de primitiefstreep gebaseerd op epiblastcelmigratie, met behulp van de nodalhomoloog, van de lateraal-posterieure gebieden van de epiblast naar de middelste middellijn.[1] De primitiefknoop bevindt zich aan het voorste uiteinde van de primitiefstreep en dient als organisator voor de gastrulatie, waarbij het lot van de epiblastcellen wordt bepaald door de differentiatie van migrerende epiblastcellen tijdens gastrulatie te induceren. De primitiefstreep bepaalt de plaats van de gastrulatie.
Tijdens gastrulatie ondergaan migrerende epiblastcellen een epitheel-mesenchymale overgang om de cel-celadhesie (E-cadherine) te verliezen, loslaten van de epiblastlaag en migreren over het dorsale oppervlak van de epiblast en vervolgens naar beneden door de primitiefstreep. De eerste golf van epiblastcellen die via de primitiefstreep binnendringt, dringt de hypoblast binnen en verdringt deze om het embryonale endoderm te worden. De mesodermlaag wordt vervolgens gevormd terwijl migrerende epiblastcellen door de primitiefstreep bewegen en zich vervolgens verspreiden in de ruimte tussen het endoderm en de resterende epiblast, die, zodra de mesodermlaag zich heeft gevormd, uiteindelijk het definitieve ectoderm wordt.
De primitiefstreep brengt tweezijdige symmetrie tot stand en bepaalt de plaats van de gastrulatie. Om de primitiefstreep te vormen, worden mesenchymstamcellen gerangschikt langs de toekomstige middellijn, waardoor de tweede embryonale as wordt gevormd, en de plaats waar cellen zullen binnendringen en migreren tijdens het proces van gastrulatie en kiemlaagvorming.[2]
De primitiefstreep strekt zich uit door deze middellijn en creëert de links-rechtse en craniale-caudale (kop-staart) lichaamsassen.[3][4] waar ze zullen differentiëren in het mesoderm[2] die, samen met endoderm- en ectoderm, aanleiding geven tot alle weefsels van het volwassen organisme.
Reptielen vertonen bimodale gastrulatie tijdens de embryogenese en missen een primitiefstreep. Bimodale gastrulatie wordt gekenmerkt door involutie van de cellen in de voorste en laterale gebieden van de blastopore en het binnendringen van de cellen van de blastopore-plaat in het achterste gebied. Analogieën tussen de blastopore-plaat en de primitiefstreep suggereren dat de blastopore-plaat een voorloper was van de primitiefstreep van zoogdieren en vogels.[5]
Structuur[bewerken | brontekst bewerken]

De epiblast is de bron van alle embryonale weefsels in het smallere caudale (posterieure) gebied van het ontwikkelende embryo aan de dorsale (rug) zijde.[6] Bij de eerste vorming, strekt de primitiefstreep zich uit over de helft van de lengte van het embryo. Het menselijk embryo is bij de vorming van de primiefstreek ongeveer 17 dagen oud gerekend vanaf de bevruchting.[7] De primitiefstreep wordt langer door migratie van cellen en vernauwing en vormt de primitiefgroef met de blastopore. Richting het craniale (voorste) uiteinde van de kiemschijf breidt de primitiefstreep zich uit naar een gebied dat bekend staat als de primitiefknoop en dat de organisator is voor de gastrulatie.[8] Bij vogels wordt primitiefknoop de knoop van Hensen genoemd. In amfibieën, waar het voor het eerst werd geïdentificeerd, staat het bekend als de Spemann-Mangold organisator.



In het midden van de knoop bevindt zich een cirkelvormige verdieping die de primitiefpit wordt genoemd. De primitiefpit strekt zich uit naar het caudale (staart) uiteinde in een smalle verdieping in de primitiefstreep, de primitiefgroef[8] (Sulcus primitivus). De groef wordt gevormd door het invouwen van epiblastische cellen.[10][11]
Na het verschijnen en vormen van de knoop, de pit en de groef begint de streep zich uit te breiden richting het staart einde. Rond dag 20 van het menselijk embryo worden de resterende delen van de streep groter en produceren een middellijn caudale celmassa die de staartknop of caudale eminentie wordt genoemd.[8] Bij zoogdieren is de staartknop het klompje van ongedifferentieerde cellen aan het caudale uiteinde van de wervelkolom. Ook op dat moment ontwikkelt de chorda dorsalis zich craniaal (hoofdzijde) van de primitieve knoop. Op dag 22 gerekend vanaf de bevruchting is de primitiefstreep achteruitgegaan tot tussen de 10 en 20% van de lengte van het embryo, en op dag 26 is deze schijnbaar verdwenen.[8]




Vorming[bewerken | brontekst bewerken]
Het kippenembryo als modelorganisme heeft veel informatie opgeleverd over de vorming van de primitiefstreep. De vorming begint met het afvlakken van de kiemschijf. De vorming van de blastula omvat de gecoördineerde beweging en herschikking van cellen in de epiblast.[12] Twee tegengesteld ronddraaiende celstromen ontmoeten elkaar aan het posterior uiteinde, waar de streep ontstaat.[12] Er is weinig beweging in het midden van deze stromingen, terwijl de grootste beweging wordt waargenomen aan de rand van de wervelingen.[13] De wervelingen van de cellen, die kunnen worden vergeleken met een poolse polonaise, zijn de sleutel voor de vorming van de primitieve streep.[14]
Cellen die over de sikkel van Koller liggen in het posterior uiteinde van het kippenembryo bewegen naar de middellijn, ontmoeten die en veranderen van richting naar het midden van de epiblast. Cellen uit de laterale posterior marginale zone vervangen de cellen die de sikkel van Koller verlieten door elkaar te ontmoeten in het midden van dit gebied, van richting te veranderen en naar voren uit te breiden.[4][15] Terwijl deze cellen bewegen en zich concentreren aan het posterior uiteinde van het embryo, ondergaat de streep een overgang van een enkele naar meerlaagse epitheellaag, waardoor het een macroscopisch zichtbare structuur wordt.[4] Verschillende mechanismen, waaronder actieve celproliferatie, georiënteerde celdeling, cel-cel-intercalatie en chemotactische celbeweging, zijn voorgesteld om de aard van de cellulaire bewegingen te verklaren die nodig zijn om de primitiefstreep te vormen.[16][4]
De marginale zone van een kippenembryo bevat cellen die zullen bijdragen aan de primitiefstreep.[4] Tussen de area opaca (ondoorzichtig gebied) en de sikkel van Koller bevindt zich een gordelachtig gebied dat de achterste marginale zone (PMZ=posterior marginal zone) wordt genoemd. De PMZ organiseert de knoop van Hensen of primitiefknoop in Amniota. De marginale zone heeft een gedefinieerde anterior-naar-posterior gradiënt in zijn vermogen voor het induceren van de primitiefstreep, waarbij het posterior uiteinde het hoogste potentieel heeft.[17] Alle cellen in de epiblast kunnen reageren op signalen uit de marginale zone,[2] maar zodra een bepaalde regio door deze signalen wordt geïnduceerd en primitiefstreepvorming ondergaat, reageren de resterende cellen in de epiblast niet langer op deze inductieve signalen en voorkomen ze de vorming van een nieuwe primitiefstreep.[17]
Onder de epiblast ligt de hypoblast, waar het extra-embryonale weefsel zijn oorsprong vindt.[4] Bij de kippen resulteert de afwezigheid van de hypoblast in meerdere primitiefstrepen,[18] wat suggereert dat de aanwezigheid ervan belangrijk is voor het reguleren van de vorming van een enkele primitiefstreep. De hypoblast speelt ook een belangrijke rol bij de regulatie van primitiefstreepvorming. Verwijdering van de hypoblast in het embryo resulteert in ectopische primitiefstrepen met het juiste patroon, wat erop wijst dat de hypoblast dient om de vorming van de primitiefstreep te remmen.[19] Een ectopische expressie is een abnormale genexpressie in een celtype, weefseltype of ontwikkelingsstadium waarin het gen gewoonlijk niet tot expressie komt.
Primitiefgroef[bewerken | brontekst bewerken]
De primitiefgroef vormt zich als een verdieping in de primitiefstreep terwijl deze zich ontwikkelt, en biedt ruimte voor migrerende cellen om naar de diepere lagen van het embryo te gaan. Cellen migreren door via de dorsale zijde naar binnen te gaan en naar de ventrale zijde van het vogelembryo te bewegen, waarbij de linker- en rechtersecties van het embryo worden gescheiden. De primitiefpit in de knoop van Hensen, aan het voorste uiteinde van de primitiefstreep, maakt het mogelijk dat cellen binnendringen die de notochord en prechordale plaat zullen vormen. Cellen die door het midden van de streep bewegen, vormen het hart en de nieren. De laterale plaat en het extra-embryonale mesoderm komen voort uit de cellen die aan het achterste uiteinde van de primitiefstreep binnenkomen. Epiblastcellen nabij de primitieve streep vormen de neurale plaat en andere dorsale structuren, terwijl de epiblastcellen ver van de streep de epidermis vormen.[20]
Signaalreactiepaden[bewerken | brontekst bewerken]
De vorming van de primitiefstreep bij het vogelembryo wordt in hoge mate gereguleerd door een complex netwerk van signaal-reactiepaden. Activering van verschillende gesynthetiseerde eiwitten (Vg1, Nodal, Wnt8C, FGF8 en Chordin) en transcriptiefactoren (T-box transcription factor T en Homeobox protein goosecoid) grenzend aan de plaats van de primitiefstreepvorming zijn vereist voor dit proces.[21][22][23][24][19]
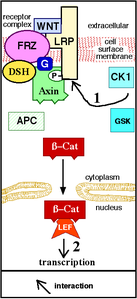
Vg1- en Wnt-signalering[bewerken | brontekst bewerken]
Op dezelfde manier kunnen verkeerde expressie en tussenvoeging van Vg1 van/in de achterste marginale zone[17] bij het vogelembryo ook ectopische primitiefstrepen veroorzaken, maar alleen binnen de marginale zone van het embryo,[23] wat een specifiek kenmerk van deze regio aangeeft in zijn vermogen om primitiefstreepvorming te induceren. Verschillende onderzoeken wijzen erop dat Wnt-expressie de bepalende factor is voor dit vermogen. Deletie van Wnt3 in muizenembryo's resulteert in de afwezigheid van een primitiefstreep, vergelijkbaar met het fenotype van β-catenine mutante embryo's.[25] Bovendien vormt de gemuteerde intracellulaire negatieve regulator van Wnt-signalering, Axin,[26] en een verkeerde expressie van het vogelembryo cWnt8C[27] meerdere primitiefstrepen in muizenembryo's. Lokalisatie van Wnt en componenten van zijn reactiepad, Lef1 en β-catenine, ondersteunt de primitiefstreep-inducerende rol in de marginale zone verder. [23] Bovendien is het uitgedrukt als een gradiënt die afneemt van posterior naar anterior,[23][24] overeenkomend met het primitiefstreep-inducerende vermogen van de marginale zone. Een verkeerde expressie van Vg1 of Wnt1 alleen kon geen ectopische primitiefstreep bij het vogelembryo veroorzaken, maar samen resulteerde hun verkeerde expressie in de vorming van een ectopische primitiefstreep, wat bevestigt dat het vermogen tot primitiefstreep-inducerende werking van de achterste marginale zone kon worden toegeschreven aan Wnt-signalering[23] en dat Vg1 en Wnt moeten samenwerken om dit proces op gang te brengen. Verkeerde expressie van Vg1 samen met de Wnt-antagonisten, Crescent of Dkk-1, voorkomt de vorming van ectopische primitiefstrepen, wat het belang aantoont van Wnt-activiteit bij de vorming van door Vg1 geïnduceerde ectopische primitiefstrepen en vandaar de implicatie ervan bij de normale vorming van primitiefstrepen. Een ectopische expressie is een abnormale genexpressie in een celtype, weefseltype of ontwikkelingsstadium waarin het gen gewoonlijk niet tot expressie komt.
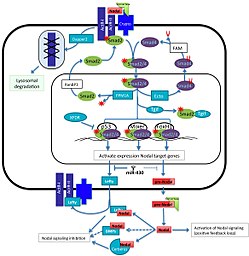
Nodalsignalering[bewerken | brontekst bewerken]
Nodal, een bekende mesodermale inductor van de transforming growth factor beta family (TGFB family),[19] is betrokken bij de primitiefstreepvorming. Muizen-embryo's met de Nodal-mutant vormen geen gastrula en missen het meeste mesoderm,[28] maar Nodal speelt niet alleen een rol bij de inductie van het mesoderm, maar reguleert ook de inductie en/of het behoud van de primitiefstreep.[28] In de aanwezigheid van de hypoblast is Nodal niet in staat om ectopische primitiefstrepen in het kippenembryo te veroorzaken, terwijl de verwijdering ervan de expressie van Nodal, Chordin en T-box transcription factor T induceert, [19] wat suggereert dat de hypoblast een bepaalde remmende werking moet hebben op Nodale signalering. De multifunctionele antagonist van Nodal-, Wnt- en BMP-signalering, Cerberus (geproduceerd in de hypoblast) en Cerberus-Short (die alleen Nodal remt), remt door zijn effect op Nodal-signalering de vorming van primitiefstrepen.[19] Uiteindelijk wordt de hypoblast naar voren verplaatst, waardoor primitiefstreepvorming aan het achterste uiteinde mogelijk wordt. Aan het voorste uiteinde remt de aanwezigheid van de hypoblast en de antagonisten die deze uitscheidt, zoals Cerberus, de expressie van Nodal en beperkt daardoor de vorming van primitiefstrepen tot alleen het achterste uiteinde.[19] Vergelijkbaar met de hypoblast in het kippenembryo scheidt de AVE in de muis twee antagonisten van Nodale signalering af, Cerberus-achtig, Cerl en Lefty1.[19][29] In muis, Cer-/-; Lefty1-/- dubbele mutanten ontwikkelen meerdere primtiefstrepen[18] zoals aangegeven door de ectopische expressie van Brachyury en kunnen gedeeltelijk worden gered door de verwijdering van één kopie van het Nodal-gen.[18] In de muis beperkt de AVE primitiefstreepvorming via de redundante functies van Cer1 en Lefty1, die de Nodale signalering negatief reguleren.[18] De rol van de AVE bij de muis bij het verzekeren van de vorming van een enkele primitiefstreep is evolutionair geconserveerd in de hypoblast van het kippenembryo.[18][19]
FGF-signalering[bewerken | brontekst bewerken]
Een andere belangrijk reactiepad bij het moduleren van de vorming van de primitiefstreep is FGF, waarvan wordt gedacht dat het samenwerkt met Nodal voor de regulatie van dit proces.[30] Remming van FGF-signalering door expressie van een dominante negatieve receptor, met behulp van een FGF-receptorremmer (SU5402) of uitputting van FGF-liganden, remt mesodermvorming[13] en dit remt op zijn beurt de vorming van primitiefstrepen.[4] Bovendien vereiste de vorming van ectopische primitiefstrepen, veroorzaakt door Vg1, FGF-signalering.[30]
BMP-signalering[bewerken | brontekst bewerken]
Ten slotte is BMP-signalering ook belangrijk voor het reguleren van het proces van primitiefstreepvorming in het kippenembryo. De plaats van de primitiefstreepvorming wordt gekenmerkt door lage BMP-signalen, terwijl de rest van de epiblast hoge niveaus van BMP-activering vertoont.[31] Bovendien voorkomt de foutieve expressie van BMP4 of BMP7 de vorming van primitiefstrepen, terwijl de BMP-remmer Chordin de vorming van ectopische primitiefstrepen bij het kippenembryo induceert,[32] wat suggereert dat primitiefstreepvorming waarschijnlijk remming van BMP vereist.
Ethische implicaties[bewerken | brontekst bewerken]
De primitiefstreep is een belangrijk concept in de bio-ethiek, waar sommige deskundigen hebben betoogd dat experimenten met menselijke embryo's toegestaan zijn, maar alleen voordat de primitiefstreep zich ontwikkelt, meestal rond de veertiende dag van het bestaan van het embryo. De ontwikkeling van de primitiefstreep wordt door dergelijke bio-ethici opgevat als de creatie van een uniek menselijk wezen.[33] In sommige landen is het illegaal om een menselijk embryo langer dan 14 dagen buiten het lichaam van een vrouw te laten groeien.[34]
Afbeeldingen[bewerken | brontekst bewerken]
-
Vorming primitiefstreep bij een kippenembryo
-
Migratie van epiblastcellen in het zoogdierembryo
-
Dorsale doorsneden (a – e) en mediane sagittale doorsneden (g en h)T: trofoblast (grijs), Y: dooierzakepitheel (geeloranje), E: epiblast (rood, omkaderd in de bovenste laag), H: hypoblast (omkaderd in de onderste laag), MZ: marginale zone (beige), CZ: centrale zone (lichtblauw), AMC (=PMZ): voorste marginale zone (lichtgroen), ASD: voorste primitiefstreepdomein (donkerblauw), rode stippellijn: grens tussen voorste gastrulaplaat (AGP) en achterste gastrula-extensie (PGE), EN: primitiefknoop (geel), PS: primitiefstreep (paars), pijlen: uitzetting van CZ, stokfiguur bovenop PS in f, rechterfiguur: bijdrage van PS aan lichaamsdelen van volwassenen. Schaalbalk: ongeveer 500 μm
-
Celbewegingen tijdens de vorming van de primiefstreep bij een vogelembryo
-
Wnt-signaalreactiepaden
-
Nodal-signaal reactiepaden.
-
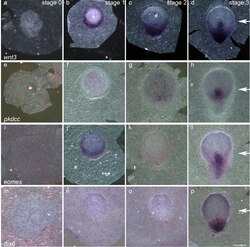
Expressie van wnt3 (a–d), pkdcc (e–h), eomes (i–l) en tbx6 (m–p). Witte pijlen markeren het uiteinde van de primitiefstreep.
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|