Tetrahydrocannabinol
| Neem het voorbehoud bij medische informatie in acht. Raadpleeg bij gezondheidsklachten een arts. |
| Tetrahydrocannabinol | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
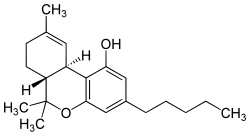
| ||||
Structuurformule van Δ9-tetrahydrocannabinol
| ||||

| ||||
3D weergave van THC
| ||||
| Algemeen | ||||
| Molecuulformule | C21H30O2 | |||
| IUPAC-naam | (6aR,10aR)-6,6,9-trimethyl-3-pentyl-6a,7,8,10a-tetrahydrobenzo[c]chromen-1-ol | |||
| Andere namen | tetrahydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-ol, THC | |||
| Molmassa | 314,4617 g/mol | |||
| SMILES | CCCCCC1=CC2=C([C@@H]3C=C(CC[C@H]3C(O2)(C)C)C)C(=C1)O
| |||
| InChI | 1/C21H30O2/c1-5-6-7-8-15-12-18(22)20-16-11-14(2)9-10-17(16)21(3,4)23-19(20)13-15/h11-13,16-17,22H,5-10H2,1-4H3/t16-,17-/m1/s1
| |||
| CAS-nummer | 1972-08-3 | |||
| PubChem | 16078 | |||
| Wikidata | Q190067 | |||
| LD50 (ratten) | (oraal) 1270 mg/kg | |||
| LD50 (muizen) | (peroraal) 482 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kookpunt | 157 °C | |||
| Oplosbaarheid in water | 2,8 g/L | |||
| Slecht oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKa = 10,6 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tetrahydrocannabinol of THC is de belangrijkste psychoactieve stof in cannabis.
Geschiedenis[bewerken | brontekst bewerken]
THC werd in 1964 voor het eerst geïsoleerd door Raphael Mechoulam en Yechiel Gaoni van het Weizmann Instituut in Rehovot (Israël).[1][2] In cannabis zijn daarnaast meer dan 113 andere cannabinoïden geïdentificeerd,[3] de rol en het belang van veel van deze verbindingen is nog niet of nauwelijks opgehelderd.
Toxicologische (en medicinale) eigenschappen van Δ9-THC zijn vooral onderzocht bij muizen en ratten, vanwege hun relatief korte levensduur en gemakkelijke behandelbaarheid. De uitkomsten van onderzoeken zijn vaak redelijk op zichzelf staand en spreken elkaar soms zelfs ronduit tegen. Vooralsnog is er nog geen allesomvattende theorie over de werking van THC op onder andere de hersenen, die alle bevindingen weet te verklaren. De controle op THC als stof wordt over de gehele wereld steeds minder, gezien er steeds meer bekend wordt over de medicinale eigenschappen. Het gebruik van wiet en hasj wordt al jaren gedoogd en kon In Nederland als eerste land als niet-geregistreerd gebruik op doktersrecept worden verkregen (medicinale wiet, of mediwiet). Synthetische THC (dronabinol) wordt verkocht als palliatief medicijn in pilvorm onder de naam Marinol.
Werking[bewerken | brontekst bewerken]
De effecten worden opgewekt doordat THC de werking van de neurotransmitter anandamide nabootst. Zo hecht THC zich aan een receptor, die bekendstaat als de cannabinoïdereceptor. Omdat cannabinoïden van nature niet voorkomen in het menselijk lichaam, begon de zoektocht naar de endogene stof van deze receptor (de stof die zich normaal gesproken bindt aan de receptor), hetgeen heeft geleid tot de ontdekking van anandamide, een endocannabinoïde en onderdeel van het endocannabinoïde-systeem. Deze stof is tevens een klein bestanddeel van cacao en dus chocolade. Onderzoek naar de verspreiding van receptoren in de hersenen verklaart waarom de kans op toxificatie ten gevolge van het gebruik van THC zo laag is (of waarom de LD50 van de stof zo groot is): gedeelten van de hersenen, die vitale functies zoals cellulaire ademhaling controleren, hebben niet zo veel receptoren, dus het effect is hier zeer gering, zelfs bij doses groter dan wat onder normale omstandigheden kan worden ingenomen.
Structuur en reactiviteit[bewerken | brontekst bewerken]
Δ9-THC bindt aan de cannabinoïdreceptor en bootst daarmee de werking na van anandamide. Δ9-THC heeft vooralsnog geen bekende chemische reactiviteit en kan daardoor celprocessen alleen ontregelen op receptorniveau.
Synthese[bewerken | brontekst bewerken]
Er zijn verschillende isomeren van het cannabinoïd THC. Type A en Type B komen van nature voor in de hars van Cannabis sativa, Cannabis indica en Cannabis ruderalis, de drie hennepsoorten die bruikbaar zijn voor de productie van marihuana. Type C komt van nature niet voor en kan alleen synthetisch bereid worden. De synthese van THC type C wordt veel uitgevoerd, omdat THC type C een 500 keer sterkere werking heeft dan THC types A en B. Er zijn twee methoden om THC te synthetiseren:
Methode 1[bewerken | brontekst bewerken]
- De basis van THC ligt hier in 1,3,5-trichloorbenzeen. In het oplosmiddel bis(2-methoxyethyl)ether (diglyme) wordt door methanolyse 1-chloor-3,5-dimethoxybenzeen gevormd.
- Het gevormde 1-chloor-3,5-dimethoxybenzeen reageert met Mg2+ tot een Grignard-reagens. Hierna vindt een Grignard-reactie plaats in het oplosmiddel tetrahydrofuraan. Het product dat daarbij ontstaat, wordt daarna gehydrolyseerd door toevoeging van zwavelzuur. Hierbij wordt een aminegroep omgezet in een ketongroep en ontstaat 3,5-dimethoxyfenyl-(n-butyl)-keton.
- Dit product wordt gereduceerd, waarbij de ketongroep via een alcoholgroep naar een waterstofatoom wordt omgezet.
- Het ontstane product, 3,5-trimethoxy-fenyl-(alkyl), wordt gedemethyleerd.[4] Hierbij worden 2 alcoholgroepen gevormd, en ontstaat er 5-(alkyl)-resorcinol.
- 5-(alkyl)-resorcinol wordt gecondenseerd en omgezet in de verschillende isomeren van tetrahydrocannabinol (THC).
Methode 2[bewerken | brontekst bewerken]
- De basis van THC ligt hier in 3,4,5-trihydroxybenzoëzuur. Deze wordt gemethyleerd met dimethylsulfaat. Hiertoe worden eerst de OH-groepen aan de aromatische ring gedeprotoneerd door NaOH, waarna de methylgroepen van het dimethylsulfaat een binding aangaan met de oxide-ionen aan de aromatische ring.
- Het ontstane 3,4,5-trimethoxybenzoëzuur zal reageren met fosforpentachloride, waarbij 3,4,5-trimethoxy-benzoylchloride wordt gevormd.
- Vervolgens wordt dit met behulp van ammoniumhydroxide en petroleumether omgezet tot 3,4,5-trimethoxy-benzamide. Het ammoniumatoom is nucleofiel, en valt aan op het elektrofiele koolstofatoom. Het chloride zal door een herschikking van de elektronen loslaten.
- 3,4,5-trimethoxy-benzamide ondergaat een Grignard-reactie met magnesium-1-broombutaan. Hierbij ontstaat 3,4,5-dimethoxy-fenyl-(n-butyl)-keton.
- Dit product ondergaat een directe reductie, waarbij het keton via een alcoholgroep gereduceerd wordt tot een waterstofatoom.
- Het nu ontstane 3,5-trimethoxy-(fenyl)-alkyl ondergaat demethylering, waarbij de methylgroep van de methylether aan de aromatische ring wordt omgezet in een alcohol. Ook wordt de methoxygroep verwijderd, waardoor 5-(alkyl)-resorcinol ontstaat.
- Dit ondergaat condensatie om uiteindelijk tot THC te worden omgezet.
Werkingsmechanisme[bewerken | brontekst bewerken]
THC komt het lichaam meestal binnen via de luchtwegen, waardoor het snel geabsorbeerd wordt en de hersenen snel bereikt. THC werkt, samen met de endogene neurotransmitter anandamide, in op de cannabinoïdereceptoren in de hersenen. Deze receptoren bevinden zich in de basale ganglia, de hippocampus, het cerebellum en in lage concentraties in de hersenstam. Uit wetenschappelijke studies is gebleken dat THC een grote affiniteit heeft voor de cannabinoïde receptoren in de basale ganglia en het cerebellum, en een middelmatige affiniteit voor de receptoren in de hippocampus en de hersenstam. De cannabinoïde receptoren in de hersenen zijn de zogenaamde CB1-receptoren, G-eiwit-gekoppelde receptoren, gevestigd op axonuiteinden in het centraal zenuwstelsel. Wanneer THC aan deze receptoren bindt, worden ze geactiveerd, waardoor de IP3 pathway op gang gebracht wordt. Hierdoor wordt de intracellulaire afgifte van calcium verhoogd. Het calciumpotentiaal wordt hierdoor minder, en dus wordt de influx van calcium door de voltage afhankelijke calciumkanalen in zenuwcellen geremd. Er kan minder prikkelgeleiding plaatsvinden, waardoor de afgifte van een aantal neurotransmitters, waaronder gamma-aminoboterzuur (GABA), in het centraal zenuwstelsel zal afnemen.
Metabolisme[bewerken | brontekst bewerken]
Het cannabinoïde THC is erg lipofiel, en daarmee een goed substraat voor cytochroom-P-450-enzymen, via welke route het metabolisme dan ook geschiedt. THC wordt opgeslagen in vetweefsel van de organen en heeft daardoor een hoge halveringstijd. Omdat het zich opslaat in vetweefsel, zullen infrequente gebruikers met een hoog metabolisme hun lichaam eerder vrijmaken van THC dan frequente gebruikers met een laag metabolisme. Er zijn zo'n 100 metabolieten van THC bekend. De eerste stap in het metabolisme van THC is de hydroxylatie op de C-11-positie door cytochroom P-450 2C9. Na deze hyroxylatiestap treedt een oxidatie op, waarbij Δ9-THC-11-oic acid ontstaat, het THC-metaboliet dat het meest wordt geëxcerneerd, geconjugeerd met glucuronzuur. Naast deze, meest voorkomende, manier van metaboliseren, kan er nog een tal van andere metabolische transformaties optreden, waarbij hydroxyzuren, dihydroxyzuren, diols en triols ontstaan. In de fase I-metabolieten worden epoxiden en reducties van de dubbele binding aangetroffen. In fase II-metabolieten tref je conjugaten met glucuronzuur, langeketenvetzuren en glucose aan. De 11-hydroxymetabolieten van Δ9-tetrahydrocannabinol zijn even actief, en soms actiever dan het THC zelf.
Excretie[bewerken | brontekst bewerken]
THC en zijn metabolieten worden voor een groot deel uitgescheiden in de urine, voornamelijk als Δ9 -THC-11-oic acid. Tevens geschiedt een groot deel van de THC-excretie via de feces. De halveringstijd van THC is gemeten aan de hand van de urine-excretie en bedraagt 24,9 – 35,3 uur. Overigens geschiedt de excretie van THC ook via de moedermelk. Hoewel er geen schadelijke effecten in embryo’s zijn aangetoond, wordt het toch afgeraden THC te gebruiken tijdens de zwangerschap.
Therapeutische effecten[bewerken | brontekst bewerken]
| Dronabinol | ||||
|---|---|---|---|---|
| Gebruik | ||||
| Indicaties | Anorexia bij aidspatiënten, nausea en braken bij chemotherapie | |||
| Voorschrift/recept | Niet van toepassing | |||
| Databanken | ||||
| ATC-code | A04AD10 | |||
| DrugBank | APRD00571 | |||
| ||||
In vier onderzoeken is uitgewezen dat Δ9-THC een nuttig medicijn kan zijn bij multiple sclerose. Er is gekeken naar: zenuwpijn, chronische pijn met MS als oorzaak, algemene symptomen van MS en naar de pijn die veroorzaakt wordt door de plexus brachialis. Uit alle vier de onderzoeken blijkt dat er een significante vermindering is van de symptomen. Patiënten die een mix kregen van THC en cannabidol, bleken veel minder last te hebben van pijn en spasme.
Het wordt in sommige landen voorgeschreven onder de naam Dronabinol, de INN- of USP (United States Pharmacopeia)-benaming (en de DAC-aanduiding, Duits Arznei Codex) voor Δ9-THC in een zuiverheid van minimaal 95%. Het wordt gebruikt als symptoombestrijding bij onder andere misselijkheid en braken.
Patiënten die chemotherapie ondergaan kunnen effectief THC gebruiken, zowel oraal als door roken, om minder misselijk te zijn en om minder over te hoeven geven. Uit onderzoek blijkt dat THC lichtelijk beter werkt dan andere middelen tegen overgeven en misselijkheid. Patiënten bleken voor cannabinoïden te kiezen als steun tijdens toekomstige chemotherapieën. Hiv-patiënten verliezen vaak veel gewicht ten gevolge van anorexie. Een bijwerking van THC is dat het een eetlust opwekt, ook wel bekend als de vreetkick. Door deze vreetkick kan de anorexie tenietgedaan worden. Hetzelfde geldt voor de anorexie/cachexie ten gevolge van kanker. Verder kan het symptomen verlichten bij slaap- en angststoornissen, waaronder posttraumatische stress-stoornissen. Ook blijkt het gebruik van THC de oogdruk te verminderen.
In België en Nederland is het niet als geneesmiddel geregistreerd. Wel wordt in Nederland op experimentele basis THC, in de vorm van cannabis, voorgeschreven aan patiënten met MS. Cannabis die door de apotheek wordt verstrekt, wordt wel 'mediwiet' (medicinale wiet) genoemd.
Toxiciteit in planten[bewerken | brontekst bewerken]
THC wordt door de cannabisplant aangemaakt als bescherming tegen herbivoren. Tevens heeft THC een hoge UV-B absorptie, waarvan gedacht wordt dat dit de plant beschermt tegen UV-straling.
Toxiciteit en effecten in dieren[bewerken | brontekst bewerken]
Anandamide, de neurotransmitter waarvan THC de agonist is, kan in weinig tot geen gevallen ontwenningsverschijnselen en fysieke afhankelijkheid veroorzaken in ratten. Zowel bij kort- als bij langdurige blootstelling aan THC, laten ratten een reversibele afname zien in de functie van het werkgeheugen. Tevens is in ratten aangetoond dat THC voor de terugval zorgt van cocaïnegebruik en het zelfgebruik van methamfetamine. Ook blijken jonge ratten eerder heroïne te gebruiken, wanneer ze onder stress gezet worden na behandeling met THC ten opzichte van jonge ratten onder stress die niet met THC behandeld zijn.
Uit onderzoek blijkt dat toediening van THC in ratten een antioxiderende werking heeft, en het neurodegeneratief proces in de ziekte van Alzheimer remt. In muizen remt THC de groei van bepaalde typen tumoren (Lewis long adenocarcinoma en Friend leukemia virus-induced splenomegaly), waardoor de levensduur van de muizen verlengd wordt. Op een andere vorm van leukemie (L1210 murine) bleek THC echter geen positief effect te hebben.
Andere gunstige effecten van lage concentraties THC blijken een vermindering in aderverkalking in muizen en een lager gemiddeld gewicht in muizen en ratten ten opzichte van controlegroepen.
Bij zowel de muizen als de ratten werd hyperactiviteit geconstateerd, vlak na de orale inname van THC. De frequentie van hyperactieve uitbarsting hangt samen met de dosis.
Toxiciteit en effecten bij mensen[bewerken | brontekst bewerken]
Dagelijks cannabisgebruik kan bij mensen op de lange termijn leiden tot tijdelijke schade aan het brein, wat zou resulteren in onder andere geheugenverlies en een verminderde leercapaciteit. Deze gevolgen zijn echter tijdelijk en verdwijnen een week na het laatste gebruik. Beschreven langetermijneffecten van THC zijn onder andere het uitlokken van psychoses als manie en zelfs schizofrenie. De cannaboïdreceptor wordt niet in elk deel van de hersenen evenveel tot expressie gebracht: De hoogste concentraties bevinden zich in de basale ganglia, het cerebellum en de hippocampus. Deze laatste is een cruciaal onderdeel van het langetermijngeheugen. Een verminderde geheugencapaciteit als gevolg van (langdurige) blootstelling aan Δ9-THC lijkt dan ook een logisch effect te zijn.[bron?] Een chemisch toxicologisch effect van Δ9-THC is vooralsnog niet aangetoond: THC lijkt op anandamide. De effecten van THC worden dan ook vooral veroorzaakt door de binding van THC aan de cannabinoïdreceptor.
Risico's[bewerken | brontekst bewerken]
Andere studies tonen een variëteit aan negatieve effecten aan bij langdurig gebruik, onder andere geheugenverlies, depressiviteit en verlies aan motivatie. De vermeende langetermijneffecten van THC-gebruik zijn momenteel[(sinds) wanneer?] de inzet van een nieuwe discussie over cannabis-gebruik in Nederland. Door het in de loop der jaren sterk verhoogde THC-gehalte in nederwiet was er rond 2005 enige discussie om het op de lijst van harddrugs op te nemen. Anno 2011 wordt deze discussie hervat voor nederwiet met een THC-gehalte van meer dan 15 procent.[5]
Cannabisgebruik en schizofrenie[bewerken | brontekst bewerken]
Mensen die lijden aan schizofrenie gebruiken vaak middelen als alcohol, tabak en cannabis als een vorm van zelfmedicatie. Het gebruik van cannabis zou bijvoorbeeld (althans bij een aantal patiënten) een tekort aan dopamine in de frontale hersenen kunnen compenseren. Onderzoekers zien een antipsychotisch effect bij schizofrene gebruikers van wiet met een laag THC gehalte en een hoog cannabidiol gehalte.[6]
Epidemiologische studies (zie literatuur) laten echter zien dat cannabisgebruik onder jongeren ook beschouwd kan worden als een onafhankelijke risicofactor voor latere ontwikkeling van schizofrenie. Een meta-analyse van een groot aantal studies door Moore e.a. in het gezaghebbende Engelse tijdschrift The Lancet stelt dat het risico op een psychose globaal 40% hoger ligt bij cannabisgebruikers, waarbij het risico toeneemt bij hogere doseringen. Mogelijk versterkt een langdurig en frequent gebruik van cannabis een reeds aanwezige genetische aanleg voor deze ziekte.
Volgens Jellinek is cannabisgebruik verantwoordelijk voor een toename van 6 tot 10% van schizofrenie.[7] In Nederland verdubbelde in de periode 1990-1998 het aantal mannen met schizofrenie.[8] De correlatie van schizofrenie bij eeneiige tweelingen is circa 40%, hetgeen een sterk genetisch bepaalde causaliteit aangeeft.[9]
Standaard[bewerken | brontekst bewerken]
Tot dusver bestaan er nog geen standaardeenheden voor cannabis, die mensen bewust zouden kunnen maken van de concentraties THC in het product. Een invoering daarvan zou de behandelingen en resultaten in verband met de geestelijke gezondheid van gebruikers kunnen helpen verbeteren. Standaardeenheden zoals die al vele jaren gemeengoed zijn voor alcohol zijn nog nooit overgenomen in gezondheidsrichtlijnen voor cannabis.
Onderzoekers suggereren dat er meer moet worden gedaan om gebruikers bewust te maken van de dosis THC als belangrijkste psychoactieve component. THC-concentraties in cannabis zouden afgelopen decennium in Europa zijn verdubbeld. In landen waar cannabis legaal wordt verkocht, zoals Canada, zou het aantal standaardeenheden dat een product bevat gemakkelijk kunnen worden vermeld op de bestaande labels op productverpakkingen. Invoering van een dergelijk systeem zou ook positieve gevolgen kunnen hebben in landen waar cannabis illegaal is.
Een internationaal overeen te komen systeem zou een praktische richtlijn kunnen opleveren voor consumenten en artsen. Indien de gezondheidseffecten van cannabis dosisafhankelijk zijn, kunnen risico's worden omgebogen. De invoering van een eenheidssysteem zou zowel gebruikers als zorgverleners helpen, door daarmee duidelijkere informatie te verstrekken over de soorten cannabisproducten die ze consumeren en hun sterkte, en zo een kader te ontwikkelen teneinde mensen te helpen cannabis veiliger te gebruiken. Het huidige gebrek aan informatie verhoogt het risico op schade voor de consument. Een verbetering hierin zou mogelijke gezondheidsrisico's zoals verslaving of psychose kunnen minimaliseren.[10]
Bronnen, noten en/of referenties
|
