Valproïnezuur
| Neem het voorbehoud bij medische informatie in acht. Raadpleeg bij gezondheidsklachten een arts. |
| Valproïnezuur | ||||
|---|---|---|---|---|
| Chemische structuur | ||||
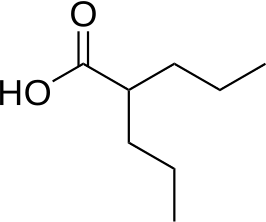
| ||||
| Gebruik | ||||
| Geneesmiddelengroep | Anti-epileptica | |||
| Merknamen | Depakine; merkloos | |||
| Databanken | ||||
| CAS-nummer | 99-66-1 | |||
| ATC-code | N03AG01 | |||
| PubChem | 3121 | |||
| DrugBank | DB00313 | |||
| Chemische gegevens | ||||
| Molecuulformule | C8H16O2 | |||
| IUPAC-naam | 2-propylpentaanzuur | |||
| Molmassa | 144,21 g/mol | |||
| Dichtheid | 0,904 g/cm³ | |||
| ||||
Valproïnezuur (2-propylpentaanzuur) of natriumvalproaat is een niet-natuurlijk voorkomend vertakt vetzuur. Valproïnezuur en zijn zout (valproaat) - worden in de geneeskunde gebruikt als een anti-epilepticum. Het middel kwam in 1968 op de markt onder de merknaam Depakine. Omdat van dit geneesmiddel het patent verlopen is, zijn er ook merkloze geneesmiddelen met dezelfde werkzame stof op de markt.
De stof is opgenomen in de lijst van essentiële geneesmiddelen van de WHO.
Geschiedenis[bewerken | brontekst bewerken]
De eerste synthese van valproïnezuur vond plaats in 1882, toen Beverly Burton het synthetiseerde als een analogon van valeriaanzuur, dat van nature in valeriaan voorkomt. Decennialang werd het zuur uitsluitend in laboratoria als 'metabolisch inert' oplosmiddel voor in water onoplosbare organische verbindingen ingezet. Bij het onderzoek naar de anticonvulsieve werking van verschillende in valproïnezuur opgeloste khellininederivaten ontdekte de Franse onderzoeker Pierre Eymard in 1962 bij toeval dat niet de opgeloste stoffen, maar het oplosmiddel verantwoordelijk was voor het farmacologisch effect van valproïnezuur. In 1967 werd het in Frankrijk goedgekeurd als anti-epilepticum. Inmiddels is valproïnezuur uitgegroeid tot het wereldwijd meest voorgeschreven anti-epilepticum.
Synthese[bewerken | brontekst bewerken]
Uitgangsmaterialen voor de synthese van valproïnezuur zijn ethylcyaanacetaat en twee equivalenten 1-broompropaan. Deze reageren met de toevoeging van natriumethanolaat, over een enolaat, naar α,α-dipropylcyanoazijnzuurester. In een basisch milieu ontstaat na estersplitsing en decarboxylering dipropylacetonitril. Dit kan door hydrolyse in valproïnezuur omgezet worden.

Als alternatief kan valproïnezuur worden geproduceerd door een malonzuurestersynthese. Daartoe wordt malonaat met twee equivalenten 1-broompropaan omgezet en de resulterende gedisubstitueerde esters verzeept en gedecarboxyleerd.
Werkingsmechanisme[bewerken | brontekst bewerken]
Valproïnezuur werkt op verschillende manieren in het menselijk organisme. Een belangrijk werkingsmechanisme omvat verhoogde neurotransmissie of beschikbaarheid van GABA.
- Van valproaat wordt aangenomen dat de activiteit van de inhiberende neurotransmitter GABA (gamma-aminoboterzuur) in de menselijke hersenen verhoogt, door het remmen van GABA transaminase dat GABA afbreekt en activatie van de synthese van GABA. Daardoor kan het een alternatief zijn voor lithiumzouten als stemmingsstabilisator.
Toch zijn in de afgelopen jaren verschillende andere werkingsmechanismen voor valproïnezuur geopperd:
- Voor zijn anti-epileptisch effect is onder meer de blokkade van prikkelende ionkanalen (spanningsafhankelijke natriumkanalen en calciumkanalen) verantwoordelijk.
- Valproïnezuur is een remmer van het enzym histondeacetylase 1 (HDAC1), waardoor het tot de groep histondeacetylaseremmers behoort. HDI's hebben een lange geschiedenis van gebruik in de psychiatrie en neurologie als stemmingsstabilisatoren en anti-epileptica. Meer recent worden ze onderzocht als mogelijke behandelingen voor kanker en ontstekingsziekten.
- Valproïnezuur fungeert epigenetisch, dat wil zeggen, het grijpt via acetyleringen in het epigenetische systeem in. Dientengevolge wordt de activiteit van individuele cellen en genen beïnvloed.
Valproïnezuur wordt goed geabsorbeerd door het lichaam en kan oraal en intraveneus worden toegediend. De halveringstijd is tussen 12 en 16 uur. Bij gelijktijdige toediening van andere anti-epileptica, zoals fenytoïne of carbamazepine kan de halveringstijd omlaag gaan naar circa vier tot negen uur.
Toepassingen[bewerken | brontekst bewerken]
- Het is een middel van eerste keus bij de behandeling van partiële epilepsie, de idiopathische vorm van gegeneraliseerde epilepsie, myoklonieën en bij absences. Empirische waarneming: na instelling van de patiënt door de arts leidt valproïnezuur bij ongeveer zes op de tien patiënten tot langdurig aanvalsvrij zijn.
- Voor de behandeling van manische perioden bij bipolaire stoornis.
- Aangezien valproïnezuur een stemming- en impulsstabiliserend effect heeft, zou het ook van nut kunnen zijn bij refractaire depressie evenals ter vermijding van agressieve impulsen.
- Aanvullende behandeling bij schizofrene psychosen, met name schizoaffectieve stoornissen.
- Ter vermijding van terugval bij ontwenning van alcohol- en drugsgebruik.
- Als migraineprofylaxe (dit is niet-geregistreerd gebruik).
- Bij de preventieve behandeling van clusterhoofdpijn (dit is eveneens niet-geregistreerd gebruik).[1]
- Bij Syndroom van Phelan-McDermid.
Toedieningsvormen[bewerken | brontekst bewerken]
Valproïnezuur is beschikbaar in verschillende toedieningsvormen. De toevoeging chrono duidt op gereguleerde afgifte: de werkzame stof komt langzamer en zeer regelmatig vrij uit het tablet. Bij een gewoon tablet is de concentratie van de stof in het bloed het hoogst 1 tot 6 uur na inname, bij chrono tabletten is dat pas na 6 tot 10 uur. De toevoegingen enteric en MSR zijn gegeven aan maagsapresistente tabletten, dat zijn tabletten die een coating hebben die pas in de darm oplost. Hierdoor is de werkzame stof beschermd tegen de zure maaginhoud.
Interacties[bewerken | brontekst bewerken]
Als enzymremmer vertraagt valproïnezuur de afbraak van bepaalde stoffen, zodat een aanpassing van de dosering kan nodig zijn. Dit is onder meer het geval bij het anti-epilepticum primidon, zijn metaboliet fenobarbital en lamotrigine. Omgekeerd kunnen fenobarbital, fenytoïne, primidon en carbamazepine door hun enzyminducerend effect de werking en uitscheiding van valproïnezuur versnellen. Valproïnezuur kan eveneens de albuminebinding van fenytoïne verminderen. Bij combinatietherapie met acetylsalicylzuur of anticoagulantia is er een verhoogd bloedingsrisico. Alcoholgebruik tijdens de behandeling heeft een potentieel verhoogd hepatotoxisch effect en wordt daarom (in de bijsluiter) afgeraden.
Valproïnezuur remt de mitochondriale bèta-oxidatie van vetzuren (zowel langketenige als middellange keten).
Verder kan valproïnezuur een reactie aangaan met carnitine-acyltransferases. Deze reactie kan leiden tot een carnitinedeficiëntie en in potentie aanleiding geven tot verschijnselen die lijken op het Syndroom van Reye via blokkade van de productie van ketolichamen, welke fungeren als een alternatieve energiebron voor de hersenen, vooral in een toestand van hypoglykemie. Ook het gebruik van andere anti-epileptica, zoals carbamazepine, fenobarbital en fenytoïne kan gepaard gaan met verlaagde carnitineconcentraties. Het meten van de carnitineniveaus, evenals het monitoren op tekenen van carnitinedeficiëntie, kan op zijn plaats zijn bij risicopatiënten. Met name bij combinatietherapie met andere anti-epileptica, ketogeen dieet of bij verminderde energieinname door ziekte. Er zijn aanwijzingen dat therapie met L-carnitine de negatieve gevolgen van overdosering met valproïnezuur kan tegengaan.[2][3]
Bijwerkingen[bewerken | brontekst bewerken]
Voordelig in de behandeling is dat valproïnezuur niet sederend werkt en vaak ook aanslaat bij niet herkende idiopathische gegeneraliseerde epilepsie.
Naast enkele ongevaarlijke en tijdelijke bijwerkingen kan de behandeling met valproïnezuur tot onaanvaardbare bijwerkingen leiden, die het noodzakelijk maken de behandeling te staken:
De meest voorkomende bijwerkingen zijn slaperigheid, tremor, voedingsproblemen (lage of overmatige eetlust), diarree, overmatige speekselvorming en tijdelijke haaruitval.
Af en toe treden gehoorverlies, hoofdpijn, vermindering van spierspanning / hypotonie, onvaste gang, overmatige activiteit, stupor, oedeem en verwarring op.
Zelden ontwikkelt zich een chronische ziekte van de hersenen met storingen van cognitieve prestaties (encefalopathie). Dit laatste fenomeen is vooral bij langdurige therapie waargenomen en gaat dan vaak gepaard met meer epileptische aanvallen en ernstige systemische veranderingen in het EEG.
Bij vrouwen kan gebruik van valproïnezuur leiden tot polycysteus-ovariumsyndroom. Vooral aan het begin van de behandeling kan buikpijn, misselijkheid, braken en vermoeidheid optreden.
Vaak is er een verandering in het bloedbeeld, bijvoorbeeld een vermindering van bloedplaatjes (trombocytopenie) en enzymremming. Valproïnezuur kan ook invloed hebben op de bloedstolling, wat kan leiden tot een verhoogde bloedingsneiging. In zeldzamer gevallen, is er een nierfunctiestoornis in de vorm van het syndroom van Fanconi, schade aan de lever (soms met dodelijke afloop), of pancreas (ook met een aantal dodelijke afloop / met name in aanwezigheid van een stofwisselingsziekte en bij combinatietherapie met andere geneesmiddelen).
Zwangerschap[bewerken | brontekst bewerken]
Bij vrouwen die valproïnezuur gebruiken tijdens de zwangerschap komen vaker misvormingen bij het kind voor, waaronder een open ruggetje. Ook cognitieve ontwikkelingsstoornissen en autisme komen vaker voor bij deze groep. Valproïnezuur kan bij proefdieren symptomen veroorzaken die sterk lijken op autisme.[4]
Naast de misvormingen zijn er ook aanwijzingen voor een dosisafhankelijke cognitieve vermindering bij de nakomelingen door gebruik van valproïnezuur tijdens de zwangerschap. Kinderen van wie de moeder tijdens de zwangerschap met valproïnezuur is behandeld, blijken een lager verbaal intelligentiequotiënt te hebben dan de nakomelingen die niet prenataal in aanraking met dit medicijn zijn gekomen.[5] In de basisschoolleeftijd treden problemen op in met name de verbale vaardigheden en het geheugen.
Er moet echter van worden uitgegaan dat een epileptische aanval tijdens de zwangerschap gevaarlijk zijn voor zowel moeder als kind. Hoe zich te gedragen tijdens een geplande of bestaande zwangerschap en of de medicijnen moeten worden veranderd, kan het beste worden bepaald bij een medisch consult. Bij inname van valproïnezuur tijdens de zwangerschap kan eventueel een gespecialiseerde prenatale controle worden uitgevoerd om mogelijke neuralebuisdefecten en andere symptomen van misvorming te kunnen herkennen.
Ook is uit onderzoek naar voren gekomen dat er mogelijk een verhoogd risico is op ontwikkelingsstoornissen bij kinderen, als de vaders in de drie maanden vóór de bevruchting valproaat gebruikten.[6]
Uit dierexperimenteel onderzoek komen aanwijzingen dat Panax ginseng en spirulina de teratogene effecten van valproïnezuur kunnen verminderen.[7][8]
Bij zuigelingen kan valproïnezuur alleen in uitzonderingsgevallen worden toegepast, bijvoorbeeld wanneer andere anti-epileptica echt niet kunnen worden gebruikt.
Waarschuwing na registratie[bewerken | brontekst bewerken]
Op basis van nieuwe onderzoekgegevens adviseerde het CBG op 10 december 2014 in Nederland valproïnezuur en afgeleide verbindingen niet toe te passen bij zwangere vrouwen, om de foetus te beschermen. Alleen bij totale therapieresistentie kan nog worden teruggegrepen naar dit middel.[9]
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|
