Epitheel-mesenchymale overgang: verschil tussen versies
kGeen bewerkingssamenvatting |
|||
| Regel 13: | Regel 13: | ||
== Inductoren == |
== Inductoren == |
||
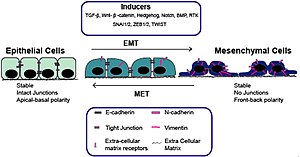
[[Bestand:Epithelial to Mesenchymal Transition Comparison Chart.png|thumb|left|Belangrijke [[Inductor (biologie)|inductoren]] van de epitheel-mesenchymale overgang. Marker=[[genetische merker]]. Transcription Factor=[[transcriptiefacor]]. Signaling Pathway=[[Signaaltransductie|signaalroute]]]] |
[[Bestand:Epithelial to Mesenchymal Transition Comparison Chart.png|thumb|left|Belangrijke [[Inductor (biologie)|inductoren]] van de epitheel-mesenchymale overgang. Marker=[[genetische merker]]. Transcription Factor=[[transcriptiefacor]]. Signaling Pathway=[[Signaaltransductie|signaalroute]]]] |
||
Het verlies van E-cadherine wordt beschouwd als een fundamentele gebeurtenis bij EMT. Veel [[transcriptiefactor]]en (TF's) die E-cadherine direct of indirect kunnen onderdrukken, kunnen worden beschouwd als EMT-TF (EMT-inducerende TF's). SNAI1/Snail 1, SNAI2/Snail 2 (ook bekend als [[Slug (eiwit)|Slug]]), ZEB1, ZEB2, TCF3 en KLF8 (Kruppel-achtige factor 8) kunnen binden aan de E-cadherine-promotor en de [[transcriptie]] ervan onderdrukken, terwijl factoren zoals Twist, Goosecoid TCF4 (ook bekend als E2.2), homeobox-eiwit SIX1 en FOXC2 (vork-head box-eiwit C2) onderdrukken indirect E-cadherine. SNAIL- en ZEB-factoren binden aan E-box-consensussequenties op het [[Promotor (genetica)|promotor]]gebied, terwijl KLF8 via GT-boxen aan de promotor bindt. Deze EMT-TF's onderdrukken niet alleen E-cadherine direct, maar onderdrukken ook transcriptioneel andere verbindingseiwitten, waaronder [[Claudine (eiwit)|claudinen]] en [[Desmosoom|desmosomen]], waardoor EMT wordt vergemakkelijkt. Aan de andere kant worden [[transcriptiefactor]]en zoals grainyhead-achtige proteïne 2-homoloog (GRHL2) en ETS-gerelateerde transcriptiefactoren ELF3 en ELF5 [[Up- en downregulatie|gedownreguleerd]] tijdens EMT en blijken ze actief MET te stimuleren wanneer ze tot overexpressie worden gebracht in mesenchymcellen. Sinds EMT bij de progressie van kanker EMT herovert in ontwikkelingsprogramma's, zijn veel van de EMT-TF's betrokken bij het bevorderen van metastatische gebeurtenissen. |
Het verlies van E-cadherine wordt beschouwd als een fundamentele gebeurtenis bij EMT. Veel [[transcriptiefactor]]en (TF's) die E-cadherine direct of indirect kunnen onderdrukken, kunnen worden beschouwd als EMT-TF (EMT-inducerende TF's). SNAI1/Snail 1, SNAI2/Snail 2 (ook bekend als [[Slug (eiwit)|Slug]]), ZEB1, ZEB2, TCF3 en KLF8 (Kruppel-achtige factor 8) kunnen binden aan de E-cadherine-promotor en de [[transcriptie]] ervan onderdrukken, terwijl factoren zoals Twist, Goosecoid TCF4 (ook bekend als E2.2), homeobox-eiwit SIX1 en FOXC2 (vork-head box-eiwit C2) onderdrukken indirect E-cadherine.<ref>{{cite journal |author=Peinado H, Olmeda D, Cano A | title = Snail, Zeb and bHLH factors in tumour progression: an alliance against the epithelial phenotype? | journal = Nature Reviews Cancer | volume = 7 | issue = 6| pages = 415–428 | year = 2007 | doi=10.1038/nrc2131 | pmid=17508028| hdl = 10261/81769 | s2cid = 25162191 }}</ref><ref>{{cite journal |author=Yang J, Weinberg RA | title = Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis | journal = Dev Cell | volume = 14 | pages = 818–829 | year = 2008 | doi=10.1016/j.devcel.2008.05.009 | pmid=18539112 | issue=6| doi-access = free }}</ref> SNAIL- en ZEB-factoren binden aan E-box-consensussequenties op het [[Promotor (genetica)|promotor]]gebied, terwijl KLF8 via GT-boxen aan de promotor bindt. Deze EMT-TF's onderdrukken niet alleen E-cadherine direct, maar onderdrukken ook transcriptioneel andere verbindingseiwitten, waaronder [[Claudine (eiwit)|claudinen]] en [[Desmosoom|desmosomen]], waardoor EMT wordt vergemakkelijkt. Aan de andere kant worden [[transcriptiefactor]]en zoals grainyhead-achtige proteïne 2-homoloog (GRHL2) en ETS-gerelateerde transcriptiefactoren ELF3 en ELF5 [[Up- en downregulatie|gedownreguleerd]] tijdens EMT en blijken ze actief MET te stimuleren wanneer ze tot overexpressie worden gebracht in mesenchymcellen..<ref>{{cite journal |author=De Craene B, Berx G | title = Regulatory networks defining EMT during cancer initiation and progression | journal = Nature Reviews Cancer | volume = 13 | issue = 2 | pages = 97–110 | year = 2013 | doi= 10.1038/nrc3447| pmid = 23344542 | s2cid = 13619676 }}</ref><ref>{{cite journal |author=Chakrabarti R, Hwang J, Andres Blanco M, Wei Y, Lukačišin M, Romano RA, Smalley K, Liu S, Yang Q, Ibrahim T, Mercatali L, Amadori D, Haffty BG, Sinha S, Kang Y | title = Elf5 inhibits the epithelial-mesenchymal transition in mammary gland development and breast cancer metastasis by transcriptionally repressing Snail2 | journal = Nat Cell Biol | volume = 14 | issue=11 | pages = 1212–1222 | year = 2012 | doi= 10.1038/ncb2607 | pmid = 23086238 | pmc= 3500637 }}</ref> Sinds EMT bij de progressie van kanker EMT herovert in ontwikkelingsprogramma's, zijn veel van de EMT-TF's betrokken bij het bevorderen van metastatische gebeurtenissen.<ref name="ncbi.nlm.nih.gov">{{cite journal |author=Nouri M, Ratther E, Stylianou N, Nelson CC, Hollier BG, Williams ED | year = 2014| title = Androgen-targeted therapy-induced epithelial mesenchymal plasticity and neuroendocrine transdifferentiation in prostate cancer: an opportunity for intervention | journal = Front Oncol| volume = 4| pages = 370| pmid = 25566507 | doi=10.3389/fonc.2014.00370 | pmc=4274903| doi-access = free}}</ref><ref>{{cite journal | author = Puisieux A, Brabletz T, Caramel J | title = Oncogenic roles of EMT-inducing transcription factors | journal = Nature Cell Biology | volume = 16 | issue = 6 | pages = 488–94 | date = June 2014 | pmid = 24875735 | doi = 10.1038/ncb2976 | s2cid = 5226347 }}</ref> |
||
Verschillende signaalroutes ([[TGF-β]], FGF, EGF, HGF, [[Wnt-signalering|Wnt]]/[[CTNNB1|beta-catenine]] en [[Notch eiwit|Notch]]) en [[Hypoxie (medisch)|hypoxie]] kunnen EMT veroorzaken. In het bijzonder is aangetoond dat Ras-MAPK Snail en Slug activeert. Slug activeert de stappen van [[Desmosoom|desmosomale]] loslaten, celverspreiding en gedeeltelijke scheiding aan de cel-celgrenzen, die de eerste en noodzakelijke fase van het EMT-proces vormen. Aan de andere kant kan Slug de tweede fase niet activeren, die de inductie van celbeweeglijkheid, onderdrukking van de [[cytokeratine]]-expressie en activering van vimentine-expressie omvat. Het is bekend dat Snail en Slug de expressie van p63-isovormen reguleren, een andere transcriptiefactor die nodig is voor een goede ontwikkeling van epitheelstructuren. De veranderde expressie van [[p63 (eiwit)|p63]]-isovormen verminderde de [[cel-celadhesie]] en verhoogde de migratie-eigenschappen van kankercellen. De p63-factor is betrokken bij het remmen van EMT en de reductie van bepaalde p63-isovormen kan belangrijk zijn bij de ontwikkeling van epitheelkankers. Van sommigen van hen is bekend dat ze de expressie van cytokeratines reguleren. |
Verschillende signaalroutes ([[TGF-β]], FGF, EGF, HGF, [[Wnt-signalering|Wnt]]/[[CTNNB1|beta-catenine]] en [[Notch eiwit|Notch]]) en [[Hypoxie (medisch)|hypoxie]] kunnen EMT veroorzaken.<ref name="The basics of epithelial-mesenchyma"/><ref>{{cite journal | author = Zhang L, Huang G, Li X, Zhang Y, Jiang Y, Shen J, Liu J, Wang Q, Zhu J, Feng X, Dong J, Qian C | display-authors = 6 | title = Hypoxia induces epithelial-mesenchymal transition via activation of SNAI1 by hypoxia-inducible factor -1α in hepatocellular carcinoma | journal = BMC Cancer | volume = 13 | pages = 108 | date = March 2013 | pmid = 23496980 | pmc = 3614870 | doi = 10.1186/1471-2407-13-108 | doi-access = free }}</ref><ref>{{Cite web|url=https://www.genetex.com/Research/Overview/cancer/Epithelial-Mesenchymal_Transition|title=Epithelial-Mesenchymal Transition {{!}} GeneTex|website=www.genetex.com|access-date=2019-10-28}}</ref> In het bijzonder is aangetoond dat Ras-MAPK Snail en Slug activeert.<ref>{{cite journal | author = Horiguchi K, Shirakihara T, Nakano A, Imamura T, Miyazono K, Saitoh M | title = Role of Ras signaling in the induction of snail by transforming growth factor-beta | journal = The Journal of Biological Chemistry | volume = 284 | issue = 1 | pages = 245–53 | date = January 2009 | pmid = 19010789 | doi = 10.1074/jbc.m804777200 | doi-access = free }}</ref><ref>{{cite journal | author = Ciruna B, Rossant J | title = FGF signaling regulates mesoderm cell fate specification and morphogenetic movement at the primitive streak | journal = Developmental Cell | volume = 1 | issue = 1 | pages = 37–49 | date = July 2001 | pmid = 11703922 | doi = 10.1016/s1534-5807(01)00017-x | doi-access = free }}</ref><ref>{{cite journal | author = Lu Z, Ghosh S, Wang Z, Hunter T | title = Downregulation of caveolin-1 function by EGF leads to the loss of E-cadherin, increased transcriptional activity of beta-catenin, and enhanced tumor cell invasion | journal = Cancer Cell | volume = 4 | issue = 6 | pages = 499–515 | date = December 2003 | pmid = 14706341 | doi = 10.1016/s1535-6108(03)00304-0 | doi-access = free }}</ref> Slug activeert de stappen van [[Desmosoom|desmosomale]] loslaten, celverspreiding en gedeeltelijke scheiding aan de cel-celgrenzen, die de eerste en noodzakelijke fase van het EMT-proces vormen. Aan de andere kant kan Slug de tweede fase niet activeren,<ref>{{cite journal | author = Savagner P, Yamada KM, Thiery JP | title = The zinc-finger protein slug causes desmosome dissociation, an initial and necessary step for growth factor-induced epithelial-mesenchymal transition | journal = The Journal of Cell Biology | volume = 137 | issue = 6 | pages = 1403–19 | date = June 1997 | pmid = 9182671 | pmc = 2132541 | doi = 10.1083/jcb.137.6.1403 }}</ref> which includes the induction of cell motility, repression of the [[cytokeratin]] expression, and activation of [[vimentin]] expression.<ref>{{cite journal | author = Boyer B, Tucker GC, Vallés AM, Franke WW, Thiery JP | title = Rearrangements of desmosomal and cytoskeletal proteins during the transition from epithelial to fibroblastoid organization in cultured rat bladder carcinoma cells | journal = The Journal of Cell Biology | volume = 109 | issue = 4 Pt 1 | pages = 1495–509 | date = October 1989 | pmid = 2677020 | pmc = 2115780 | doi = 10.1083/jcb.109.4.1495 }}</ref> die de inductie van celbeweeglijkheid, onderdrukking van de [[cytokeratine]]-expressie en activering van vimentine-expressie omvat. Het is bekend dat Snail en Slug de expressie van p63-isovormen reguleren, een andere transcriptiefactor die nodig is voor een goede ontwikkeling van epitheelstructuren.<ref>{{cite journal | author = Herfs M, Hubert P, Suarez-Carmona M, Reschner A, Saussez S, Berx G, Savagner P, Boniver J, Delvenne P | display-authors = 6 | title = Regulation of p63 isoforms by snail and slug transcription factors in human squamous cell carcinoma | journal = The American Journal of Pathology | volume = 176 | issue = 4 | pages = 1941–9 | date = April 2010 | pmid = 20150431 | pmc = 2843482 | doi = 10.2353/ajpath.2010.090804 }}</ref> De veranderde expressie van [[p63 (eiwit)|p63]]-isovormen verminderde de [[cel-celadhesie]] en verhoogde de migratie-eigenschappen van kankercellen. De p63-factor is betrokken bij het remmen van EMT en de reductie van bepaalde p63-isovormen kan belangrijk zijn bij de ontwikkeling van epitheelkankers.<ref>{{cite journal | author = Lindsay J, McDade SS, Pickard A, McCloskey KD, McCance DJ | title = Role of DeltaNp63gamma in epithelial to mesenchymal transition | journal = The Journal of Biological Chemistry | volume = 286 | issue = 5 | pages = 3915–24 | date = February 2011 | pmid = 21127042 | pmc = 3030392 | doi = 10.1074/jbc.M110.162511 | doi-access = free }}</ref> Van sommigen van hen is bekend dat ze de expressie van cytokeratines reguleren.<ref>{{cite journal | author = Boldrup L, Coates PJ, Gu X, Nylander K | title = DeltaNp63 isoforms regulate CD44 and keratins 4, 6, 14 and 19 in squamous cell carcinoma of head and neck | journal = The Journal of Pathology | volume = 213 | issue = 4 | pages = 384–91 | date = December 2007 | pmid = 17935121 | doi = 10.1002/path.2237 | s2cid = 21891189 }}</ref> Er wordt ook gesuggereerd dat de fosfatidylinositol 3'-kinase (PI3K)/AKT-as, de Hedgehog-signaalroute, de celkernfactor [[NF-κB]] en de activerende [[HNF1B|transcriptiefactor 2]] betrokken zijn bij EMT.<ref>{{cite journal | author = Larue L, Bellacosa A | title = Epithelial-mesenchymal transition in development and cancer: role of phosphatidylinositol 3' kinase/AKT pathways | journal = Oncogene | volume = 24 | issue = 50 | pages = 7443–54 | date = November 2005 | pmid = 16288291 | doi = 10.1038/sj.onc.1209091 | s2cid = 22198937 | doi-access = }}</ref><ref>{{cite journal | author = Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V | title = The role of ATF-2 in oncogenesis | journal = BioEssays | volume = 30 | issue = 4 | pages = 314–27 | date = April 2008 | pmid = 18348191 | doi = 10.1002/bies.20734 | s2cid = 678541 }}</ref><ref>{{cite journal | author = Huber MA, Beug H, Wirth T | title = Epithelial-mesenchymal transition: NF-kappaB takes center stage | journal = Cell Cycle | volume = 3 | issue = 12 | pages = 1477–80 | date = December 2004 | pmid = 15539952 | doi = 10.4161/cc.3.12.1280 | doi-access = free }}</ref><ref>{{cite journal | author = Katoh Y, Katoh M | title = Hedgehog signaling, epithelial-to-mesenchymal transition and miRNA (review) | journal = International Journal of Molecular Medicine | volume = 22 | issue = 3 | pages = 271–5 | date = September 2008 | pmid = 18698484 }}</ref> |
||
Het Wnt-signaal[[Reactiepad (biochemie)|reactiepad]] reguleert EMT bij [[gastrulatie]], [[hartklep]]vorming en [[kanker]]. Activering van het Wnt-reactiepad in [[borstkanker]]cellen induceert de EMT-regulator Snail en [[Up- en downregulatie|upreguleert]] de mesenchym[[Genetische merker|merker]] [[vimentine]]. Ook correleert het actieve Wnt/bèta-catenine-reactiepad met een slechte prognose bij borstkankerpatiënten in de kliniek. Op dezelfde manier activeert TGF-β de expressie van Snail en ZEB om EMT bij de hartontwikkeling, [[palatogenese]] en kanker te reguleren. De bot[[metastase]] van borstkanker heeft de TGF-β-signalering geactiveerd, wat bijdraagt aan de vorming van deze |
Het Wnt-signaal[[Reactiepad (biochemie)|reactiepad]] reguleert EMT bij [[gastrulatie]], [[hartklep]]vorming en [[kanker]].<ref name = micalizzi>{{cite journal |author1=Micalizzi DS |author2=Farabaugh SM |author3=Ford HL | title = Epithelial-Mesenchymal Transition in Cancer: Parallels between Normal Development and Tumor Progression | journal=J Mammary Gland Biol Neoplasia | volume = 15 |issue=2 | pages = 117–134 | year = 2010 | doi = 10.1007/s10911-010-9178-9|pmid=20490631 |pmc=2886089 }}</ref> Activering van het Wnt-reactiepad in [[borstkanker]]cellen induceert de EMT-regulator Snail en [[Up- en downregulatie|upreguleert]] de mesenchym[[Genetische merker|merker]] [[vimentine]]. Ook correleert het actieve Wnt/bèta-catenine-reactiepad met een slechte prognose bij borstkankerpatiënten in de kliniek. Op dezelfde manier activeert TGF-β de expressie van Snail en ZEB om EMT bij de hartontwikkeling, [[palatogenese]] en kanker te reguleren. De bot[[metastase]] van borstkanker heeft de TGF-β-signalering geactiveerd, wat bijdraagt aan de vorming van deze ]]laesie]]s.<ref>{{cite journal |author=Kang Y, He W, Tulley S, Gupta GP, Serganova I, Chen CR, Manova-Todorova K, Blasberg R, Gerald WL, Massagué J | title = Breast cancer bone metastasis mediated by the Smad tumor suppressor pathway | journal= PNAS | volume = 102 | issue= 39| pages = 13909–14 | year = 2005| doi=10.1073/pnas.0506517102 | pmid=16172383 | pmc=1236573| bibcode = 2005PNAS..10213909K | doi-access = free }}</ref> Aan de andere kant onderdrukt p53, een bekende tumorsuppressor, EMT door de expressie van verschillende [[microRNA]]'s te activeren – miR-200 en miR-34 die de productie van de eiwitten ZEB en Snail remmen, en zo het epithele [[fenotype]] behouden.<ref>{{cite journal |author=Chang C, Chao C, Xia W, Yang J, Xiong Y, Li C, Yu W, Rehman SK, Hsu JL, Lee H, Liu M, Chen C, Yu D, Hung M | title = p53 regulates epithelial-mesenchymal transition (EMT) and stem cell properties through modulating miRNAs | journal= Nat Cell Biol | volume = 13 | issue= 3| pages = 317–323 | year = 2011 | doi=10.1038/ncb2173| pmid = 21336307 | pmc= 3075845 }}</ref> |
||
{{Clearboth}} |
{{Clearboth}} |
||
Versie van 15 mei 2024 12:20
| Mee bezig Aan dit artikel of deze sectie wordt de komende uren of dagen nog druk gewerkt.
Klik op geschiedenis voor de laatste ontwikkelingen. |
De epitheel-mesenchymale overgang (EMT) is een proces waarbij epitheelcellen hun celpolariteit en cel-celadhesie verliezen, en migrerende en invasieve eigenschappen krijgen om mesenchymatische stamcellen te worden; dit zijn multipotente stromacellen die kunnen differentiëren in verschillende celtypen. EMT is essentieel voor tal van ontwikkelingsprocessen, waaronder de vorming van mesoderm en de vorming van de neurale buis. Er is ook aangetoond dat EMT optreedt bij wondgenezing, bij orgaanfibrose en bij het initiëren van metastasen bij de progressie van kanker.
Deze overgang vindt plaats door het verlies van cadherine, zonula occludens, zonula adhaerens en desmosomen op de celmembranen van epitheelcellen. De oppervlaktemoleculen ondergaan endocytose en het cytoskelet van de microtubuli verliest vorm, waardoor het mesenchym langs de extracellulaire matrix (ECM) kan migreren. De epitheel naar mesenchym overgang vindt plaats in embryonale cellen en vereist migratie door of over weefsel, en kan worden opgevolgd door een epitheel-mesenchymale overgang voor het vormen van secundaire epitheelweefsels. Embryologische mesenchymale cellen brengen proteïne S100-A4 (S100A4) tot expressie, ook bekend als het fibroblast-specifiek eiwit, wat indicatief is voor hun gedeelde eigenschappen met de migrerende volwassen fibroblasten, en c-Fos, een oncogen geassocieerd met de downregulering van het epithele cadherine.
De epitheel-mesenchymale overgang werd voor het eerst herkend als een kenmerk van embryogenese door Betty Hay in de jaren tachtig.[1][2] EMT en het omgekeerde proces ervan, MET (van mesenchym-epithelale overgang) zijn van cruciaal belang voor de ontwikkeling van veel weefsels en organen in het zich ontwikkelende embryo, en voor talrijke embryonale gebeurtenissen zoals gastrulatie, vorming van de neurale lijst, vorming van hartkleppen, ontwikkeling van het secundaire gehemelte en myogenese.[3] Mesenchymcellen daarentegen missen deze polarisatie, hebben een spoelvormige morfologie en interageren alleen met elkaar via centrale plaatsen.[4] Epitheelcellen brengen hoge niveaus van E-cadherine tot expressie, terwijl mesenchymcellen die van N-cadherine, fibronectine en vimentine tot expressie brengen. EMT brengt dus diepgaande morfologische en fenotypische veranderingen in een cel met zich mee.[5]
Op basis van de biologische context is EMT onderverdeeld in 3 typen:
- ontwikkelingsstoornissen (Type I),
- fibrose[6] en wondgenezing (Type II) en
- kanker (Type III).[7][8][9]
Inductoren

Het verlies van E-cadherine wordt beschouwd als een fundamentele gebeurtenis bij EMT. Veel transcriptiefactoren (TF's) die E-cadherine direct of indirect kunnen onderdrukken, kunnen worden beschouwd als EMT-TF (EMT-inducerende TF's). SNAI1/Snail 1, SNAI2/Snail 2 (ook bekend als Slug), ZEB1, ZEB2, TCF3 en KLF8 (Kruppel-achtige factor 8) kunnen binden aan de E-cadherine-promotor en de transcriptie ervan onderdrukken, terwijl factoren zoals Twist, Goosecoid TCF4 (ook bekend als E2.2), homeobox-eiwit SIX1 en FOXC2 (vork-head box-eiwit C2) onderdrukken indirect E-cadherine.[10][11] SNAIL- en ZEB-factoren binden aan E-box-consensussequenties op het promotorgebied, terwijl KLF8 via GT-boxen aan de promotor bindt. Deze EMT-TF's onderdrukken niet alleen E-cadherine direct, maar onderdrukken ook transcriptioneel andere verbindingseiwitten, waaronder claudinen en desmosomen, waardoor EMT wordt vergemakkelijkt. Aan de andere kant worden transcriptiefactoren zoals grainyhead-achtige proteïne 2-homoloog (GRHL2) en ETS-gerelateerde transcriptiefactoren ELF3 en ELF5 gedownreguleerd tijdens EMT en blijken ze actief MET te stimuleren wanneer ze tot overexpressie worden gebracht in mesenchymcellen..[12][13] Sinds EMT bij de progressie van kanker EMT herovert in ontwikkelingsprogramma's, zijn veel van de EMT-TF's betrokken bij het bevorderen van metastatische gebeurtenissen.[14][15]
Verschillende signaalroutes (TGF-β, FGF, EGF, HGF, Wnt/beta-catenine en Notch) en hypoxie kunnen EMT veroorzaken.[7][16][17] In het bijzonder is aangetoond dat Ras-MAPK Snail en Slug activeert.[18][19][20] Slug activeert de stappen van desmosomale loslaten, celverspreiding en gedeeltelijke scheiding aan de cel-celgrenzen, die de eerste en noodzakelijke fase van het EMT-proces vormen. Aan de andere kant kan Slug de tweede fase niet activeren,[21] which includes the induction of cell motility, repression of the cytokeratin expression, and activation of vimentin expression.[22] die de inductie van celbeweeglijkheid, onderdrukking van de cytokeratine-expressie en activering van vimentine-expressie omvat. Het is bekend dat Snail en Slug de expressie van p63-isovormen reguleren, een andere transcriptiefactor die nodig is voor een goede ontwikkeling van epitheelstructuren.[23] De veranderde expressie van p63-isovormen verminderde de cel-celadhesie en verhoogde de migratie-eigenschappen van kankercellen. De p63-factor is betrokken bij het remmen van EMT en de reductie van bepaalde p63-isovormen kan belangrijk zijn bij de ontwikkeling van epitheelkankers.[24] Van sommigen van hen is bekend dat ze de expressie van cytokeratines reguleren.[25] Er wordt ook gesuggereerd dat de fosfatidylinositol 3'-kinase (PI3K)/AKT-as, de Hedgehog-signaalroute, de celkernfactor NF-κB en de activerende transcriptiefactor 2 betrokken zijn bij EMT.[26][27][28][29]
Het Wnt-signaalreactiepad reguleert EMT bij gastrulatie, hartklepvorming en kanker.[30] Activering van het Wnt-reactiepad in borstkankercellen induceert de EMT-regulator Snail en upreguleert de mesenchymmerker vimentine. Ook correleert het actieve Wnt/bèta-catenine-reactiepad met een slechte prognose bij borstkankerpatiënten in de kliniek. Op dezelfde manier activeert TGF-β de expressie van Snail en ZEB om EMT bij de hartontwikkeling, palatogenese en kanker te reguleren. De botmetastase van borstkanker heeft de TGF-β-signalering geactiveerd, wat bijdraagt aan de vorming van deze ]]laesie]]s.[31] Aan de andere kant onderdrukt p53, een bekende tumorsuppressor, EMT door de expressie van verschillende microRNA's te activeren – miR-200 en miR-34 die de productie van de eiwitten ZEB en Snail remmen, en zo het epithele fenotype behouden.[32]
Ontwikkeling en wondgenezing
Na de eerste fase van de embryogenese worden de innesteling van het embryo en de initiatie van de placentavorming geassocieerd met EMT. De trofoectoderm-cellen ondergaan EMT om de innesteling in het endometrium en de juiste plaatsing van de placenta te vergemakkelijken, waardoor de uitwisseling van voedingsstoffen en gasuitwisseling naar het embryo mogelijk wordt. Later in de embryogenese, tijdens de gastrulatie, zorgt EMT ervoor dat de cellen een specifiek gebied van het embryo kunnen binnendringen: de primitiefstreep bij Amniota en de ventrale groef bij Drosophila. De cellen in dit weefsel brengen E-cadherine en apicaal-basale polariteit tot expressie. Omdat gastrulatie een zeer snel proces is, wordt E-cadherine transcriptioneel onderdrukt door Twist en SNAI1 (gewoonlijk Snail genoemd), en op eiwitniveau door met P38 interacterend eiwit. De primitiefstreep genereert, door invaginatie, verder mesoendoderm, dat zich scheidt om een mesoderm en een endoderm te vormen, opnieuw via EMT. Mesenchymale cellen uit de primitiefstreep nemen ook deel aan de vorming van veel epitheel mesodermale organen, zoals notochord en somieten, via het omgekeerde van EMT, dwz mesenchym-epithelale overgang (MET). Lancetvisjes vormen een epitheliale neurale buis en een dorsaal notochord, maar hebben niet het EMT-potentieel van de primitiefstreep. Bij hogere chordadieren komt het mesenchym voort uit de primitiefstreep en migreert naar voren om de somieten te vormen en neemt samen met het mesenchym van de neurale top deel aan de vorming van het hartmesoderm.
Bij de gewervelden zijn epitheel en mesenchym de fundamentele weefselfenotypen. Tijdens de embryonale ontwikkeling worden migrerende neurale lijstcellen gegenereerd door EMT waarbij de epitheelcellen van het neuro-ectoderm betrokken zijn. Als gevolg hiervan scheiden deze cellen zich van de neurale plooien af, krijgen ze beweeglijkheid en verspreiden ze zich naar verschillende delen van het embryo, waar ze differentiëren naar vele andere celtypen. Ook wordt het craniofaciale mesenchym dat het bindweefsel vormt dat het hoofd en het gezicht vormt, door EMT uit neuraalbuisepitheel gevormd. EMT vindt plaats tijdens de vorming van de wervelkolom uit de extracellulaire matrix, die moet worden gesynthetiseerd door fibroblasten en osteoblasten die de neurale buis omringen. De belangrijkste bron van deze cellen zijn het sclerotoom en somietmesenchym, evenals de primitiefstreep. Door de mesenchymale morfologie kunnen de cellen naar specifieke doelen in het embryo bewegen, waar ze differentiëren en/of differentiatie van andere cellen induceren.
Tijdens wondgenezing ondergaan keratinocyten aan de rand van de wond EMT en ondergaan ze opnieuw epithelialisatie of MET wanneer de wond gesloten is. De expressie van Snail2 aan het migratiefront beïnvloedt deze toestand, omdat de overexpressie ervan de wondgenezing versnelt. Op dezelfde manier ondergaat het oppervlakte-epitheel van de eierstokken tijdens elke menstruatiecyclus EMT tijdens post-ovulatoire wondgenezing.
Onvolledige EMT of een hybride E/M-fenotype
Niet alle cellen ondergaan een volledige EMT, dat wil zeggen dat ze hun cel-celadhesie verliezen en solitaire migratie-eigenschappen verkrijgen. In plaats daarvan ondergaan de meeste cellen een onvolledige EMT, een toestand waarin ze enkele epitheel eigenschappen behouden, zoals cel-celadhesie of apico-basale polariteit, en migratie eigenschappen krijgen. Daarom hebben cellen in dit hybride epitheliale/mesenchymale (E/M) fenotype bijzondere eigenschappen zoals collectieve celmigratie. Het volgen van eencellige cellen draagt bij aan het mogelijk maken van de visualisatie van morfologische overgangen tijdens EMT, het onderscheiden van fenotypes van celmigratie en de correlatie van de erfelijkheid van deze eigenschappen tussen zustercellen. Er zijn twee wiskundige modellen voorgesteld, die proberen de opkomst van dit hybride E/M-fenotype te verklaren, en het is zeer waarschijnlijk dat verschillende cellijnen verschillende hybride toestanden aannemen, zoals blijkt uit experimenten in MCF10A, HMLE en H1975-cellijnen. Hoewel naar een hybride E/M-toestand wordt verwezen als 'metastabiel' of van voorbijgaande aard, suggereren recente experimenten in H1975-cellen dat deze toestand stabiel kan zijn.
Kanker
EMT bij kankerprogressie en metastase
Het initiëren van metastasen vereist binnendringing, die mogelijk wordt gemaakt door EMT. Carcinoomcellen in een primaire tumor verliezen cel-celadhesie gemedieerd door E-cadherine-repressie en breken door het basaal membraan met verhoogde binnendringingseigenschappen, en dringen de bloedbaan binnen. Later, wanneer deze circulerende tumorcellen (CTC's) de bloedbaan verlaten om micro-metastasen te vormen, ondergaan ze mesenchym-epithelale overgang (MET) voor klonale uitgroei op deze metastatische plaatsen. EMT en MET vormen dus de initiatie en voltooiing van de binnendringing-metastasecascade. Op deze nieuwe metastase plaats kan de tumor andere processen ondergaan om de groei te optimaliseren. EMT is bijvoorbeeld in verband gebracht met PD-L1-expressie, vooral bij longkanker. Verhoogde niveaus van PD-L1 onderdrukken het immuunsysteem waardoor de kanker zich gemakkelijker kan verspreiden. [40]
EMT verleent resistentie tegen door oncogenen geïnduceerde voortijdige veroudering. Twist1 en Twist2, evenals ZEB1, beschermen menselijke cellen en embryonale fibroblasten van muizen tegen veroudering. Op vergelijkbare wijze kan TGF-β tumorbinnendringing en ontwijking van immuunbewaking in gevorderde stadia bevorderen. Wanneer TGF-β inwerkt op geactiveerde borstepitheelcellen die Ras tot expressie brengen, heeft EMT de voorkeur en wordt apoptose geremd. Dit effect kan worden omgekeerd door inductoren van epitheeldifferentiatie, zoals GATA-3.
Er is aangetoond dat EMT wordt geïnduceerd door androgeendeprivatietherapie bij metastatische prostaatkanker.[14] Activering van EMT-programma's via remming van de androgeen-as biedt een mechanisme waarmee tumorcellen zich kunnen aanpassen om herhaling en progressie van de ziekte te bevorderen. Brachyury, Axl, MEK en Aurora kinase A zijn moleculaire aanjagers van deze programma's, en remmers worden momenteel in klinische onderzoeken uitgevoerd om therapeutische toepassingen te bepalen. Oncogene PKC-iota kan de binnendringing van melanoomcellen bevorderen door vimentine tijdens EMT te activeren. PKC-iota-remming of knockdown resulteerde in een toename van de E-cadherine- en RhoA-niveaus, terwijl de totale vimentine, gefosforyleerd vimentine (S39) en Par6 in metastatische melanoomcellen daalden. Deze resultaten suggereerden dat PKC-iota betrokken is bij signaalroutes die EMT bij melanoom upreguleren.
Er zijn aanwijzingen dat EMT betrokken is bij het verwerven van resistentie tegen geneesmiddelen. Er werd gevonden dat de toename van EMT-merkers verband houdt met de resistentie van epitheelcellijnen van ovariumcarcinoom tegen paclitaxel. Op dezelfde manier verleent Snail ook resistentie tegen paclitaxel, adriamycine en bestraling door p53-gemedieerde apoptose te remmen. Bovendien werd onlangs aangetoond dat ontstekingen, die in verband zijn gebracht met de progressie van kanker en fibrose, verband houden met kanker door middel van door ontstekingen geïnduceerde EMT.[46] Bijgevolg stelt EMT cellen in staat een migrerend fenotype te krijgen, evenals meervoudige immunosuppressie (remmen afweersysteem), resistentie tegen geneesmiddelen en het ontwijken van apoptose-mechanismen.
Er zijn aanwijzingen dat cellen die EMT ondergaan stamcelachtige eigenschappen krijgen, waardoor kankerstamcellen (CSC's) ontstaan. Na transfectie door geactiveerde Ras neemt een subpopulatie van cellen, die de vermeende stamcelmerkers CD44high/CD24low vertonen toe met de gelijktijdige inductie van EMT. Ook is ZEB1 in staat stamcelachtige eigenschappen te verlenen, waardoor de relatie tussen EMT en stamcellen wordt versterkt. EMT kan dus een groter gevaar opleveren voor kankerpatiënten, omdat EMT er niet alleen voor zorgt dat de carcinoomcellen in de bloedbaan terechtkomen, maar ze ook eigenschappen van stamcellen geeft die het tumorverwekkende en proliferatie potentieel vergroten.[48]
Recente onderzoeken hebben de primaire effecten van EMT echter verder verschoven van binnendringing en metastase naar resistentie tegen chemotherapeutischee middelen. Onderzoek naar borstkanker en pancreaskanker toonde beide geen verschil aan in het metastatische potentieel van cellen bij verwerving van EMT. Deze komen overeen met een andere studie die aantoont dat de EMT-transcriptiefactor TWIST feitelijk intacte zonula adhaerens vereist om lokale binnendringing bij borstkanker te bemiddelen. De effecten van EMT en de relatie ervan met binnendringing en metastase kunnen daarom zeer contextspecifiek zijn.
In blaaskankercellijnen remt overexpressie van HDAC5 de proliferatie op de lange termijn, maar kan de epithelale naar mesenchymale transitie (EMT) bevorderen.
Bloedplaatjes-inductie van EMT in kankercellen

Bloedplaatjes hebben het vermogen om de inductie van EMT in kankercellen te initiëren. Wanneer bloedplaatjes naar een plaats in het bloedvat worden gebracht, kunnen ze een verscheidenheid aan groeifactoren vrijgeven (PDGF, [53] VEGF, [54] Angiopoietine-1 [55]) en cytokinen, waaronder de EMT-inductor TGF-β. De afgifte van TGF-β door bloedplaatjes in bloedvaten nabij primaire tumoren verhoogt de indringing en bevordert de metastase van kankercellen in de tumor. Studies naar defecte bloedplaatjes en een verminderd aantal bloedplaatjes in muismodellen hebben aangetoond dat een verminderde bloedplaatjesfunctie samengaat met verminderde metastatische vorming. Bij mensen zijn het aantal bloedplaatjes en trombocytose (een verhoogd aantal bloedplaatjes in het bloed) in verband gebracht met gevorderde, vaak metastatische kanker bij baarmoederhalskanker, eierstokkanker, maagkanker en slokdarmkanker. 63] Hoewel er veel onderzoek is gedaan naar het bestuderen van interacties tussen tumorcellen en bloedplaatjes, is er nog geen kankertherapie ontwikkeld die zich op deze interactie richt.[64] Dit kan gedeeltelijk te wijten zijn aan de herhaling van protrombotische reactiepaden die het gebruik van meerdere therapeutische benaderingen zouden vereisen om pro-metastatische gebeurtenissen te voorkomen via EMT-inductie in kankercellen door geactiveerde bloedplaatjes.
Om de kansen op de ontwikkeling van een kankermetastase te vergroten, moet een kankercel detectie en waarneming door het immuunsysteem vermijden zodra deze in de bloedbaan terechtkomt. Geactiveerde bloedplaatjes hebben het vermogen om glycoproteïnen en glycolipiden (P-selectineliganden zoals PSGL-1) op het oppervlak van kankercellen te binden voor een fysieke barrière die de kankercel beschermt tegen door natuurlijke killercellen gemedieerde lyse in de bloedbaan. Bovendien bevorderen geactiveerde bloedplaatjes de adhesie van kankercellen aan geactiveerde endotheelcellen die de bloedvaten bekleden met behulp van adhesiemoleculen die op bloedplaatjes aanwezig zijn. P-selectine liganden op het oppervlak van kankercellen moeten nog worden opgehelderd en kunnen dienen als potentiële biomarkers voor ziekteprogressie bij kanker.
Geneesmiddelen gericht op EMT tegen kanker
Veel studies hebben voorgesteld dat inductie van EMT het primaire mechanisme is waardoor epitheelkankercellen kwaadaardige fenotypes worden die metastase bevorderen. Geneesmiddelenontwikkeling gericht op de activering van EMT in kankercellen is dus een doel geworden van farmaceutische bedrijven.[68]
Micromoleculen die door TGF-β geïnduceerde EMT kunnen remmen, zijn in ontwikkeling.[68] Silmitasertib (CX-4945) is een micromolecuulremmer van proteïnekinase CK2, die in verband wordt gebracht met door TGF-β geïnduceerde EMT, en bevindt zich momenteel in klinische onderzoeken voor cholangiocarcinoom (galwegkanker), evenals in preklinische ontwikkeling voor hematologische en lymfoïde malignes. In januari 2017 kreeg Silmitasertib de status van weesgeneesmiddel van de Amerikaanse Food and Drug Administration voor cholangiocarcinoom en bevindt zich momenteel in een fase II-studie. Klinische onderzoeken om vermeende voordelen aan te tonen zijn nog aan de gang.[33] Silmitasertib wordt ontwikkeld door Senhwa Biosciences.[71] Een andere micromoleculaire remmer Galunisertib (LY2157299) is een krachtige TGF-β type I-receptorkinaseremmer waarvan is aangetoond dat deze de grootte, de groeisnelheid van tumoren en het tumorvormende potentieel vermindert in drievoudige negatieve borstkankercellijnen met behulp van muizenxenotransplantaten. 72] Galunisertib werd ontwikkeld door Lilly Oncology en bevond zich in fase I/II klinische onderzoeken voor hepatocellulair carcinoom, niet door een chirurgische ingreep verwijderbare pancreaskanker en kwaadaardig glioom. In januari 2020 is Eli Lilly met het onderzoek gestopt.[34] Er wordt gesuggereerd dat mnicromolecuulremmers van EMT niet fungeren als vervanging voor traditionele chemotherapeutische middelen, maar waarschijnlijk de grootste werkzaamheid zullen vertonen bij de behandeling van kanker wanneer ze in combinatie daarmee worden gebruikt.
Antagomirs en microRNA-nabootsers hebben belangstelling gekregen als potentiële bron van therapieën om EMT-geïnduceerde metastase bij kanker aan te pakken en om vele andere ziekten te behandelen. Antagomirs, ook bekend als anti-miRs, zijn een klasse van chemisch gemanipuleerde oligonucleotiden die zijn ontworpen om microRNA's tot zwijgen te brengen. Antagomirs werden voor het eerst ontwikkeld om zich te richten op miR-122, een microRNA dat overvloedig aanwezig was en specifiek was voor de lever. Deze ontdekking heeft geleid tot de ontwikkeling van andere antagomirs die kunnen koppelen aan specifieke microRNA's die aanwezig zijn in de micro-omgeving van de tumor of in de kankercellen. 75][73] Een microRNA dat miR-655 nabootst, bleek EMT te onderdrukken door het richten van EMT-inducerende transcriptiefactor ZEB1 en TGF-β-receptor 2 in een pancreaskankercellijn. Overexpressie van de miR-655-nabootser in de Panc1-kankercellijn verhoogde de expressie van E-cadherine en onderdrukte de migratie en indringing van mesenchymachtige kankercellen. Het gebruik van microRNA-nabootsers om EMT te onderdrukken is uitgebreid naar andere kankercellijnen en biedt potentieel voor de ontwikkeling van klinische geneesmiddelen. MicroRNA-nabootsers en antagomirs lijden echter aan een gebrek aan stabiliteit in vivo en missen een nauwkeurig afgiftesysteem om deze moleculen voor behandeling naar de tumorcellen of het weefsel te sturen.[77] Verbeteringen aan de antagomir- en microRNA-nabootsende stabiliteit door chemische modificaties zoals vergrendelde nucleïnezuur (LNA) oligonucleotiden of peptidenucleïnezuren (PNA) kunnen de snelle afbraak van deze kleine moleculen door RNasen voorkomen. De levering van antagomirs en microRNA-nabootsers in cellen door deze moleculen in liposoom-nanodeeltjes in te sluiten heeft interesse gewekt, maar liposoomstructuren lijden aan hun eigen nadelen die moeten worden overwonnen voor hun effectieve gebruik als medicijnafgiftemechanisme. Deze nadelen van liposoom-nanodeeltjes omvatten niet-specifieke opname door cellen en inductie van immuunreacties. De rol die microRNA's spelen bij de ontwikkeling en metastase van kanker wordt wetenschappelijk veel onderzocht en het moet nog worden aangetoond of microRNA-nabootsers of antagomirs kunnen dienen als standaard klinische behandelingen om EMT of oncogene microRNA's bij kanker te onderdrukken.
Generatie van endocriene voorlopercellen uit eilandjes van Langerhans
Vergelijkbaar met het genereren van kankerstamcellen, werd aangetoond dat EMT voorlopercellen genereert konden worden uit menselijke eilandjes van Langerhans. Aanvankelijk werd voorgesteld dat de van menselijke eilandjes van Langerhans afkomstige voorlopercellen (hIPC's) betere voorlopers zijn, aangezien β-cel-nakomelingen in deze hIPC's epigenetische kenmerken erven die een actief insulinepromotergebied definiëren. Later suggereerde een andere reeks experimenten echter dat gelabelde β-cellen in vitro dedifferentiëren tot een mesenchymaalachtig fenotype, maar niet prolifereren; waarmee in 2007 een debat op gang werd gebracht.
Omdat deze onderzoeken bij menselijke eilandjes van Langerhans geen analyse van de afstamming bevatten, werden deze bevindingen van onomkeerbaar gelabelde β-cellen bij muizen geëxtrapoleerd naar menselijke eilandjes van Langerhans. Door gebruik te maken van een tweetallig lentiviraal en genetisch afstammingssysteem om β-cellen te labelen, werd op overtuigende wijze aangetoond dat β-cellen van volwassen menselijke eilandjes van Langerhans EMT ondergaan en in vitro prolifereren. Deze bevindingen werden ook bevestigd in menselijke foetale insulineproducerende cellen van de alvleesklier, en de mesenchymale cellen afgeleid van de eilandjes van Langerhans kunnen het omgekeerde van EMT ondergaan – MET – om eilandjesachtige celaggregaten te genereren. Het concept van het genereren van voorlopercellen uit insulineproducerende cellen door EMT of het genereren van kankerstamcellen tijdens EMT bij kanker kan dus potentie hebben voor vervangingstherapie bij diabetes en pleit voor medicijnen die zich richten op de remming van EMT bij kanker.
Afbeeldingen
-
Epitheel-mesenchymale overgang (EMT) met inductoren
-
Verschillende graden van epitheel-mesenchymale overgang (EMT) correleren met verschillende weefselmorfologieën
-
Ingressie bij een vogel-embryo
Bronnen, noten en/of referenties
|