Gebruiker:CFCF/Kladblok/Longkanker
{{samenvoegennaar|Longkanker}}
| Neem het voorbehoud bij medische informatie in acht. Raadpleeg bij gezondheidsklachten een arts. |
| Longkanker | ||||
|---|---|---|---|---|

| ||||
| Coderingen | ||||
| ICD-10 | C33-C34 | |||
| ICD-9 | 162 | |||
| OMIM | #211980 | |||
| DiseasesDB | 7616 | |||
| MedlinePlus | 007194 | |||
| eMedicine | med/1333med/1336 emerg/335 radio/807 radio/405radio/406 | |||
| MeSH | D002283 | |||
| ||||
Longkanker is een ziekte die wordt gekenmerkt door ongeremde celgroei (kanker) in weefsels van de longen. Deze ongeremde celgroei wordt vaak beschreven als een kwaadaardige tumor, gezwel of carcinoom. Zonder behandeling kan dit uitzaaien, een proces dat metastase wordt genoemd waarbij deze tumorcellen zich buiten de longen uitbreiden naar nabijgelegen weefsels of andere lichaamsdelen. De meeste vormen van kanker die in de longen beginnen, zogeheten primaire longkanker, zijn carcinomen die ontstaan in epitheelcellen. De voornaamste typen longkanker zijn:
- kleincellig longkanker (In het Engels small cell lung cancer afgekort als SCLC), ook wel havercelcarcinoom genoemd
- niet-kleincellig longkanker (In het Engels non-small cell lung cancer afgekort als NSCLC)
De meest voorkomende symptomen zijn hoesten (inclusief het ophoesten van bloed), gewichtsverlies en kortademigheid.[1]
Longkanker wordt meestal veroorzaakt door roken, hierbij worden de longen langdurige blootgesteld aan tabaksrook,[2] dat de oorzaak is van 80-90% van alle gevallen van longkanker.[1] Niet-rokers vormen 10-15% van de longkankerpatiënten[3] en deze gevallen worden vaak toegeschreven aan een combinatie van meeroken,[4][5] genetische factoren,[6] radongas,[6] asbest[7] en luchtvervuiling[6]. Longkanker is te zien op een röntgenfoto van de borstkas en met computertomografie (CT-scan). De diagnose wordt bevestigd met een biopsie[8] die doorgaans wordt uitgevoerd via bronchoscopie of onder CT-geleiding. De behandeling en het langetermijnresultaat hangen af van het type kanker, het stadium (mate van verspreiding) en de algehele gezondheid van de patiënt.
Gebruikelijke behandelingen zijn onder meer chirurgie, chemotherapie en radiotherapie. Niet-kleincellige kanker wordt soms behandeld met chirurgie, terwijl bij kleincellige kanker met chemotherapie en radiotherapie betere resultaten worden verkregen.[9] De prognose van longkanker is slecht, 85% van de mensen waarbij de diagnose longkanker wordt gesteld, overlijdt binnen 5 jaar.[10] Wereldwijd is longkanker de meest voorkomende oorzaak van overlijden door kanker bij zowel mannen als vrouwen en is de ziekte sinds 2008 verantwoordelijk voor 1,38 miljoen doden per jaar.[11]
Klachten en verschijnselen[bewerken | brontekst bewerken]
Klachten en verschijnselen die kunnen wijzen op longkanker, zijn onder andere:[1]
- symptomen met betrekking tot de ademhaling: hoesten, ophoesten van bloed, piepend ademen|piepende ademhaling en kortademigheid
- algemene lichamelijke symptomen: gewichtsverlies, koorts, trommelstokvingers en vermoeidheid
- symptomen door plaatselijke druk: pijn op de borst, botpijn, vena cava inferior syndroom en met moeite met slikken
Bij een tumor in de luchtwegen kan de luchtstroom worden belemmerd, wat leidt tot ademhalingsproblemen. De verstopping kan leiden tot een opeenhoping van slijm achter de blokkade en kan de patiënt vatbaar maken voor een longontsteking.[1]
Afhankelijk van het type tumor kunnen zogeheten paraneoplastische verschijnselen in eerste instantie de aandacht op de ziekte vestigen.[12] Bij longkanker kan het dan gaan om onder meer het syndroom van Lambert-Eaton (spierzwakte ten gevolge van autoantilichamen), hypercalciëmie of het syndroom van inadequate secretie van antidiuretisch hormoon (SIADH). Tumoren in de top van de long, die bekend staan als pancoasttumoren, kunnen plaatselijk het zenuwstelsel binnendringen, wat leidt tot het syndroom van Horner (verzakken van het ooglid en een kleine pupil aan die kant) en tot schade aan de plexus brachialis.[1]
Veel van de symptomen van longkanker (slechte eetlust, gewichtsverlies, koorts, vermoeidheid) zijn niet-specifiek.[13] Tegen de tijd dat er symptomen ontstaan en de patiënt een arts raadpleegt, heeft de kanker zich bij veel patiënten al verspreid tot buiten de oorspronkelijke plaats. Gebruikelijke verspreidingsplaatsen zijn onder andere de hersenen, botten, bijnieren, de andere long, de lever, het hartzakje en de nieren.[14] Ongeveer 10% van de mensen met longkanker vertoont op het moment van de diagnose geen symptomen. De kanker wordt dan bij toeval opgemerkt bij een röntgenfoto van de borst.[15]
Oorzaken[bewerken | brontekst bewerken]
Kanker ontwikkelt zich na beschadiging van het DNA. Deze genetische schade is van invloed op de normale functies van cellen, inclusief celdeling, geprogrammeerde celdood (apoptose) en DNA-herstel. Naarmate de schade toeneemt, wordt het risico op kanker groter.[13]
Roken[bewerken | brontekst bewerken]


Roken, vooral van sigaretten, is verreweg de belangrijkste oorzaak van longkanker.[16] Sigarettenrook bevat meer dan 60 bekende kankerverwekkende stoffen (carcinogenen),[17] inclusief radio-isotopen die vervalproducten van radon zijn, nitrosamine en benzopyreen. In de ontwikkelde landen is 90% van de sterfgevallen door longkanker onder mannen in het jaar 2000 toegeschreven aan roken (70% bij vrouwen).[18][1]Roken is de oorzaak van 80–90% van alle gevallen van longkanker.[1][19]
Passief roken (het inhaleren van rook van iemand anders die rookt) is een oorzaak van longkanker bij niet-rokers. Een passieve roker is meestal iemand die woont bij of werkt met een roker. Uit onderzoeken in de Verenigde Staten,[20][21]Europa,[22] het Verenigd Koninkrijk[23] en Australië[24] is telkens weer gebleken dat passieve rokers een aanzienlijk verhoogd risico lopen.[25] Wie samenwoont met een roker, heeft een 20–30% hoger risico en wie werkt in een omgeving met tweedehands rook loopt een 16–19% hoger risico.[26] Onderzoek naar zijstroomrook suggereert dat deze rook gevaarlijker is dan direct ingeademde rook.[27] In de Verenigde Staten sterven jaarlijks ongeveer 3400 doden door longkanker als gevolg van passief roken.[21]
Radongas[bewerken | brontekst bewerken]
Radon is een kleurloos en geurloos gas dat ontstaat bij het verval van radioactief radium, dat op zijn beurt een vervalproduct is van uranium dat wordt gevonden in de aardkorst. De producten van radioactief verval ioniseren DNA, waardoor mutaties ontstaan die soms de vorm van kanker aannemen. Radon is de op één na meest voorkomende oorzaak van longkanker in de Verenigde Staten (na roken).[21] Het risico neemt toe met 8–16% bij iedere toename van 100 Bq/m³ in de concentratie van radon.[28] De hoeveelheid radongas verschilt per plaats en per samenstelling van de dieper gelegen grond- en steenlagen. In regio's zoals Cornwall in het Verenigd Koninkrijk (waar graniet in de bodem zit) is radongas een groot probleem. Gebouwen moeten mechanisch worden geventileerd om de concentraties radongas te verlagen. Het Amerikaanse bureau voor milieubescherming (United States Environmental Protection Agency - EPA) schat dat 1 op de 15 huizen in de Verenigde Staten een hoeveelheid radon bevat die hoger is dan de aanbevolen richtlijn van 4 picocurie per liter (pCi/l) (148 Bq/m³).[29]
Asbest[bewerken | brontekst bewerken]
Asbest kan allerlei longziekten veroorzaken, waaronder longkanker. Bekender is het mesothelioom, dit is een tumor van het longvlies die vaak veroorzaak wordt door asbest. Tumoren van het longvlies vallen niet onder de longtumoren. [30][31] Tabaksrook en asbest hebben gecombineerd een versterkende werking op het ontstaan van longkanker.[7]
Luchtvervuiling[bewerken | brontekst bewerken]
Vervuiling van de buitenlucht verhoogt het risico op longkanker in geringe mate.[6] Mensen in derde wereld landen die nog binnenhuis koken op hout, steenkool, mest of gewas resten lopen meer risico op longkanker. [32][33]
Genetische factoren[bewerken | brontekst bewerken]
Naar schatting 8 tot 14% van de gevallen van longkanker is te wijten aan erfelijke factoren.[34] Verwanten van mensen met longkanker lopen een 2,4 maal zo hoog risico als anderen. Dit is waarschijnlijk het gevolg van een combinatie van genen.[35] Soms lijkt longkanker genetische te zijn, echter zijn gemeenschappelijke risicofactoren zoals roken vaker de oorzaak van het voorkomen van longkanker in de familie.
Andere oorzaken[bewerken | brontekst bewerken]
Tal van andere stoffen, beroepen en blootstelling aan omgevingsfactoren zijn in verband gebracht met longkanker. Het internationale bureau voor kankeronderzoek (International Agency for Research on Cancer - IARC) stelt dat er "voldoende bewijs" is dat de volgende factoren longkanker kunnen veroorzaken:[36]
- Sommige metalen (aluminiumproductie, cadmium en cadmiumverbindingen, chroom(VI)-verbindingen, beryllium en berylliumverbindingen, gegoten ijzer en staal, nikkelverbindingen, arseen en anorganische arseenverbindingen, ondergrondse winning van hematiet)
- Sommige verbrandingsproducten (onvolledige verbranding, steenkool (uitstoot door verbranding van kolen binnenshuis), koolvergassing, koolteerpek, cokesproductie, roetdeeltjes, uitlaatgassen van dieselmotoren)
- Ioniserende straling (röntgenstralen, radon-222 en de vervalproducten ervan, gammastralen, plutonium)
- Sommige giftige gassen (methylether (technische kwaliteit), bis(chloormethyl)ether, mosterdgas, MOPP (Mitoxine Oncovin Procarbazine Prednison) een mengsel van vincristine, prednison, mosterdgas en procarbazine verfdampen.
- Rubberproductie en kristallijn silicastof
Ontstaan van de ziekte[bewerken | brontekst bewerken]
Net als veel andere vormen van kanker ontstaat longkanker door de combinatie van meerdere factoren. Mensen kunnen aanleg hebben voor kanker, dit gebeurt door de activering van een of meerdere oncogenen of deactivering van tumoronderdrukkende genen.[37] Deze activatie of deactivatie kan komen door de blootstelling aan carcinogenen zoals tabaksrook of andere chemicaliën.
Diagnose[bewerken | brontekst bewerken]

Een van de eerste onderzoeken bij iemand met symptomen die op longkanker kunnen wijzen, is een röntgenfoto van de borstkas. Daarop kan een duidelijke massa (tumor), verwijding van het mediastinum (wat kan wijzen op uitzaaiingen in de lymfeklieren), atelectase (samenvallen van de long), consolidatie of pleuravocht te zien zijn.[2] Meestal wordt met een CT-scan meer informatie over het type en de ernst van de ziekte verzameld. Vaak wordt met een bronchoscopie of CT-geleide biopsie een stukje weefsel van de tumor genomen voor histologisch- of pathologisch onderzoek.[15]
Longkanker ziet er op een röntgenfoto van de borstkas vaak uit als een zwelling. De differentiële diagnose is echter breed. Veel andere ziekten geven hetzelfde beeld, waaronder tuberculose, schimmelinfecties, uitzaaiingen van kanker elders in het lichaam of een longontsteking (pneumonie). Zeldzame oorzaken van een zwelling zijn onder meer hamartomen, bronchogene cysten, adenomen, arterioveneuze misvorming, pulmonaire sequestratie, reuma knobbel, ziekte van Wegener of een goedaardige zwelling van de lymfeklier (lymfoom).[38] Longkanker kan ook toevallig worden ontdekt als een zwelling wanneer om een geheel andere reden een röntgenfoto of een CT-scan van de borstkas is gemaakt.[39]De definitieve diagnose van longkanker is gebaseerd op het histologische onderzoek van het verdachte weefsel samen met de symptomen en radiologische kenmerken.[1]
Classificatie[bewerken | brontekst bewerken]
| Histologisch type | Incidentie per 100.000 per jaar |
|---|---|
| Alle typen | 66,9 |
| Adenocarcinoom | 22,1 |
| Plaveiselcelcarcinoom | 14,4 |
| Kleincellig carcinoom | 9,8 |
| Overig/ongedifferentieerd | 20,6 |
Longkanker wordt geclassificeerd naar histologisch type, dit is het oorspronkelijke celtype waaruit de kanker is ontstaan.[13] Deze classificatie is van belang voor bepaling van de behandeling en het voorspellen van het verloop van de ziekte. Verreweg de meeste vormen van zijn carcinomen, kwaadaardige tumoren die ontstaan vanuit epitheelcellen. Longcarcinomen worden ingedeeld naar de grootte en het uiterlijk van de kwaadaardige cellen zoals een histopatholoog die onder een microscoop ziet. Er wordt een globale tweedeling in niet-kleincellige en kleincellige longcarcinomen gebruikt.[40]
Niet-kleincellig longkanker[bewerken | brontekst bewerken]

De drie belangrijkste subtypen van niet-kleincellig longkanker zijn adenocarcinoom, plaveiselcellongcarcinoom en grootcellig longcarcinoom.[1]
Bijna 40% van alle longkankers zijn adenocarcinomen, die meestal ontstaan in het weefsel aan de buitenrand van de long.[8] De meeste gevallen van adenocarcinoom houden verband met roken, maar ook onder niet-rokers is de adenokanker de meest voorkomende longkanker.[41] Een subtype van het adenocarcinoom, het bronchioloalveolair carcinoom, komt meer voor bij vrouwen die nooit hebben gerookt en biedt op lange termijn mogelijk betere kansen op overleving.[42]
Het plaveiselcelcarcinoom is verantwoordelijk voor ongeveer 30% van alle gevallen van longkanker. Meestal treedt dit op nabij de grote luchtwegen. In het midden van de tumor wordt vaak een holte en de daarmee samenhangende celdood aangetroffen.[8] Ongeveer 9% van alle gevallen van longkanker bestaat uit grootcellige carcinomen. Deze worden zo genoemd omdat de kankercellen groot zijn met zeer veel cytoplasma, een grote kern en opmerkelijke nucleoli.[8]
Kleincellig longkanker[bewerken | brontekst bewerken]

Bij het kleincellige longkanker (SCLC) bevatten de cellen dichte neurosecretoire korrels (vesikels die neuro-endocriene hormonen bevatten), waardoor deze tumor gepaard gaat met een endocrien/paraneoplastisch syndroom (een reeks verschijnselen die wordt veroorzaakt doordat de kanker zelf hormonen afscheidt).[43] De meeste gevallen doen zich voor in de grote luchtwegen (primaire en secundaire bronchiën).[15] Deze kwaadaardige tumoren groeien snel en zorgen in een vroeg stadium van de ziekte voor uitzaaiingen. Zestig tot zeventig procent is al uitgezaaid wanneer de kanker merkbaar wordt. Dit type longkanker hangt sterk samen met roken.[1]
Andere typen[bewerken | brontekst bewerken]
Er worden vier belangrijke histologische subtypen onderscheiden, al kunnen sommige kankers een combinatie van verschillende subtypen bevatten.[44] Zeldzame subtypen zijn onder meer kliertumoren, carcinoïde tumoren en ongedifferentieerde carcinomen.[1]
Uitzaaiingen[bewerken | brontekst bewerken]
| Histologisch type | Immunokleuring |
|---|---|
| Plaveiselcelcarcinoom | CK5/6 positief CK7 negatief |
| Adenocarcinoom | CK7 positief TTF-1 positief |
| Grootcellig carcinoom | TTF-1 negatief |
| Kleincellig carcinoom | TTF-1 positief CD56 positief Chromogranine positief Synaptofysine positief |
Tumoren elders in het lichaam kunnen ook uitzaaiingen in de long geven. Deze zogenoemde secundaire kanker wordt geclassificeerd naar de plaats van oorsprong; borstkanker die naar de long is uitgezaaid, wordt bijvoorbeeld gemetastaseerde borstkanker genoemd. Metastasen hebben vaak een karakteristieke ronde vorm op röntgenfoto's van de borstkas.[45]
Primaire longkanker zaait vaak uit naar de hersenen, botten, de lever en de bijnieren.[8] Immunokleuring van een biopsie helpt vaak de oorspronkelijke bron te vinden.[46]
Stadiëring[bewerken | brontekst bewerken]
De stadiëring van longkanker is een bepaling van de mate van verspreiding van de kanker vanaf de oorspronkelijke plaats. De mate van verspreiding is een van de factoren die van invloed zijn op de prognose en de mogelijke behandeling van longkanker.[1]
De stadiëring van niet-kleincellige longkanker (NSCLC) vindt in eerste instantie plaats aan de hand van de TNM-classificatie. Deze is gebaseerd op de grootte van de primaire tumor, verspreiding naar lymfeknooppunten en metastasen (uitzaaiingen). Vervolgens wordt op basis van de TNM-parameters de kanker in een groep ingedeeld, die kan variëren van "occulte kanker" (kanker waar de primaire tumor nog niet gevonden is) tot de stadia 0, IA, IB, IIA, IIB, IIIA, IIIB en IV. Deze indeling in een stadiumgroep helpt bij de keuze van behandeling en het inschatten van de prognose.[47] Kleincellig longkanker (SCLC) wordt vanouds geclassificeerd als 'beperkt stadium' (beperkt tot één helft van de borst en binnen het bereik van één enkel verdraagbaar radiotherapieveld) of 'uitgebreide stadium' (verspreide ziekte).[1] De TNM-classificatie en -groepsindeling zijn echter nuttig bij het inschatten van de prognose.[47]
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TNM | Stadium groep |
|---|---|
| T1a–T1b N0 M0 | IA |
| T2a N0 M0 | IB |
| T1a–T2a N1 M0 | IIA |
| T2b N0 M0 | |
| T2b N1 M0 | IIB |
| T3 N0 M0 | |
| T1a–T3 N2 M0 | IIIA |
| T3 N1 M0 | |
| T4 N0–N1 M0 | |
| N3 M0 | IIIB |
| T4 N2 M0 | |
| M1 | IV |
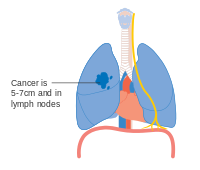
- Schema van belangrijkste kenmerken van longkanker stadiëring
-
Stadium IA en IB longkanker
-
Stadium IIA longkanker
-
Stadium IIB longkanker
-
Een mogelijkheid voor stadium IIB longkanker, T2b. Indien de tumor zich 2cm of dichter bij de carina bevind is het een stadium III.
-
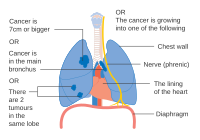
Stadium IIIA longkanker
-
Stadium IIIA longkanker, als er één of meerdere kenmerken beschreven in de afbeelding
-
Stadium IIIA longkanker
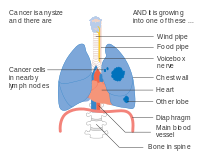
-
Stadium IIIB longkanker
-
Stadium IIIB longkanker
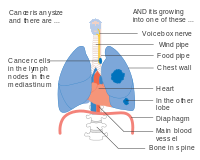
-
Stadium IV longkanker
Voor zowel niet-kleincellige als kleincellige kankers bestaan de twee algemene stadiumbepalingen uit klinische stadiëring en chirurgische stadiëring. Klinische stadiëring wordt uitgevoerd vóór definitieve chirurgie. Klinische stadiëring wordt gebaseerd op de uitkomsten van beeldvormende onderzoeken (zoals CT-scans en PET-scans) en biopsieën. Chirurgische stadiëring vindt plaats tijdens of na de ingreep en wordt gebaseerd op de gecombineerde resultaten van chirurgische en klinische bevindingen, waaronder chirurgische monsters van lymfeklieren in de borstkas.[8]
Preventie[bewerken | brontekst bewerken]
Preventie, oftewel het voorkómen van longkanker, is de meest kosteneffectieve manier om het ontstaan van longkanker tegen te gaan. Terwijl in de meeste landen kankerverwekkende stoffen thuis en op het werk zijn herkend en verboden, is roken vaak niet verboden. Een belangrijk doel bij het voorkómen van longkanker is verbieden van het roken van tabak, en het stoppen met roken is een belangrijk preventief onderdeel in dit proces.[49]
Beleidsmaatregelen om meeroken roken te verminderen in openbare ruimten zoals restaurants en werkplekken zijn gebruikelijk geworden in veel Westerse landen.[50] In Bhutan geldt sinds 2005 een volledig rookverbod[51] en in India is in oktober 2008 een verbod op roken in het openbaar afgekondigd.[52] De Wereldgezondheidsorganisatie heeft overheden opgeroepen tabaksreclame volledig te verbieden om zo te voorkomen dat jongeren gaan roken. Waar zo'n verbod is ingevoerd, is het gebruik van tabak naar schatting met 16% afgenomen.[53]
Langdurig gebruik van extra vitamine A,[54][55] vitamine C,[54] vitamine D[56] of vitamine E[54] verkleint het risico op longkanker niet. Sommige onderzoeken suggereren dat mensen die in verhouding veel groenten en fruit eten minder risico lopen,[21][57] maar hierbij is waarschijnlijk sprake geweest van door elkaar lopende factoren waardoor niet na te gaan is welke factor een bepaald resultaat oplevert confounding. Diepergaande onderzoeken hebben geen duidelijk verband opgeleverd.[57]
Screening[bewerken | brontekst bewerken]
Screening is het gebruik van medische onderzoeken om ziekten op te sporen bij mensen die geen klachten of symptomen hebben. Screeningtests voor longkanker zijn onder meer sputum-cytologie, röntgenfoto's van de borstkas en computertomografie (CT). Van screeningprogramma's met röntgenfoto's van de borstkas of cytologisch onderzoek van sputum is niet bewezen dat ze voordeel opleveren.[58] Door jaarlijkse screening met laag gedoseerde CT-scans van mensen met een hoog risico (d.w.z. mensen van 55 tot 79 jaar die meer dan 30 pakjaren hebben gerookt of die eerder longkanker hebben gehad) kan het absolute risico op overlijden door longkanker afnemen met 0,3% (relatieve risicoreductie 20%).[59][60] Een groot percentage van de scans heeft echter een vals-positieve uitslag, wat kan leiden tot onnodige ingrijpende procedures en tot aanzienlijke kosten.[61] Tegenover iedere terecht positieve scan staan meer dan 19 vals-positieve scans.[62] De blootstelling aan straling is nog een potentieel nadeel van screening.[63]
Behandeling[bewerken | brontekst bewerken]
De behandeling van longkanker is afhankelijk van het specifieke celtype van de kanker, hoe ver de ziekte zich heeft verspreid, de conditie en wensen van de patiënt. Gebruikelijke behandelingen zijn onder meer palliatieve zorg,[64] chirurgie, chemotherapie en radiotherapie.[1]
Chirurgie[bewerken | brontekst bewerken]

Als met onderzoek een niet-kleincellig longkanker wordt vastgesteld, wordt het stadium bepaald om na te gaan of de ziekte plaatselijk is en te behandelen valt met chirurgie, of dat het gezwel zich zo sterk heeft verspreid dat chirurgie geen optie meer is. Dit stadium wordt bepaald met CT-scans en positronemissietomografie.[1] Wanneer betrokkenheid van lymfeklieren in het mediastinum (de ruimte tussen de longen met grote luchtwegen, bloedvaten en lymfeklieren) wordt vermoed, kunnen via mediastinoscopie biopsie van de klieren worden genomen als hulp bij de stadiëring.[65] Met bloedonderzoek en longfunctieonderzoek wordt vastgesteld of een patiënt fit genoeg is voor chirurgie.[15] Als longfunctieonderzoeken laten zien dat er weinig reserve longcapaciteit is, is chirurgie niet altijd mogelijk.[1]
In een vroeg stadium van niet-kleincellige longkanker is verwijdering van een longkwab (lobectomie) de chirurgische behandeling die de voorkeur krijgt. Als patiënten niet in aanmerking komen voor een volledige lobectomie, kan een deel van de aangetaste longkwab (wigresectie) worden verwijderd. Bij een wigresectie is het risico op terugkeer van de kanker echter groter dan bij lobectomie.[66] Brachytherapie met radioactief jodium aan de randen van de wigresectie kan het risico op terugkeer van de kanker verkleinen.[67] Het gebeurt maar zelden dat een hele long wordt verwijderd (pneumonectomie).[66] Minimaal invasieve benaderingen van longkankeroperaties zijn video-ondersteunde thoracoscopische chirurgie en VATS-lobectomie.[68] VATS-lobectomie is net zo effectief als een gewone open operatie waarbij de long verwijderd wordt en gaat gepaard met minder problemen na de ingreep.[69]
Bij kleincellige longkanker wordt gewoonlijk chemotherapie en/of radiotherapie gebruikt.[70] Er wordt echter opnieuw nagedacht over het inzetten van chirurgie bij kleincellige longkanker. In een vroeg stadium van kleincellige longkanker kan chirurgie in aanvulling op chemotherapie en bestraling betere resultaten opleveren.[71]
Radiotherapie[bewerken | brontekst bewerken]
Radiotherapie (bestraling) wordt vaak gegeven in combinatie met chemotherapie en kan worden ingezet voor genezing van patiënten met niet-kleincellige longkanker die niet in aanmerking komen voor chirurgie. Deze vorm van hoogintensieve radiotherapie wordt radicale radiotherapie genoemd.[72] Een verfijning van deze techniek is continue gehyperfractioneerde versnelde radiotherapie (CHART), waarbij gedurende een korte periode een hoge dosis radioactieve straling wordt gegeven.[73] Na een operatie die bedoeld is om de patiënt te genezen van niet-kleincellige longkanker mag de borstkas in het algemeen niet worden bestraald.[74] Sommige patiënten met uitzaaiingen in bepaalde lymfeklieren in het mediastinum (stadium N2) kunnen echter baat hebben bij radiotherapie na de operatie.[75]
Voor patiënten met potentieel te genezen kleincellige longkanker wordt vaak radiotherapie van de borstkas aanbevolen als aanvulling op chemotherapie.[8]
Als een groeiende tumor een kort deel van de bronchus blokkeert, kan brachytherapie (plaatselijke radiotherapie) direct in de luchtwegen worden gegeven om de doorgang te openen.[76] Vergeleken met radiotherapie door uitwendige bestraling kan de behandeltijd met brachytherapie worden bekort en worden zorgverleners aan minder straling blootgesteld.[77]
Preventieve schedelbestraling is een vorm van radiotherapie voor de hersenen die wordt gebruikt om het risico op metastasering te verkleinen. Preventieve schedelbestraling is bijzonder nuttig bij kleincellige longkanker. In het beperkte stadium van de ziekte verhoogt deze bestraling de 3-jaarsoverleving van 15% tot 20%; in het uitgebreide stadium neemt de 1-jaarsoverleving toe van 13% tot 27%.[78]
Recente verbeteringen in precisie en in beeldvorming hebben geleid tot de ontwikkeling van stereotactische bestraling bij de behandeling van longkanker in een vroeg stadium. Bij deze vorm van radiotherapie worden in een klein aantal sessies hoge doses toegediend met behulp van doelgerichte stereotactische technieken. Deze therapie wordt vooral gebruikt bij patiënten voor wie chirurgie geen optie is vanwege medische comorbiditeiten.[79]
Zowel bij patiënten met niet-kleincellige als kleincellige lonkanker kunnen kleinere doses straling van de borstkas worden gebruik voor het in bedwang houden van symptomen (palliatieve radiotherapie).[80]
Chemotherapie[bewerken | brontekst bewerken]
Behandeling met chemotherapie is afhankelijk van het type van de tumor.[8]
Niet-kleincellig longkanker Bij patiënten met een niet-kleincellig longkanker stadium II-IIIA en een goede lichamelijke conditie kan, voorafgaand aan chirurgie, chemotherapie gegeven worden (adjuvante chemotherapie). Adjuvante chemotherapie is het gebruik van chemotherapie samen met een andere behandeling zoals chirurgie, met als doel de kans op een goede afloop te bevorderen. Vaak wordt er dan gekozen voor een chemotherapie combinatie met cisplatine.[81][82] Bij het niet-kleincellige longkanker worden tijdens de operatie biopsies genomen van nabijgelegen lymfeklieren als hulp bij de stadiëring van longkanker. Als de ziekte in stadium II of III is, verbetert adjuvante chemotherapie de kans op overleving na 5 jaar met 5%.[83][84]
Kleincellig longkanker Voor patiënten met stadium I-II kleincellig longkanker is chirurgische behandeling te overwegen. Adjuvante behandeling met chemotherapie en profylactische hersenbestraling geadviseerd om uitzaaiingen naar de hersenen te voorkomen, maar de wetenschappelijke onderbouwing is beperkt. [85] Voor patiënten met kleincellig longkanker met uitgebreide ziekte en een goede lichamelijke conditie kan chemotherapie worden aanbevolen. Dit vertraagd de ziekte en kan eventueel levensverlengend werken. De voorkeur gaat dan uit naar cisplatine of carboplatine gecombineerd met etoposide.[86]
Palliatieve zorg[bewerken | brontekst bewerken]
Voor mensen met ziekte in het eindstadium kan palliatieve zorg of stervensbegeleiding toepasselijk zijn.[15] Met deze benaderingen is ruimer overleg mogelijk over behandelopties, kunnen er weloverwogen beslissingen worden genomen[87][88] en kan zinloze en vaak dure zorg aan het einde van het leven worden vermeden.[88]
Bij de behandeling van niet-kleincellig longkanker kan chemotherapie worden gecombineerd met palliatieve zorg. In vergevorderde stadia van kanker biedt correct gebruik van chemotherapie een betere mediane overlevingsduur dan alleen ondersteunende zorg en verbetert het ook de kwaliteit van het leven.[89] Bij een goede lichamelijke conditie biedt voortzetting van chemotherapie als palliatieve behandeling van longkanker 1,5 tot 3 maanden verlenging van de levensduur, verlichting van symptomen en een verbetering van de levenskwaliteit, waarbij moderne middelen betere resultaten opleveren.[90][91] De NSCLC Meta-Analyses Collaborative Group beveelt aan chemotherapie te overwegen bij patiënten met niet-kleincellig longkanker in een gevorderd stadium als de ontvanger dat wil en hij of zij de behandeling kan verdragen.[92][93]
Prognose[bewerken | brontekst bewerken]
| Klinisch stadium | 5-jaars overleving (%) | |
|---|---|---|
| Niet-kleincellig longcarcinoom | Kleincellig longcarcinoom | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Op het moment dat de diagnose longkanker wordt gesteld, is de ziekte vaak al in een ver gevorderd stadium. Wanneer de ziekte zich uit, verkeert 30–40% van de patiënten met niet-kleincellige longkanker en 60% van de patiënten met kleincellige longkanker al in stadium IV.[8]Dit maakt dat de prognose meestal slecht is. Van alle mensen met longkanker is 15% vijf jaar na het stellen van de diagnose nog in leven.[2]
Factoren die van invloed zijn op de prognose bij niet-kleincellige longkanker zijn onder meer aan- of afwezigheid van longsymptomen, de grootte van de tumor, het celtype (histologie), de mate van verspreiding (stadium) en metastasen in meerdere lymfeklieren, en vaatingroei. Voor mensen die niet meer geopereerd kunnen worden (inoperabel) is het verloop het slechtst, wanneer er vooraf een slechte lichamelijke conditie was en ze al meer dan 10% gewichtsverlies hebben.[94] Factoren die een rol spelen bij de prognose van kleincellige longkanker zijn onder meer de lichamelijke conditie, het geslacht, het stadium van de ziekte en of het centrale zenuwstelsel of de lever al zijn aangetast op het moment dat de diagnose gesteld wordt.[95]
Bij het niet-kleincellige longkanker wordt de beste prognose verkregen wanneer de ziekte in stadium IA is en de kanker volledig operatief verwijderd wordt; hierbij is 70% van de patiënten na 5 jaar nog in leven.[96] Bij het kleincellige longkanker is de algehele 5-jaarsoverleving ongeveer 5%.[1] Van de patiënten met kleincellige longkanker in het uitgebreide stadium is minder dan 1% na 5 jaar nog in leven. De gemiddelde overlevingstijd bij de ziekte in het beperkte stadium is 20 maanden, met een 5-jaarsoverlevingspercentage van 20%.[2]
Volgens gegevens van het Amerikaanse National Cancer Institute is de mediane leeftijd waarop in de Verenigde Staten longkanker wordt geconstateerd 70 jaar,[97] en de mediane leeftijd bij overlijden 72 jaar.[98]
Epidemiologie[bewerken | brontekst bewerken]


Wereldwijd is longkanker de meest voorkomende vorm van kanker, zowel wat betreft incidentie als mortaliteit. In 2008 waren er 1,61 miljoen nieuwe gevallen en 1,38 miljoen doden door longkanker. De grootste aantallen zijn te vinden in Europa en Noord-Amerika. [11] In 2013 kregen 12110 mensen in Nederland longkanker. [100] Het deel van de bevolking met het grootste risico op longkanker zijn mensen ouder dan 50 jaar die hebben gerookt. In tegenstelling tot het sterftecijfer bij mannen, dat meer dan 20 jaar geleden begon te dalen, is het sterftecijfer voor longkanker bij vrouwen de laatste decennia gestegen en stabiliseert dit zich pas sinds kort.[101] In de Verenigde Staten hebben mannen 8% risico om in de loop van het leven longkanker te krijgen en vrouwen 6%.[1]
Voor iedere 3–4 miljoen sigaretten die worden gerookt, sterft één roker aan longkanker.[1][102] De tabaksindustrie heeft een grote invloed op rookgedrag.[103] Als jonge niet-rokers advertenties voor tabakswaren zien, is de kans groter dat ze ook gaan roken.[104] De rol van passief roken wordt in toenemende mate erkend als risicofactor voor longkanker,[25] wat leidt tot beleidsbeslissingen om ongewenste blootstelling van niet-rokers aan tabaksrook van anderen te beperken.[105] Uitstoot van auto's, fabrieken en energiecentrales zijn ook mogelijke risico's.[6]
Oost-Europa heeft de grootste sterfte aan longkanker onder mannen, terwijl de sterfte onder vrouwen in Noord-Europa en de Verenigde Staten het grootst is. In de Verenigde Staten is de sterfte onder zwarte mannen en vrouwen hoger.[106] In ontwikkelingslanden zijn de cijfers voor longkanker op dit moment lager.[107] Naarmate het roken in deze landen toeneemt, wordt verwacht dat deze cijfers binnen enkele jaren zullen stijgen, vooral in China[108] en India.[109]
Sinds de zestiger jaren van de vorige eeuw is het aantal adenocarcinomen van de longen ten opzichte van andere soorten longkanker gestegen. Dit is gedeeltelijk te wijten aan de introductie van filtersigaretten. Filters verwijderen de grotere deeltjes uit tabaksrook, zodat de aanslag in de grotere luchtwegen afneemt. De roker moet echter dieper inhaleren om dezelfde hoeveelheid nicotine binnen te krijgen, zodat de aanslag in de kleinere luchtwegen toeneemt, de plaats waar adenocarcinomen doorgaans ontstaan.[110] Het aantal gevallen van adenocarcinoom in de longen blijft stijgen.[111]
Geschiedenis[bewerken | brontekst bewerken]
Longkanker kwam weinig voor voordat de mens sigaretten ging roken; tot 1761 werd het niet eens gezien als afzonderlijke ziekte.[112] In 1810 werden verschillende aspecten van longkanker nader beschreven.[113]Kwaadaardige longtumoren vormden slechts 1% van alle gevallen van kanker die in 1878 bij secties werden gezien, maar aan het begin van de twintigste eeuw was dit gestegen tot 10–15%.[114] In 1912 werden slechts 374 gevallen wereldwijd in de medische literatuur vermeld,[115] maar uit onderzoek van sectierapporten bleek dat het percentage nieuwe gevallen van longkanker was toegenomen van 0,3% in 1852 tot 5,66% in 1952.[116] In Duitsland ontdekte de arts Fritz Lickint in 1929 het verband tussen roken en longkanker,[114] wat leidde tot een agressieve anti-tabakbeweging in nazi-Duitsland|antirookcampagne.[117] De British Doctors Study, die in de jaren '50 werd gepubliceerd, was het eerste betrouwbare epidemiologische bewijs van het verband tussen longkanker en roken.[118] Naar aanleiding daarvan beval de directeur-generaal van de volksgezondheid in de Verenigde Staten rokers in 1964 aan te stoppen met roken.[119]
Het verband met radongas werd voor het eerst opgemerkt onder mijnwerkers in het Ertsgebergte nabij Schneeberg in het Duitse Saksen. Daar werd al sinds 1470 zilver gewonnen en de mijnen waren er rijk aan uranium, dat vergezeld gaat van radium en radongas.[120] De mijnwerkers kregen onevenredig vaak longziekten, die uiteindelijk in de jaren 1870 werden herkend als longkanker.[121] Ondanks deze ontdekking werd de mijnbouw voortgezet tot in de jaren '50 omdat er in de USSR vraag was naar uranium.[120] In de jaren '60 werd bevestigd dat radon een oorzaak is van longkanker.[122]
De eerste succesvolle pneumonectomie in verband met longkanker werd uitgevoerd in 1933.[123] Palliatieve radiotherapie wordt gebruikt sinds de jaren '40.[124] Radicale radiotherapie, waarmee werd begonnen in de jaren '50, was een poging om grotere doses straling toe te dienen aan patiënten met een relatief vroeg stadium van longkanker die niet in aanmerking kwamen voor chirurgie.[125] In 1997 werd continue gehyperfractioneerde versnelde radiotherapie beschouwd als een verbetering ten opzichte van conventionele radicale radiotherapie.[126] Voor kleincellig longkanker bleven de eerste pogingen in de jaren '60 met chirurgische verwijdering[127] en radicale radiotherapie[128] zonder succes. In de jaren '70 werden succesvolle behandelwijzen met chemotherapie ontwikkeld.[129]
Referenties[bewerken | brontekst bewerken]
- ↑ a b c d e f g h i j k l m n o p q r s t u v Horn, L (2012). Harrison's Principles of Internal Medicine, 18th. McGraw-Hill, "Chapter 89". ISBN 0-07-174889-X.
- ↑ a b c d Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition, Online edition. Geraadpleegd op 15 August 2007.
- ↑ (September 2008). Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies. PLoS Medicine 5 (9): e185. PMID 18788891. PMC 2531137. DOI: 10.1371/journal.pmed.0050185.
- ↑ Carmona, RH, The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General. U.S. Department of Health and Human Services (27 June 2006). "Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke." Retrieved 2014-06-16
- ↑ (2002). Tobacco Smoke and Involuntary Smoking (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 83 (WHO International Agency for Research on Cancer). “There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).”.
- ↑ a b c d e f Alberg AJ, Samet JM (2010). Murray & Nadel's Textbook of Respiratory Medicine, 5th. Saunders Elsevier, "Chapter 46". ISBN 978-1-4160-4710-0.
- ↑ a b O'Reilly, KM, Mclaughlin AM, Beckett WS (March 2007). Asbestos-related lung disease. American Family Physician 75 (5): 683–688. PMID 17375514.
- ↑ a b c d e f g h i Lu, C, Onn A, Vaporciyan AA et al. (2010). Holland-Frei Cancer Medicine, 8th. People's Medical Publishing House, "78: Cancer of the Lung". ISBN 9781607950141.
- ↑ Chapman, S, Robinson G, Stradling J, West S (2009). Oxford Handbook of Respiratory Medicine, 2nd. Oxford University Press, "Chapter 31". ISBN 9-780199-545162.
- ↑ Nationaal kompas: Wat is longkanker en wat is het beloop?, geraadpleegd op 22-7-2015.
- ↑ a b Ferlay, J, Shin HR, Bray F et al. (December 2010). Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International Journal of Cancer 127 (12): 2893–2917. PMID 21351269. DOI: 10.1002/ijc.25516.
- ↑ Honnorat, J, Antoine JC (May 2007). Paraneoplastic neurological syndromes. Orphanet Journal of Rare Diseases 2 (1) (BioMed Central). PMID 17480225. PMC 1868710. DOI: 10.1186/1750-1172-2-22.
- ↑ a b c Brown, KM, Keats JJ, Sekulic A et al. (2010). Holland-Frei Cancer Medicine, 8th. People's Medical Publishing House USA, "8". ISBN 978-1607950141.
- ↑ Greene, Frederick L. (2002). AJCC cancer staging manual. Springer-Verlag, Berlin. ISBN 0-387-95271-3.
- ↑ a b c d e Collins, LG, Haines C, Perkel R (January 2007). Lung cancer: diagnosis and management. American Family Physician 75 (1): 56–63 (American Academy of Family Physicians). PMID 17225705.
- ↑ (1998). European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel. CA Cancer J Clin 48 (3): 167–176; discussion 164–166 (Smoking is the major risk factor, accounting for about 90% of lung cancer incidence.). PMID 9594919. DOI: 10.3322/canjclin.48.3.167.
- ↑ Hecht, SS (2012). Lung carcinogenesis by tobacco smoke. International Journal of Cancer 131 (12): 2724–2732. PMID 22945513. PMC 3479369. DOI: 10.1002/ijc.27816.
- ↑ Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press (2006). ISBN 0-19-262535-7.
- ↑ Proctor, RN (March 2012). The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. Tobacco Control 21 (2): 87–91. PMID 22345227. DOI: 10.1136/tobaccocontrol-2011-050338.
- ↑ California Environmental Protection Agency (1997). Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency. Tobacco Control 6 (4): 346–353. PMID 9583639. PMC 1759599. DOI: 10.1136/tc.6.4.346.
* Centers for Disease Control and Prevention (CDC)CDC (December 2001). State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000. Morbidity and Mortality Weekly Report 50 (49): 1101–1106 (CDC: Atlanta, Georgia). PMID 11794619. - ↑ a b c d Alberg, AJ, Samet JM (September 2007). Epidemiology of lung cancer. Chest 132 (S3): 29S–55S (American College of Chest Physicians). PMID 17873159. DOI: 10.1378/chest.07-1347.
- ↑ Jaakkola, MS, Jaakkola JJ (August 2006). Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention. European Respiratory Journal 28 (2): 397–408. PMID 16880370. DOI: 10.1183/09031936.06.00001306.
- ↑ Parkin, DM (December 2011). Tobacco—attributable cancer burden in the UK in 2010. British Journal of Cancer 105 (Suppl. 2): S6–S13. PMID 22158323. PMC 3252064. DOI: 10.1038/bjc.2011.475.
- ↑ [The Health Effects of Passive Smoking: a Scientific Information Paper. National Health and Medical Research Council. Canberra (Australia): National Health and Medical Research Council; 1997. Working Party. NHMRC]
- ↑ a b Taylor, R, Najafi F, Dobson A (October 2007). Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. International Journal of Epidemiology 36 (5): 1048–1059. PMID 17690135. DOI: 10.1093/ije/dym158.
- ↑ Frequently asked questions about second hand smoke. World Health Organization. Geraadpleegd op 25 July 2012.
- ↑ Schick, S, Glantz S (December 2005). Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke. Tobacco Control 14 (6): 396–404. PMID 16319363. PMC 1748121. DOI: 10.1136/tc.2005.011288.
- ↑ Schmid K, Kuwert T, Drexler H (March 2010). Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine. Dtsch Arztebl Int 107 (11): 181–6. PMID 20386676. PMC 2853156. DOI: 10.3238/arztebl.2010.0181.
- ↑ EPA radon
- ↑ Oncologie Spil, J. (2013). Mesothelioom. In Oncologie: Handboek voor verpleegkundigen en andere hulpverleners (2e, herz. dr. ed.). Houten: Bohn Stafleu van Loghum.
- ↑ Davies, RJO, Lee YCG (2010). Oxford Textbook Medicine, 5th. OUP Oxford, "18.19.3". ISBN 978-0199204854.
- ↑ Lim, WY, Seow, A (2012 Jan). Biomass fuels and lung cancer.. Respirology (Carlton, Vic.) 17 (1): 20-31. PMID 22008241.
- ↑ Sood, A (2012 Dec). Indoor fuel exposure and the lung in both developing and developed countries: an update.. Clinics in chest medicine 33 (4): 649-65. PMID 23153607.
- ↑ Dudley, Joel (2013). Exploring Personal Genomics. Oxford University Press, p. 25. ISBN 9780199644483.
- ↑ Kern JA, McLennan G (2008). Fishman's Pulmonary Diseases and Disorders, 4th. McGraw-Hill, p. 1802. ISBN 0-07-145739-9.
- ↑ Cogliano, VJ, Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP (21 december 2011). Preventable exposures associated with human cancers.. Journal of the National Cancer Institute 103 (24): 1827-39. PMID 22158127.
- ↑ Yang, IA, Holloway, JW, Fong, KM (October 2013). Genetic susceptibility to lung cancer and co-morbidities. Journal of Thoracic Disease 5 (Suppl. 5): S454–S462. PMID 24163739. PMC 3804872. DOI: 10.3978/j.issn.2072-1439.2013.08.06.
- ↑ Miller, WT (2008). Fishman's Pulmonary Diseases and Disorders, 4th. McGraw-Hill, p. 486. ISBN 0-07-145739-9.
- ↑ Kaiser, LR (2008). Fishman's Pulmonary Diseases and Disorders, 4th. McGraw-Hill, 1815–1816. ISBN 0-07-145739-9.
- ↑ Kumar, V (2013). Robbins Basic Pathology, 9th. Elsevier Saunders, "12", pp. 505. ISBN 978-1-4377-1781-5.
- ↑ Subramanian, J, Govindan R (February 2007). Lung cancer in never smokers: a review. Journal of Clinical Oncology 25 (5): 561–570 (American Society of Clinical Oncology). PMID 17290066. DOI: 10.1200/JCO.2006.06.8015.
- ↑ Raz, DJ, He B, Rosell R (March 2006). Bronchioloalveolar carcinoma: a review. Clinical Lung Cancer 7 (5): 313–322. PMID 16640802. DOI: 10.3816/CLC.2006.n.012.
- ↑ (March 2006). Small cell lung cancer. Annals of Oncology 17 (Suppl. 2): 5–10. PMID 16608983. DOI: 10.1093/annonc/mdj910.
- ↑ Maitra, A, Kumar V (2007). Robbins Basic Pathology, 8th. Saunders Elsevier, 528–529. ISBN 978-1-4160-2973-1.
- ↑ (1 March 2001). Atypical pulmonary metastases: spectrum of radiologic findings. Radiographics 21 (2): 403–417. PMID 11259704. DOI: 10.1148/radiographics.21.2.g01mr17403.
- ↑ Tan D, Zander DS (2008). Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update. Int J Clin Exp Pathol 1 (1): 19–31. PMID 18784820. PMC 2480532.
- ↑ a b c Rami-Porta, R, Crowley JJ, Goldstraw P (February 2009). The revised TNM staging system for lung cancer. Annals of Thoracic and Cardiovascular Surgery 15 (1): 4–9. PMID 19262443.
- ↑ Chheang, S, Brown K (June 2013). Lung cancer staging: clinical and radiologic perspectives. Seminars in Interventional Radiology 30 (2): 99–113. PMID 24436525. PMC 3709937. DOI: 10.1055/s-0033-1342950.
- ↑ Goodman, GE (November 2002). Lung cancer. 1: prevention of lung cancer. Thorax 57 (11): 994–999. PMID 12403886. PMC 1746232.
- ↑ McNabola, A, Gill LW (February 2009). The control of environmental tobacco smoke: a policy review. International Journal of Environmental Research and Public Health 6 (2): 741–758. PMID 19440413. PMC 2672352. DOI: 10.3390/ijerph6020741.
- ↑ Pandey, G, "Bhutan's smokers face public ban", BBC, February 2005. Geraadpleegd op 7 september 2007.
- ↑ Pandey, G, "Indian ban on smoking in public", BBC, 2 October 2008. Geraadpleegd op 25 april 2012.
- ↑ United Nations News service (30 May 2008). UN health agency calls for total ban on tobacco advertising to protect young. Persbericht.
- ↑ a b c Fabricius, P, Lange P (July–September 2003). Diet and lung cancer. Monaldi Archives for Chest Disease 59 (3): 207–211. PMID 15065316.
- ↑ Fritz, H, Kennedy D, Fergusson D et al. (2011). . PLoS ONE 6 (6). PMID 21738614. PMC 3124481. DOI: 10.1371/journal.pone.0021107.
- ↑ Herr, C, Greulich T, Koczulla RA et al. (March 2011). The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. Respiratory Research 12 (1). PMID 21418564. PMC 3071319. DOI: 10.1186/1465-9921-12-31.
- ↑ a b Key, TJ (January 2011). Fruit and vegetables and cancer risk. British Journal of Cancer 104 (1): 6–11. PMID 21119663. PMC 3039795. DOI: 10.1038/sj.bjc.6606032.
- ↑ Manser, RL, Irving LB, Stone C et al. (2004). Screening for lung cancer. Cochrane Database of Systematic Reviews (1): CD001991. PMID 14973979. DOI: 10.1002/14651858.CD001991.pub2.
- ↑ Jaklitsch, MT, Jacobson FL, Austin JH et al. (July 2012). The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. Journal of Thoracic and Cardiovascular Surgery 144 (1): 33–38. PMID 22710039. DOI: 10.1016/j.jtcvs.2012.05.060.
- ↑ Bach, PB, Mirkin JN, Oliver TK et al. (June 2012). Benefits and harms of CT screening for lung cancer: a systematic review. JAMA: the Journal of the American Medical Association 307 (22): 2418–2429. PMID 22610500. DOI: 10.1001/jama.2012.5521.
- ↑ Boiselle, PM (2013 Mar 20). Computed tomography screening for lung cancer.. JAMA : the journal of the American Medical Association 309 (11): 1163-70. PMID 23512063.
- ↑ Bach PB, Mirkin JN, Oliver TK, et al. (June 2012). Benefits and harms of CT screening for lung cancer: a systematic review. JAMA 307 (22): 2418–29. PMID 22610500. DOI: 10.1001/jama.2012.5521.
- ↑ Aberle, DR, Abtin, F; Brown, K (2013 Mar 10). Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial.. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 31 (8): 1002-8. PMID 23401434.
- ↑ Ferrell, B, Koczywas M, Grannis F, Harrington A (April 2011). Palliative care in lung cancer. Surgical Clinics of North America 91 (2): 403–417. PMID 21419260. DOI: 10.1016/j.suc.2010.12.003.
- ↑ Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders, 4th. McGraw-Hill, 1853–1854. ISBN 0-07-145739-9.
- ↑ a b Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders, 4th. McGraw-Hill, 1855–1856. ISBN 0-07-145739-9.
- ↑ Odell, DD, Kent MS, Fernando HC (Spring 2010). Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer. Seminars in Thoracic and Cardiovascular Surgery 22 (1): 32–37. PMID 20813314. DOI: 10.1053/j.semtcvs.2010.04.003.
- ↑ Alam, N, Flores RM (July–September 2007). Video-assisted thoracic surgery (VATS) lobectomy: the evidence base. Journal of the Society of Laparoendoscopic Surgeons 11 (3): 368–374. PMID 17931521. PMC 3015831.
- ↑ Rueth, NM, Andrade RS (June 2010). Is VATS lobectomy better: perioperatively, biologically and oncologically?. Annals of Thoracic Surgery 89 (6): S2107–S2111. PMID 20493991. DOI: 10.1016/j.athoracsur.2010.03.020.
- ↑ Simon GR, Turrisi A (September 2007). Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 132 (3 Suppl): 324S–339S. PMID 17873178. DOI: 10.1378/chest.07-1385.
- ↑ Goldstein, SD, Yang SC (October 2011). Role of surgery in small cell lung cancer. Surgical Oncology Clinics of North America 20 (4): 769–777. PMID 21986271. DOI: 10.1016/j.soc.2011.08.001.
- ↑ Arriagada, R (2002). Oxford Textbook of Oncology, 2nd. Oxford University Press, p. 2094. ISBN 0-19-262926-3.
- ↑ Hatton, MQ, Martin JE (June 2010). Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions. Clinical Oncology (Royal College of Radiologists) 22 (5): 356–364. PMID 20399629. DOI: 10.1016/j.clon.2010.03.010.
- ↑ PORT Meta-analysis Trialists Group (2005). Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews (2): CD002142. PMID 15846628. DOI: 10.1002/14651858.CD002142.pub2.
- ↑ Le Péchoux, C (2011). Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. Oncologist 16 (5): 672–681. PMID 21378080. PMC 3228187. DOI: 10.1634/theoncologist.2010-0150.
- ↑ Cardona, AF, Reveiz L, Ospina EG et al. (April 2008). Palliative endobronchial brachytherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews (2): CD004284. PMID 18425900. DOI: 10.1002/14651858.CD004284.pub2.
- ↑ Ikushima, H (February 2010). Radiation therapy: state of the art and the future. Journal of Medical Investigation 57 (1–2): 1–11. PMID 20299738.
- ↑ Paumier, A, Cuenca X, Le Péchoux C (June 2011). Prophylactic cranial irradiation in lung cancer. Cancer Treatment Reviews 37 (4): 261–265. PMID 20934256. DOI: 10.1016/j.ctrv.2010.08.009.
- ↑ Girard, N, Mornex F (October 2011). Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update. Cancer Radiothérapie 15 (6–7): 522–526. PMID 21889901. DOI: 10.1016/j.canrad.2011.07.241.
- ↑ Fairchild, A, Harris K, Barnes E et al. (August 2008). Palliative thoracic radiotherapy for lung cancer: a systematic review. Journal of Clinical Oncology 26 (24): 4001–4011. PMID 18711191. DOI: 10.1200/JCO.2007.15.3312.
- ↑ heelkunde.nl, Integraal Kankercentrum Nederland (IKNL) 2011 richtlijn "niet kleincellig longcarcinoom".
- ↑ NSCLC Meta-analysis Collaborative, Group (May 3, 2014). Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data.. Lancet 383 (9928): 1561–71. PMID 24576776. PMC 4022989. DOI: 10.1016/S0140-6736(13)62159-5.
- ↑ Carbone, DP, Felip E (September 2011). Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms. Clinical Lung Cancer 12 (5): 261–271. PMID 21831720. DOI: 10.1016/j.cllc.2011.06.002.
- ↑ Le Chevalier, T (October 2010). Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. Annals of Oncology 21 (Suppl. 7): vii196–198. PMID 20943614. DOI: 10.1093/annonc/mdq376.
- ↑ Oncolone.nl, oncoline SCLC.
- ↑ Oncoline.nl,geraadpleegd op 28-09-2015.
- ↑ Kelley AS, Meier DE (August 2010). Palliative care—a shifting paradigm. New England Journal of Medicine 363 (8): 781–2. PMID 20818881. DOI: 10.1056/NEJMe1004139.
- ↑ a b Prince-Paul M (April 2009). When hospice is the best option: an opportunity to redefine goals. Oncology (Williston Park, N.Y.) 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592.
- ↑ Souquet PJ, Chauvin F, Boissel JP, Bernard JP (April 1995). Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer. Lung Cancer 12 Suppl 1: S147–54. PMID 7551923. DOI: 10.1016/0169-5002(95)00430-9.
- ↑ Sörenson S, Glimelius B, Nygren P (2001). A systematic overview of chemotherapy effects in non-small cell lung cancer. Acta Oncol 40 (2–3): 327–39. PMID 11441939.
- ↑ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N (2001). A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer. Health Technol Assess 5 (32): 1–195. PMID 12065068.
- ↑ NSCLC Meta-Analyses Collaborative Group (October 2008). Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials. J. Clin. Oncol. 26 (28): 4617–25. PMID 18678835. PMC 2653127. DOI: 10.1200/JCO.2008.17.7162.
- ↑ {{cite Cochrane |title=Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer|review=CD007309 |version=2 |issue=5 |year=2010 |pmid=20464750|editor1-last=Burdett |editor1-first=Sarah |author1=Non-Small Cell Lung Cancer Collaborative Group }}
- ↑ Non-Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. Geraadpleegd op 22 november 2008.
- ↑ Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute (2012). Geraadpleegd op 16 May 2012.
- ↑ Spiro, SG (2010). Oxford Textbook Medicine, 5th. OUP Oxford, "18.19.1". ISBN 978-0199204854.
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ↑ WHO Disease and injury country estimates. World Health Organization (2009). Geraadpleegd op 11 november 2009.
- ↑ kanker.nl, cijfers over longkanker in Nederland 2013.
- ↑ Jemal A, Tiwari RC, Murray T, et al. (2004). Cancer statistics, 2004. CA: a Cancer Journal for Clinicians 54 (1): 8–29. PMID 14974761. DOI: 10.3322/canjclin.54.1.8.
- ↑ Proctor, RN (March 2012). The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. Tobacco Control 21 (2): 87–91. PMID 22345227. DOI: 10.1136/tobaccocontrol-2011-050338.
- ↑ Lum, KL, Polansky JR, Jackler RK (October 2008). Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951. Tobacco Control 17 (5): 313–323. PMID 18818225. PMC 2602591. DOI: 10.1136/tc.2008.025445.
- ↑ Lovato, C, Watts A, Stead LF (October 2011). Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours. Cochrane Database of Systematic Reviews (10): CD003439. PMID 21975739. DOI: 10.1002/14651858.CD003439.pub2.
- ↑ Kemp, FB (Jul–Sep 2009). Smoke free policies in Europe. An overview. Pneumologia 58 (3): 155–158. PMID 19817310.
- ↑ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010[1]
- ↑ Gender in lung cancer and smoking research (PDF). World Health Organization (2004). Geraadpleegd op 26 May 2007.
- ↑ Zhang, J, Ou JX, Bai CX (November 2011). Tobacco smoking in China: prevalence, disease burden, challenges and future strategies. Respirology 16 (8): 1165–1172. PMID 21910781. DOI: 10.1111/j.1440-1843.2011.02062.x.
- ↑ Behera, D, Balamugesh T (2004). Lung cancer in India (PDF). Indian Journal of Chest Diseases and Allied Sciences 46 (4): 269–281. PMID 15515828.
- ↑ (February 1997). The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma. International Journal of Epidemiology 26 (1): 14–23. PMID 9126499. DOI: 10.1093/ije/26.1.14.
- ↑ Kadara, H, Kabbout M, Wistuba II (January 2012). Pulmonary adenocarcinoma: a renewed entity in 2011. Respirology 17 (1): 50–65. PMID 22040022. DOI: 10.1111/j.1440-1843.2011.02095.x.
- ↑ Morgagni, Giovanni Battista (1761). De sedibus et causis morborum per anatomen indagatis.
- ↑ (fr) Bayle, Gaspard-Laurent (1810). Recherches sur la phthisie pulmonaire, Paris.
- ↑ a b Witschi, H (November 2001). A short history of lung cancer. Toxicological Sciences 64 (1): 4–6. PMID 11606795. DOI: 10.1093/toxsci/64.1.4.
- ↑ Adler, I (1912). Primary Malignant Growths of the Lungs and Bronchi. Longmans, Green, and Company, New York. , cited in Spiro SG, Silvestri GA (2005). One hundred years of lung cancer. American Journal of Respiratory and Critical Care Medicine 172 (5): 523–529. PMID 15961694. DOI: 10.1164/rccm.200504-531OE.
- ↑ Grannis, FW, History of cigarette smoking and lung cancer. smokinglungs.com. Gearchiveerd op 18 July 2007. Geraadpleegd op 6 August 2007.
- ↑ Proctor, R (2000). The Nazi War on Cancer. Princeton University Press, 173–246. ISBN 0-691-00196-0.
- ↑ Doll, R, Hill AB (November 1956). Lung Cancer and Other Causes of Death in Relation to Smoking. British Medical Journal 2 (5001): 1071–1081. PMID 13364389. PMC 2035864. DOI: 10.1136/bmj.2.5001.1071.
- ↑ US Department of Health Education and Welfare, Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service (PDF). US Government Printing Office (1964).
- ↑ a b Greaves, M (2000). Cancer: the Evolutionary Legacy. Oxford University Press, 196–197. ISBN 0-19-262835-6.
- ↑ Greenberg, M, Selikoff IJ (February 1993). Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879. Annals of Occupational Hygiene 37 (1): 5–14. PMID 8460878.
- ↑ Samet, JM (April 2011). Radiation and cancer risk: a continuing challenge for epidemiologists. Environmental Health 10 (Suppl. 1): S4. PMID 21489214. PMC 3073196. DOI: 10.1186/1476-069X-10-S1-S4.
- ↑ Horn, L, Johnson DH (July 2008). Evarts A. Graham and the first pneumonectomy for lung cancer. Journal of Clinical Oncology 26 (19): 3268–3275. PMID 18591561. DOI: 10.1200/JCO.2008.16.8260.
- ↑ Edwards, AT (1946). Carcinoma of the Bronchus. Thorax 1 (1): 1–25. PMID 20986395. PMC 1018207. DOI: 10.1136/thx.1.1.1.
- ↑ (de) Kabela, M (1956). Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses. Ceskoslovenská Onkológia 3 (2): 109–115. PMID 13383622.
- ↑ (July 1997). Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. Lancet 350 (9072): 161–165 (Elsevier). PMID 9250182. DOI: 10.1016/S0140-6736(97)06305-8.
- ↑ (November 1968). Results of resection for oat-cell carcinoma of the lung. Lancet 2 (7575): 925–927 (Elsevier). PMID 4176258. DOI: 10.1016/S0140-6736(68)91163-X.
- ↑ Miller, AB, Fox W, Tall R (September 1969). Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet 2 (7619): 501–505 (Elsevier). PMID 4184834. DOI: 10.1016/S0140-6736(69)90212-8.
- ↑ (1977). Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treatment Reports 61 (3): 349–354. PMID 194691.