Immuunsysteem

Het immuunsysteem is een complex netwerk waarin gespecialiseerde cellen en eiwitten samenwerken om een levend wezen te beschermen tegen ziekte en infectie. Het vormt een afweer tegen binnendringende ziekteverwekkers als bacteriën, virussen en parasieten. Het immuunsysteem herkent deze vreemde indringers en activeert verschillende mechanismen om hen te doden en op te ruimen.
Bijna alle levende wezens bezitten een vorm van afweer. Bacteriën hebben bijvoorbeeld een systeem van enzymen dat beschermt tegen virusinfecties. Vroeg in de evolutie van dieren ontstonden complexere mechanismen, zoals fagocytose waarbij een cel de indringer opeet. Gewervelde dieren, waaronder de mens, beschikken over nog verder verfijnde afweermechanismen die erop gericht zijn ziekteverwekkers heel precies te herkennen en te bestrijden.
De afweer van gewervelden bestaat globaal uit twee delen. Het eerste deel, dat aangeduid wordt als aangeboren immuunsysteem, vormt de eerste lijn van verdediging, die meteen in werking treedt om een infectie te voorkomen of binnen de perken te houden. Het tweede deel, het verworven immuunsysteem, is in staat ziekteverwekkers bij een volgende aanval te herkennen en af te weren, wat herhaling van de infectie voorkomt. Dit vermogen om een infectie te onthouden is de basis van vaccinatie.
Stoornissen in de afweer kunnen leiden tot ernstige aandoeningen. Wanneer het immuunsysteem onvoldoende functioneert, zoals bij immuundeficiënties, kunnen zich terugkerende en levensbedreigende infecties ontwikkelen. Dit is bijvoorbeeld het geval bij hiv/aids, erfelijke afwijkingen als SCID en bij het gebruik van afweeronderdrukkende middelen als prednison. Een overactieve afweer kan ertoe leiden dat het immuunsysteem de eigen weefsels aanvalt. Voorbeelden van dergelijke auto-immuunziekten zijn reumatoïde artritis, diabetes type 1 en multiple sclerose.
Overzicht
[bewerken | brontekst bewerken]Mensen, dieren en planten leven in een wereld vol micro-organismen: bacteriën, schimmels, parasieten en virussen. Hoewel de meeste van deze organismen geen schade toebrengen en ongemerkt samenleven met hun gastheer, zijn er veel soorten die het lichaam binnendringen en daar ziekte kunnen veroorzaken. Het immuunsysteem heeft de taak het lichaam te verdedigen tegen de mogelijke bedreigingen van deze ziekteverwekkers (pathogenen).
Het lichaam van dieren beschikt over fysieke barrières, zoals epitheelweefsels en slijmvliezen, die bacteriën en virussen normaal gesproken buitenhouden. Een ziekteverwekker die deze barrières toch doorbreekt, komt in aanraking met het aangeboren immuunsysteem, dat een onmiddellijke, maar aspecifieke respons in gang zet.[1] De ziekteverwekker wordt bijvoorbeeld door witte bloedcellen opgenomen en verteerd of middels een ontstekingsreactie in zijn groei geremd. Terwijl het aangeboren immuunsysteem de infectie onder controle probeert de houden, brengt deze (bij gewervelden) een tweede lijn van afweer op gang: het verworven immuunsysteem.[2]
De cellen van het verworven immuunsysteem bezitten speciale receptoren op hun membraan, waarmee zij op een uiterst specifieke manier ziekteverwekkers herkennen en daarop reageren. Na herkenning beginnen de cellen zich in hoog tempo te delen en te differentiëren, zodat de ziekteverwekker overal in het lichaam doeltreffend wordt bestreden, bijvoorbeeld via antilichamen of cytotoxische mechanismen.[2] Sommige cellen blijven na afloop nog lange tijd aanwezig in het bloed, teneinde herhaling van dezelfde infectie te voorkomen – een immunologisch geheugen.
| Aangeboren immuunsysteem | Verworven immuunsysteem |
|---|---|
| Reageert aspecifiek, werkt breed | Is gericht tegen een specifiek antigeen |
| Is voortdurend en overal in het lichaam aanwezig | Komt enkele dagen na infectie op gang |
| Werkt via fagocytose, ontsteking, defensinen | Werkt via antilichamen, cytotoxische T-cellen |
| Leidt niet tot geheugen | Leidt tot een immunologisch geheugen |
| Komt voor bij vrijwel alle vormen van leven | Komt voor bij alle hogere gewervelde dieren |
Immunologie is de wetenschap die zich bezighoudt met alle aspecten van het immuunsysteem. De moderne immunologie is voornamelijk gericht op het immuunsysteem van de mens – en daarmee die van andere gewervelde dieren – omdat de mechanismen van de menselijke afweer veruit het best zijn bestudeerd en ontrafeld. Hoewel ook ongewervelde dieren, planten en andere levensvormen complexe afweersystemen bezitten, is de kennis hierover relatief beperkt.[3][4] Zowel de aangeboren als de verworven afweer kennen ieder hun eigen vakgebied. Historisch gezien kent de immunologische wetenschap een belangrijke overlap met geneeskunde: veel aandacht gaat uit naar het verklaren van stoornissen van de afweer, hoe deze werken en te behandelen zijn.[5][6] Hoewel het immuunsysteem primair gericht is op de bestrijding van ziekteverwekkers, speelt het ook een grote rol bij de afweer tegen kankercellen.[7]
Fysieke barrières
[bewerken | brontekst bewerken]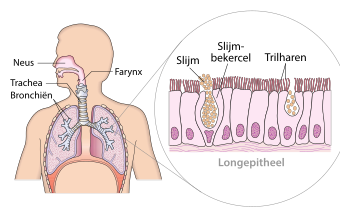
Het lichaam van gewervelde dieren wordt in eerste instantie beschermd tegen ziekteverwekkers door fysieke barrières, zoals de huid, het epitheelweefsel rondom organen (zoals die van de long- of darmwand) en de slijmvliezen. De dicht op elkaar liggende epitheelcellen zijn moeilijk te passeren voor micro-organismen. Bovendien maken de biochemische omstandigheden van de slijmvliezen – zoals de hoge zuurgraad van de maag en vetzuren op de huid – het lastig voor micro-organismen om op deze plaatsen te overleven.[8]
In de slijmvliezen en lichaamsvloeistoffen komen vele antimicrobiële stoffen voor die in belangrijke mate bijdragen aan de afweer tegen infecties. Sommige van deze stoffen kunnen micro-organismen direct doden, andere zorgen ervoor dat hun groei sterk vertraagd wordt, of ondersteunen de immuunrespons ertegen. Epitheelcellen van de huid en de luchtwegen produceren bijvoorbeeld kationische peptiden (defensinen) die zich aan de membranen van bacteriën en virussen hechten en deze ontwrichten.[9] Lysozymen in traanvocht splitsen de celwandcomponenten van bacteriën, en lactoferrinen in onder meer zweet en speeksel remmen de groei van pathogenen door ijzer weg te vangen.[8]
Op de huid en binnen de darmen komen van nature grote aantallen onschadelijke (en vaak nuttige) micro-organismen voor, het zogenaamde microbioom. Deze micro-organismen concurreren met lichaamsvreemde ziekteverwekkers om ruimte en voedingsstoffen. Sommige darmbacteriën produceren ook antimicrobiële verbindingen die direct de groei van pathogenen remmen.[10][11] Een achteruitgang van de darmflora, bijvoorbeeld bij gebruik van antibiotica, kan ertoe leiden dat pathogene bacteriën (zoals Clostridium) de darm vrijelijk koloniseren.[12]
Aangeboren immuunsysteem
[bewerken | brontekst bewerken]Wanneer een ziekteverwekker ergens het lichaam binnendringt, komt die als eerste in aanraking met het aangeboren immuunsysteem, dat in principe overal en altijd in het lichaam klaarligt om direct in actie te komen. Het aangeboren immuunsysteem wordt gevormd door een aantal verschillende celtypen en honderden verschillende eiwitmoleculen die aanwezig zijn in het bloedplasma en de weefselvloeistoffen. Aangeboren immuuncellen en eiwitten kunnen een indringer vrijwel direct (binnen enkele minuten tot uren) aanpakken en opruimen.
Herkenning
[bewerken | brontekst bewerken]De cellen van het aangeboren immuunsysteem zijn in staat binnengedrongen virussen, bacteriën en andere pathogenen te herkennen op hun algemene kenmerken. Herkenning vindt plaats door middel van patroonherkenningsreceptoren.[13] Deze receptoren binden zich aan moleculen die typisch zijn voor micro-organismen, zoals virale nucleïnezuren of bacteriële koolhydraten. Dergelijke molecuulpatronen worden in de immunologie aangeduid als PAMPs, pathogen-associated molecular patterns.[a] Omdat deze structuren nooit voorkomen op lichaamscellen, kunnen aangeboren immuuncellen lichaamsvreemde indringers onderscheiden van lichaamseigen bestanddelen.

Er bestaan diverse groepen patroonherkenningsreceptoren. Een van de belangrijkste zijn de Toll-like receptoren, die voorkomen bij zowel dieren als planten. Toll-like receptoren zijn grote, membraan-gebonden eiwitten die binding aangaan met (onderdelen van) diverse ziekteverwekkers, zoals lipopolysachariden, flagelline en bepaalde motieven in microbieel DNA.[14] Wanneer een Toll-like receptor in contact komt met een lichaamsvreemd deeltje, brengt het binnen de immuuncel een signaalroute op gang die uiteindelijk leidt tot de uitscheiding van signaalstoffen (cytokinen). De cytokinen alarmeren het immuunsysteem dat er een infectie gaande is.
Een andere grote familie van patroonherkenningsreceptoren zijn de Nod-like receptoren. Qua structuur lijken ze op Toll-like receptoren, maar ze komen uitsluitend voor in het cytoplasma, waar ze afbraakproducten van bacteriële peptidoglycanen detecteren.[15] Personen die een mutatie hebben in het gen voor Nod-like receptor 2 hebben een verhoogd risico op het ontwikkelen van de ziekte van Crohn, een chronische ontstekingsziekte van de dunne darm, die vermoedelijk veroorzaakt wordt door een bacteriële infectie.[16]
De meeste virussen worden gesignaleerd door RIG-I-like receptoren.[17] Dit zijn een groep herkenningseiwitten die eveneens in het cytoplasma gelokaliseerd zijn en zich binden aan dubbelstrengs RNA, een vorm van RNA die algemeen optreedt tijdens de replicatie van virussen, maar zelden bij het lichaamseigen RNA. RIG-I-like receptoren geven aanleiding tot een interferonrespons. Interferonen zijn kleine eiwitten die de replicatiecyclus van virussen verhinderen.[17]
Aangeboren immuuncellen
[bewerken | brontekst bewerken]
Tot de celtypen van het aangeboren immuunsysteem behoren macrofagen, neutrofielen, dendritische cellen en verschillende soorten granulocyten. Dit zijn allemaal witte bloedcellen die ziekteverwekkers snel herkennen en proberen te elimineren, meestal door ze in zich op te nemen en intracellulair te verteren (fagocytose).[18]
Macrofagen zijn langlevende witte bloedcellen die zich in de meeste weefsels van gewervelde dieren bevinden; het zijn vaak de eerste immuuncellen die in aanraking komen met binnendringende micro-organismen. Neutrofielen zijn kortlevende bloedcellen die in grote aantallen voorkomen in het bloed; ze worden snel gerekruteerd naar geïnfecteerd weefsel door signaalstofjes (chemokinen) die uitgescheiden worden door geactiveerde macrofagen.[19]
Macrofagen, dendritische cellen en neutrofielen zijn gespecialiseerd in het fagocyteren van ziekteverwekkers, en worden daarom ook wel professionele fagocyten genoemd. Deze cellen hebben receptoren op hun membraan die vreemde indringers herkennen, vastbinden, en vervolgens opnemen in een inwendig blaasje.[18] Binnen de cel wordt de opgenomen pathogeen blootgesteld aan een uitgebreid arsenaal van hydrolases, lysozymen en giftige peroxiden. Fagocytose is een van oudste vormen van afweer: het proces is wijdverspreid in het dierenrijk en komt ook voor bij diverse eencelligen als voedselvergaringsmethode.[20][21]
Granulocyten zijn witte bloedcellen die granulen in hun cytoplasma hebben. Tot deze groep behoren mestcellen, basofielen en eosinofielen. Mestcellen komen voor in slijmvliezen en reguleren ontstekingsreacties, onder meer door histamine af te geven.[22] Sommige meercellige parasieten, zoals ingewandswormen, zijn te groot om te worden gefagocyteerd. In zo'n geval zullen zich eosinofielen rond de indringer verzamelen. Deze scheiden defensines en andere schadelijke stoffen uit en geven giftige zuurstofradicalen vrij. Een dergelijke barrage is vaak genoeg om de parasiet te vernietigen.[19][23]
Tot slot kent de aangeboren afweer een celtype dat geïnfecteerde lichaamscellen en tumorcellen kan bestrijden. Dit celtype, de zogenaamde naturalkillercel (NK-cel), wordt naar het geïnfecteerde weefsel gerekruteerd door vrijkomende interferonen. De NK-cel vernietigt de zieke cel door een missing self-principe. Gezonde cellen worden genegeerd door NK-cellen doordat zij intacte zelf-antigenen op hun membraan presenteren, die de activiteit van de NK-cel tegenhouden. Zijn deze zelf-antigenen niet aanwezig – wat vaak het geval is in geïnfecteerde lichaamscellen en gemuteerde kankercellen – dan brengt de NK-cel apoptose (geprogrammeerde celdood) op gang in de zieke cel.[24] NK-cellen zijn in de belangstelling gekomen als een mogelijke immunotherapie tegen kanker.[25]

Ontsteking
[bewerken | brontekst bewerken]Wanneer de aangeboren immuuncellen een binnengedrongen ziekteverwekker op het spoor komen, slaan ze alarm en geven ze aanleiding tot een ontstekingsreactie. Tijdens een ontsteking worden extra cellen en eiwitten van het afweersysteem aangemaakt en gedirigeerd naar de infectiehaard om deze te bestrijden.[26] De ontsteking wordt gekenmerkt door vijf klassieke klinische symptomen: pijn, roodheid, warmte, zwelling en functieverlies. De bloedvaten rond de infectiehaard verwijden zich en worden doorlaatbaar voor eiwitten, wat leidt tot de lokale zwelling. De endotheelcellen langs de lokale bloedvaten brengen celadhesie-eiwitten tot expressie, die ervoor zorgen dat neutrofielen (en later ook lymfocyten) aan de vaatwand aanhechten en erdoorheen dringen naar het geïnfecteerde weefsel.[27][19]
Een ontsteking wordt geregeld door een breed scala aan signaalmoleculen (cytokinen). Cytokinen worden aangemaakt door immuuncellen wanneer zij met hun patroonherkenningsreceptoren lichaamsvreemd materiaal detecteren. De belangrijkste ontstekingsbevorderende cytokinen zijn tumornecrosefactor α (TNF-α), interferon-γ (IFN-γ), enkele chemokinen (stofjes die neutrofielen rekruteren) en verschillende interleukinen (met name IL-1, IL-6, IL-12 en IL-17).[26] Ook splitsingsproducten van het complementsysteem bevorderen de ontsteking. Wanneer een ontstekingsprikkel lange tijd aanhoudt, zoals bij een persisterende infectie of een auto-immuunziekte, kan de ontsteking een chronisch karakter krijgen. Aandoeningen als COPD, inflammatoire darmziekten en artrose zijn hiervan een vervelend gevolg.[28]
Complementsysteem
[bewerken | brontekst bewerken]In het bloed en de weefselvloeistoffen bevinden zich talloze eiwitten met antimicrobiële activiteit. De componenten van het complementsysteem zijn hiervan een belangrijk voorbeeld. Het complementsysteem bestaat uit ongeveer dertig op elkaar inwerkende oplosbare eiwitten, die inactief zijn totdat een infectie of een andere trigger ze activeert.[29] Ze werden ontdekt door hun vermogen om de werking van antilichamen 'aan te vullen' (te complementeren). Het complementsysteem bestaat uit een ingewikkeld, drieledig mechanisme[c] dat een stapsgewijze signaalcascade in gang zet. Uiteindelijk wordt in deze cascade het complement-eiwit C3 gesplitst in twee actieve fragmenten (C3a en C3b) die uiteenlopende functies hebben: aantrekken van ontstekingscellen, vergemakkelijken van fagocytose en stimuleren van de verworven afweer.[19] Bovendien kunnen sommige complement-eiwitten poriën vormen in het membraan van bacteriën, waardoor deze met water vollopen en uiteenvallen. Personen met een deficiëntie voor het C3-eiwit lijden vaak aan terugkerende bacteriële infecties.[30]
Verworven immuunsysteem
[bewerken | brontekst bewerken]Een enorme stap in de evolutie van afweermechanismen trad op toen de gewervelde dieren ontstonden, die een verworven immuunsysteem ontwikkelden. Het verworven immuunsysteem werkt uiterst specifiek: hieraan ontleent het dan ook zijn grote kracht. De verworven afweer hangt af van twee groepen witte bloedcellen, de T-lymfocyten en de B-lymfocyten, ook wel T-cellen en B-cellen genoemd. B-lymfocyten produceren antilichamen; dit zijn grote eiwitmoleculen die aan de bloedbaan worden afgegeven en zich specifiek binden aan het lichaamsvreemde stofje waartegen ze zijn gericht – het zogenaamde antigeen. Zo kan een antilichaam zich binden aan een extracellulair virus of microbieel toxine, waarna deze niet langer gastheercellen kunnen ingaan. T-lymfocyten daarentegen, detecteren ziekteverwekkers die zich binnen lichaamscellen verbergen. Ze kunnen de geïnfecteerde cel doden middels een cytotoxisch (celdodend) mechanisme, of de activiteit van fagocyten of B-cellen stimuleren om zo de infectie te helpen bestrijden. Hoewel het verworven immuunsysteem traag op gang komt, biedt het een langdurige, soms levenslange bescherming tegen een ziekteverwekker.
![Het verworven immuunsysteem wordt geactiveerd door fagocyten, veelal dendritische cellen.[31] Nadat een dendritische cel een pathogeen heeft gefagocyteerd, migreert deze naar een lymfeklier om daar fragmentjes van de pathogeen (de antigenen) aan T-lymfocyten te presenteren. De geactiveerde T-cellen delen zich snel. Een deel gaat naar de infectiehaard om deze te bestrijden. Andere T-cellen stimuleren B-cellen om antilichamen te produceren.](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a9/Adaptief_immuunsysteem.svg/550px-Adaptief_immuunsysteem.svg.png)
Antigenen
[bewerken | brontekst bewerken]De cellen van het verworven immuunsysteem herkennen specifieke details van pathogene micro-organismen, de zogenaamde antigenen. Bij hun ontdekking was van antigenen alleen bekend dat het stofjes waren die de aanmaak van antilichamen opwekken; ze kregen daarom de naam antibody generator (anti-gen).[32] Antigenen zijn doorgaans eiwitten op het oppervlak van een ziekteverwekker. Het spike-eiwit van coronavirussen is een notoir voorbeeld. Het kunnen ook polysachariden, lipiden of nucleïnezuren zijn. Sommige antigenen, zoals toxinen, worden door de ziekteverwekker uitgescheiden.

T- en B-lymfocyten hebben op hun membraan een unieke soort receptor: de T-celreceptor of B-celreceptor. Deze receptoren binden zich aan de antigenen die het lichaam zijn binnengedrongen. De binding van zo'n receptor op een antigeen is uiterst specifiek: zo specifiek, dat er zelfs onderscheid gemaakt kan worden tussen twee eiwitten die verschillen in slechts een enkel aminozuur, of twee vrijwel identieke optische isomeren. Op deze manier kan het verworven immuunsysteem elke ziekteverwekker herkennen en er specifiek op reageren, ook op nieuwe mutanten.
Het verworven immuunsysteem produceert miljoenen verschillende T- en B-celreceptoren. Iedere lymfocyt heeft één uniek type receptor op zijn membraan.[d] Tijdens de ontwikkeling van lymfocyten vinden er speciale genetische recombinaties plaats die zorgen voor een gigantische diversiteit aan antigeenreceptoren. Deze recombinaties, de zogenaamde V(D)J-recombinaties, maken mogelijk dat een mens ruim 1 miljoen B-celreceptoren kan maken, en meer dan 10 miljoen T-celreceptoren.
Tolerantie
[bewerken | brontekst bewerken]Omdat het genetische herschikkingsproces willekeurig is, ontstaan er zowel receptoren die kunnen binden aan lichaamsvreemde moleculen als receptoren die kunnen binden aan lichaamseigen moleculen. Gewervelde dieren hebben speciale mechanismen ontwikkeld die ervoor zorgen dat B- en T-cellen niet reageren tegen het eigen lichaam. Lymfocyten komen tijdens hun ontwikkeling in contact met lichaamseigen moleculen. Als ze een receptor hebben die aan een lichaamseigen antigeen bindt, zullen ze doodgaan door apoptose (klonale deletie). Zelfreactieve lymfocyten worden op deze manier weg geselecteerd.[33] De enkele zelfreactieve lymfocyten die aan dit mechanisme ontsnappen, worden vaak elders in het lichaam alsnog onderdrukt door regulatoire T-cellen.[34] Wanneer tolerantiemechanismen falen, worden er lymfocyten gemaakt die tegen de eigen cellen zijn gericht. Als gevolg hiervan kan een auto-immuunziekte ontstaan. In diabetes type 1 worden er bijvoorbeeld T-cellen gevormd tegen bètacellen in de pancreas, wat leidt tot een ernstig verstoorde insulineproductie.[35]
Cellulaire afweer
[bewerken | brontekst bewerken]Na hun ontwikkeling te hebben voltooid in de thymus, komen T-cellen in de bloedsomloop terecht. Ze circuleren door het bloed en de lymfevaten. In dit stadium worden ze naïeve T-cellen genoemd, omdat ze nog geen lichaamsvreemd antigeen zijn tegengekomen. Om deel te kunnen nemen aan de verworven immuunrespons, moet een naïeve T-cel eerst met zijn receptor een antigeen binden. De T-cel raakt dan geactiveerd, zal zich veelvuldig delen en differentiëren tot effectorcellen die kunnen bijdragen aan de bestrijding van de ziekteverwekker.
T-cellen worden geactiveerd door cellen van het aangeboren immuunsysteem, de zogenaamde antigeen-presenterende cellen. Dendritische cellen zijn veruit het belangrijkste antigeenpresenterende celtype in het lichaam. Nadat een dendritische cel een pathogeen op de plaats van infectie heeft gefagocyteerd, zal deze cel fragmentjes van de pathogeen (kleine peptiden) op zijn membraanoppervlak dragen. De cel is hiervoor uitgerust met speciale eiwitcomplexen die lichaamsvreemde peptiden kunnen binden, de MHC-eiwitten (MHC-II).[e] De dendritische cel circuleert rond de lymfeknopen en komt daarbij in contact met duizenden naïeve T-cellen. Wanneer de dendritische cel een T-cel tegenkomt die met hoge affiniteit aan het lichaamsvreemde antigeen bindt, krijgt de T-cel een signaal om zich vele malen te delen (klonale expansie). Zo ontstaan er duizenden identieke klonen van de cel met de juiste receptor. Sommige van de klonen differentiëren zich tot cytotoxische T-cellen, andere tot verschillende soorten helper-T-cellen.

Effector-T-cellen
[bewerken | brontekst bewerken]Cytotoxische T-cellen zijn gespecialiseerd in het herkennen van geïnfecteerde lichaamscellen, bijvoorbeeld cellen van de luchtwegen die een virus of andere intracellulaire pathogeen in zich dragen. Cytotoxische T-cellen kunnen de geïnfecteerde cel doden voordat de pathogeen zich verspreid naar naburige cellen. De herkenning van een geïnfecteerde lichaamscel gebeurt, net als bij antigeenpresentatie, door middel van een MHC-eiwit (MHC-I). Vrijwel alle cellen in het lichaam brengen MHC-I tot expressie. Wanneer er een infectie plaatsvindt, zal de cel peptiden van de pathogeen op zijn membraan presenteren via MHC-I. Langskomende cytotoxische T-cellen herkennen het lichaamsvreemde antigeen, en scheiden dan toxische eiwitten uit (perforines en granzymen) die de lichaamscel vernietigen.[36] Cytotoxische T-cellen zijn uitgerust met een co-receptor genaamd CD8, die de interactie met MHC-I stabiliseert.[37]

Helper-T-cellen zijn van groot belang voor het ondersteunen en sturen van de immuunrespons. Ze stimuleren zowel aangeboren als verworven immmuuncellen. Ze geven bijvoorbeeld macrofagen de kracht om efficiënter te fagocyteren; ze stimuleren B-cellen om over te gaan tot antilichaamproductie; en ze bevorderen de antigeenpresentatie tussen dendritische cellen en naïeve T-cellen. In alle gevallen vindt de ondersteuning plaats door de uitscheiding van cytokinen. Alle T-helpercellen bezitten CD4, een co-receptor die nodig is voor stabiele interactie met MHC-II tijdens antigeenpresentatie.[37]
Differentiatie tot helpercellen is complex. Globaal zijn er vijf richtingen te onderscheiden waarnaar helpercellen zich specialiseren: Th1-, Th2-, Tfh-, Th17- en regulatoire T-cellen.[f] Elk van deze helpercellen ondersteunt een uniek deel van het immuunsysteem, en elk maakt daarvoor speciale cytokinen aan. Regulatoire T-cellen temperen een opkomende immuunrespons door ontstekingsremmende cytokinen af te geven. Hiermee voorkomen ze een excessieve reactie die vaak schadelijk is voor het eigen lichaam.[39] De differentiatieroutes van helper-T-cellen zijn niet in steen gebeiteld; effector-T-cellen zijn plastisch en kunnen veranderen van het ene naar het andere celtype als dat nodig is.[38]
Humorale afweer
[bewerken | brontekst bewerken]De verworven afweer die door B-lymfocyten wordt verzorgd, noemt men de humorale afweer. Een B-celreceptor is een groot, Y-vormig eiwit dat opgebouwd is uit vier delen: twee identieke zware ketens en twee identieke lichte ketens. Een B-celreceptor heeft een hypervariabele regio waarin zich de antigeen-bindingsplaats bevindt. Nadat een antigeen een juiste B-celreceptor bindt, raakt de B-cel geactiveerd. De B-cel zal zich delen en differentiëren tot plasmacellen, de antilichaamproducenten van het lichaam. Voor de productie en sturing van antilichamen zijn helper-T-cellen essentieel: de B-cel krijgt zijn antigeen namelijk niet gepresenteerd via een dendritische cel, maar via een gespecialiseerde helper-T-cel.[40]

Een antilichaam, ook wel immunoglobuline (Ig) genoemd, is in wezen een uitgescheiden B-celreceptor. Het heeft, net als de receptor, een karakteristieke Y-vorm maar mist het membraandomein waardoor het loskomt van de plasmacel. De antilichamen komen in de bloedsomloop terecht en verspreiden zich gemakkelijk over alle weefselvloeistoffen van het lichaam. Zoogdieren vormen vijf klassen van antilichamen: IgA, IgD, IgE, IgG en IgM. De klassen onderscheiden zich door de bouw van hun zware ketens, die tevens de functionele eigenschappen van het antilichaam bepaalt.[41]
Antilichamen zorgen er op verschillende manieren voor dat een pathogeen wordt bestreden. Virussen en microbiële toxines zijn na binding van een antilichaam niet meer in staat om aan een gastheercel te hechten. Uitschakeling van virussen of toxines met behulp van antilichamen wordt neutralisatie genoemd. Het induceren van neutraliserende antilichamen is een belangrijk focuspunt bij de ontwikkeling van nieuwe vaccins.[42][43] Naast hun neutralisatiefunctie zorgen antilichamen er ook voor dat pathogenen sneller worden opgeruimd door het aangeboren immuunsysteem. Een antilichaam-beladen bacterie wordt bijvoorbeeld efficiënter gefagocyteerd (opsonisatie) en makkelijker vernietigd door het complementsysteem.[44]
Immuniteit en geheugen
[bewerken | brontekst bewerken]Als het lichaam een infectie heeft doorgemaakt en hiervan hersteld is, zijn er vele miljoenen antigeenspecifieke T-cellen en B-cellen aanwezig in de circulatie. Hoewel de meeste van deze lymfocyten na verloop van tijd verdwijnen, is er een subgroep die nog vele jaren aanwezig blijft: de geheugencellen.[45] Zij zetten een zeer snelle en efficiënte immuunrespons in gang wanneer dezelfde ziekteverwekker opnieuw het lichaam binnendringt. De respons is vaak zo efficiënt, dat schade door de ziekteverwekker ongemerkt binnen de perken wordt gehouden. Dit principe, het zogeheten immunologisch geheugen, is de basis van vaccinatie. Geheugencellen zorgen ervoor dat een individu beschermd of immuun is voor een ziekte die in het verleden is doorgemaakt. Voor sommige infectieziekten, zoals mazelen of waterpokken, is de bescherming levenslang. Voor snelmuterende pathogenen, zoals influenzavirussen, is de bescherming meestal vergankelijk.[46]

De geheugenrespons is relatief eenvoudig te bestuderen in diermodellen. Wanneer een proefdier geïmmuniseerd wordt met een antigeen, kan na enkele dagen een primaire immuunrespons worden gedetecteerd – gemeten aan de hoeveelheid en de soort antilichamen het bloed. Tijdens de primaire respons wordt eerst IgM gemaakt, en na ongeveer een week verschijnen er antilichamen van een andere klasse, IgG. Deze IgG-antilichamen hebben dezelfde specificiteit, maar zijn anders van grootte en kunnen daardoor op andere plaatsen in het lichaam terechtkomen.[g] Als het dier na enkele weken, maanden of zelfs jaren opnieuw wordt geïmmuniseerd met hetzelfde antigeen, zal een secundaire immuunrespons optreden die verschilt van de primaire respons: de opstartcurve is steiler, omdat er veel meer reeds aanwezige B- of T-cellen (geheugencellen) aanwezig zijn. Bovendien gaat de productie van antilichamen langer door en zal er een hogere antistoftiter bereikt worden. De secundaire respons kenmerkt zich door de snelle productie van vooral de IgG-klasse.[45]
Fysiologische regulatie
[bewerken | brontekst bewerken]Het immuunsysteem kent een nauwe verwevenheid met andere orgaansystemen in het lichaam. Voornamelijk het zenuwstelsel en endocrien systeem (hormoonstelsel) kunnen de immuunrespons afstemmen en reguleren. Fysiologische signalen als hormonen en neurotransmitters bepalen hoe snel en efficiënt het immuunsysteem op gang komt om infecties te bestrijden. Leefstijlvariabelen als slaap, beweging en voeding zijn belangrijke externe determinanten van de immuunfunctie.
Hormonen
[bewerken | brontekst bewerken]
Vrijwel alle immuuncellen bezitten hormoonreceptoren op hun membraan, en zijn gevoelig voor diverse endocriene signalen. Van geslachtshormonen is duidelijk dat ze een grote invloed uitoefenen op de immuunfunctie.[48][49] Oestrogenen, de vrouwelijke geslachtshormonen, hebben bijvoorbeeld een uitgesproken stimulerend effect op zowel aangeboren als verworven immuuncellen. Dit wordt geïllustreerd door de sterkere immuunrespons die vrouwen over het algemeen vertonen tegen infecties en door de grotere incidentie van auto-immuunziekten die ze kennen.[50] Mannelijke geslachtshormonen, zoals testosteron, lijken een remmende invloed te hebben op de afweer.[51] Het mechanisme hierachter is nog niet geheel opgehelderd. Ook andere hormonen, zoals groeihormonen, prolactine en vitamine D (een pro-hormoon) kunnen de immuunrespons sturen.
Slaap en voeding
[bewerken | brontekst bewerken]De werking van het menselijk immuunsysteem wordt in belangrijke mate beïnvloed door leefstijlfactoren als slaap, lichaamsbeweging en voeding. Er is nog veel onduidelijk over de manier waarop dergelijke externe factoren de aangeboren en verworven immuuncellen precies moduleren. Wel is helder dat de juiste leefgewoontes, zoals voldoende slaap en gezonde voeding, van wezenlijk belang zijn voor een robuuste en goed functionerende afweer.[52][53]
Veel processen van het immuunsysteem volgen een circadiaan ritme, wat suggereert dat ze nauw verbonden zijn met de slaap-waakcyclus. Dit ritme komt tot stand doordat de hoeveelheid cytokinen en andere signaalstoffen die worden afgegeven varieert met de tijd van de dag. Effectorcellen van de afweer, zoals NK-cellen of cytotoxische T-cellen, vertonen een piek in hun activiteit overdag: ze zijn dan hard bezig met de bestrijding van indringers die de gastheer gedurende de daguren tegenkomt.[52] Minder gedifferentieerde immuuncellen, zoals naïeve T-cellen of geheugencellen, hebben hun piek juist 's nachts. Onderzoeken in muismodellen laten zien dat er tijdens de nachtrust een sterkere interactie is tussen antigeenpresenterende cellen en (naïeve) T-cellen, en een hoger delingspotentieel van helper-T-cellen.[52] Langdurige slaaponthouding is bij de mens in verband gebracht met een verstoorde cytokineproductie, sluipende ontstekingswaarden in het bloed, en immuundeficiënties die resulteren in een hoger infectierisico.[54][55][56]
Een gezonde voeding is noodzakelijk om alle cellen van het lichaam optimaal te laten functioneren, ook die van het immuunsysteem. Sommige nutriënten uit voeding spelen een directe rol in de afweer: het aminozuur arginine is bijvoorbeeld nodig voor de aanmaak van stikstofmonoxide in macrofagen, en vitamine A en zink hebben een regulerende rol op de celdeling en zijn daarom van belang bij de proliferatie van lymfocyten.[53] Voedingsvezels kunnen invloed hebben op de immuunfunctie door in te spelen op het darm-microbioom. Darmbacteriën zijn namelijk op verschillende manieren in staat om het menselijk immuunsysteem te beïnvloeden.[h] De impact van voeding op immunologische aandoeningen (infectie, chronische ontstekingsziekten, allergieën) is – ondanks veel onderzoek – slechts beperkt in kaart gebracht.[58] Eenduidige voedingsadviezen om de weerstand te verbeteren zijn dan ook lastig te formuleren.
Stoornissen van het menselijk immuunsysteem
[bewerken | brontekst bewerken]Immuundeficiënties
[bewerken | brontekst bewerken]Het immuunsysteem werkt niet altijd perfect. Het kan bijvoorbeeld een aangeboren afwijking hebben, of in de loop van het leven minder goed gaan functioneren door tal van omstandigheden, variërend van medicijngebruik tot ondervoeding. Een tekortschietend immuunsysteem is gevaarlijk. Er bestaat immers een verhoogde gevoeligheid voor infecties, zelfs voor micro-organismen die gewoonlijk geen ziekte kunnen veroorzaken.[59] Men spreekt van opportunistische infecties.
Severe combined immunodeficiency (SCID) is een zeldzame aangeboren afwijking van het immuunsysteem. Kinderen die geboren worden met SCID hebben geen T- en B-lymfocyten in hun bloed, waardoor zij zich niet of nauwelijks kunnen verweren tegen micro-organismen. De oorzaak van SCID ligt in mutaties van receptoren op de lymfocyten.[60] Ook mensen die met een goed functionerend immuunsysteem worden geboren, kunnen later in hun leven te maken krijgen met een verminderde afweer. Misschien wel het sprekendste voorbeeld hiervan is infectie met het humaan immunodeficiëntievirus (hiv). Dit virus infecteert helper-T-cellen, waardoor de verworven afweer dermate ontregeld raakt dat zich levensbedreigende infecties en vormen van kanker kunnen ontwikkelen.[61][62]
Auto-immuunziekten
[bewerken | brontekst bewerken]
Onder normale omstandigheden wordt een immuunrespons tegen het eigen lichaam grotendeels voorkomen (en actief onderdrukt), door voorgenoemde tolerantiemechanismen als klonale deletie en de werking van regulerende immuuncellen.[63] Wanneer deze tolerantie faalt of doorbroken wordt, en er antilichamen of effector-T-cellen worden aangemaakt die tegen de eigen lichaamsbestanddelen actief zijn, kan dit aanleiding geven tot een auto-immuunziekte.[63]
Auto-immuunziekten kunnen vrijwel ieder orgaan treffen en de klinische symptomen lopen dan ook ver uiteen. Sommige auto-immuunziekten zijn orgaanspecifiek, zoals de huidziekte psoriasis. Andere hebben een systemisch karakter, zoals systemische lupus erythematodes (SLE), waarbij vrijwel elk deel van het lichaam kan worden aangedaan. Bij SLE worden er antilichamen gevormd tegen het eigen dubbelstrengse DNA. Een ziekte als SLE kan zeer ernstig en zelfs fataal verlopen indien niet tijdig de diagnose wordt gesteld en een behandeling wordt gestart.[64]
In veel geïndustrialiseerde landen zoals Nederland en België vormen reumatoïde artritis, de ziekte van Hashimoto en diabetes type 1 de top drie van auto-immuunziekten onder de bevolking.[65] Chronisch verlopende auto-immuunziekten zoals reumatoïde artritis, een steriele ontsteking van de gewrichtsvloeistof, of multipele sclerose, een immuunreactie tegen het myelineweefsel in het centraal zenuwstelsel, vormen een zware ziektelast voor de patiënt en zijn omgeving. Er zijn verschillende geneesmiddelen beschikbaar die de symptomen van auto-immuunziekten kunnen bestrijden of de ziekteprogressie ervan vertragen.[66] Slechts in zeldzame gevallen is complete genezing van een auto-immuunziekte realiseerbaar.
Allergie en overgevoeligheid
[bewerken | brontekst bewerken]
Het lichaam staat voortdurend bloot aan onschuldige prikkels van buitenaf, zoals huisstofmijten, voedingsbestanddelen en pollen. Normaal gesproken komt het immuunsysteem niet in actie tegen deze prikkels omdat tolerantiemechanismen voorkomen dat een reactie optreedt. Sommige individuen vertonen echter wél een hevige respons, vaak met nare lichamelijke klachten tot gevolg.[67] Een overmatige reactie op een onschuldige prikkel ligt ten grondslag aan een allergie. De bekendste manifestaties van allergieën zijn eczeem, voedselallergie (bijvoorbeeld voor gluten, noten of lactose), hooikoorts en astma.
Bij een allergische reactie spelen de cytokinen IL-4 en IL-5 een belangrijke rol. Deze cytokinen zetten onder andere B-lymfocyten aan tot de productie van IgE-antilichamen. IgE-antilichamen binden aan mestcellen, die daardoor krachtige ontstekingsmoleculen vrijgeven, zoals histaminen. Veel allergieremmende medicijnen zijn erop gericht de werking van histaminen te blokkeren, de antihistaminica.[68]
Vanaf het eind van de 20ste eeuw is het aantal mensen met een allergische ziekte sterk toegenomen, mogelijk als gevolg van toegenomen hygiëne en veranderingen in de omgeving.[69][70] Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) heeft alle aandoeningen waarbij het immuunsysteem betrokken is voor Nederland in kaart gebracht. Het blijkt, exclusief infectieziekten, om drie miljoen patiënten te gaan.[65]
Geneeskundige beïnvloeding
[bewerken | brontekst bewerken]Immunosuppressie
[bewerken | brontekst bewerken]
Soms vormt het immuunsysteem een lastige hinderpaal bij gewenst medisch handelen. Orgaantransplantaties en bloedtransfusies zijn in dit verband vermeldenswaard.[71] Het immuunsysteem herkent een getransplanteerd orgaan of weefsel als lichaamsvreemd, en zal het transplantaat proberen te vernietigen (afstoting). Transplantatiepatiënten zijn vaak levenslang afhankelijk van afweeronderdrukkende geneesmiddelen die het afstotingsproces beperken, de zogenaamde immuunsuppressiva.[72] Ook mensen die leiden aan chronische onstekingsziekten, auto-immuunziekten of ernstige allergieën kunnen worden behandeld met een immuunsuppressivum.
Belangrijke immuunsuppressiva zijn corticosteroïden, zoals prednison of dexamethason. Deze geneesmiddelen hebben een ontstekingsremmend effect, en kunnen bij hogere doseringen zelfs de gehele immuunrespons stilleggen.[71] Helaas onderdrukken de meeste immuunsuppressiva die tot dusver op de markt gebracht zijn niet alleen afstoting of een lokale ontsteking, maar alle immunologische reacties in het lichaam. Hierdoor hebben patiënten die onder langdurige behandeling zijn met immuunsuppressiva vaak een verhoogd risico op infecties en bepaalde vormen van kanker.[73]
Vaccinatie
[bewerken | brontekst bewerken]
Vaccinatie is de bekendste en een van de succesvolste toepassingen van immunologische principes in de gezondheidszorg. Het aantal besmettingen van veel kinderziekten waartegen wordt gevaccineerd, zoals de bof, mazelen en rodehond, is met ruim 95% teruggebracht en enkele ziekten, zoals pokken, zijn zelfs geheel uitgeroeid.[74][75] Vaccins zijn biofarmaceutische middelen die de antigenen van een ziekteverwekker bevatten, of deze in het lichaam aanmaken. Na toediening wordt er een actieve immuunrespons teweeggebracht, zonder dat er ziekteverschijnselen ontstaan. Na enkele dagen of weken heeft het geïmmuniseerde individu krachtige antilichamen en geheugencellen in de bloedsomloop, en is daarmee beschermd tegen een infectie met de daadwerkelijke ziekteverwekker.[76]
Voordat een nieuw vaccin op de markt gebracht wordt, moet de effectiviteit en veiligheid ervan in grootschalige klinische trials worden aangetoond. Eerst wordt in kleine groepen bekeken of het vaccin de gewenste immuunrespons opwekt. Vervolgens wordt in groepen van tienduizenden personen gekeken of het vaccin voldoende beschermt. Vaccinpreparaten worden ontwikkeld uit verzwakte of geïnactiveerde micro-organismen of onderdelen daarvan. Aan het vaccin wordt vaak een adjuvant toegevoegd, zoals aluminiumzouten. Adjuvantia verhogen de werkzaamheid van het vaccin door het antigeen te stabiliseren of costimulatoire signalen te induceren die de immuunrespons verder vooruithelpen.[76]
De toepassing van vaccins is breder dan alleen de preventie van infectieziekten. Vaccinatie wordt ook gebruikt bij de behandeling van allergieën en auto-immuunziekten. Het doel van deze vaccins is om de richting van de bestaande immuunrespons zodanig te sturen, dat verdere schade wordt voorkomen. Auto-immuunvaccins kunnen regulatoire T-cellen activeren om een respons tegen het eigen lichaam te onderdrukken, en allergievaccins kunnen een schadelijke IgE-respons ombuigen naar een onschadelijke IgG-respons.[77] Men spreekt in dit verband ook wel van immunotherapie.
Immunotherapie tegen kanker
[bewerken | brontekst bewerken]
Kankercellen kennen een complexe wisselwerking met het immuunsysteem. Het immuunsysteem is in staat om kankercellen in een vroeg stadium van hun ontwikkeling op te ruimen, een fenomeen genaamd immune surveillance.[78] Sommige kankercellen zijn zo hevig gemuteerd dat ze eiwitten tot expressie brengen die door de afweer voor lichaamsvreemd worden aangezien. Bij de immuunreactie tegen tumoren spelen T-cellen een doorslaggevende rol. Helper-T-cellen herkennen het tumorantigeen en produceren cytokinen die cytotoxische T-cellen aanzetten tot interactie met de kankercel, leidend tot celdood.[79]
Dankzij nieuwe inzichten in de tumorimmunologie is het steeds beter mogelijk geworden om het afweersysteem te mobiliseren om tumorgroei te onderdrukken. Belangrijke voorbeelden hiervan zijn het gebruik van de checkpointremmers bij melanoom en longkanker, en genetisch gemodificeerde T-cellen (CAR-T-cellen) bij verschillende vormen van leukemie.[79] In het bijzonder bij longkanker en uitgezaaid melanoom – vormen van kanker die in het verleden nauwelijks te behandelen waren – leidt checkpointremming tot spectaculaire doorbraken en zelfs complete remissie op lange termijn.[80][81]
Helaas ontwikkelen tumoren tijdens hun groei uiteenlopende manieren om het immuunsysteem te ontwijken. Zo kunnen sommige kankercellen de cytotoxische werking van T-cellen tegengaan, door de T-cel een remmend signaal te geven. Voorts geven tumoren ontstekingsremmende cytokinen vrij (zoals TGF-β) die de afweer stilhouden.[82] De beperkte en voortdurend veranderende antigene verschillen tussen normale lichaamscellen en tumorcellen zorgen ervoor dat effectieve immuuntherapie niet eenvoudig is. De verschillen zijn er echter, en verwacht mag worden dat immuuntherapie een steeds belangrijkere rol zal vervullen in het toekomstig therapeutisch arsenaal tegen kanker.[79]
Evolutie en afweer in andere levensvormen
[bewerken | brontekst bewerken]Vrijwel alle vormen van leven kennen een vorm van afweer. De ontwikkeling van verdedigingsmechanismen tegen infecterende micro-organismen is een universeel gegeven in de evolutie. Afweermechanismen zijn bij diverse levensvormen op verschillende manieren tot stand gekomen, afgestemd op de pathogene gevaren waar zij in hun specifieke omgeving aan blootstaan.
De meeste bacteriën en archaea bezitten een vernuftig verdedigingssysteem van enzymen die bescherming bieden tegen virussen. Dit systeem, CRISPR genaamd, stelt bacteriën in staat het genetisch materiaal van virussen waarmee zij in contact komen, op te slaan in hun genoom. Wanneer het betreffende virus de bacterie een tweede keer infecteert, zal de bacterie het genetisch materiaal herkennen en afbreken via een vorm van RNA-interferentie. Dit principe is te vergelijken met de verworven afweer bij gewervelden.[83] Naast CRISPR kunnen bacteriën – en andere eencelligen – zich ook verweren middels andere restrictiemechanismen, maar hier is nog weinig over bekend.
Planten en dieren beschikken over sterk geconserveerde patroonherkenningsmoleculen om vreemde indringers te herkennen. De Toll-like receptoren, die oorspronkelijk ontdekt werden in de fruitvlieg Drosophila, ontstonden waarschijnlijk al zeer vroeg in de evolutie van het dierenrijk, meer dan 700 miljoen jaar geleden.[84] Antimicrobiële peptiden (defensinen) en eenvoudige complement-eiwitten vormen het belangrijkste onderdeel van het immuunsysteem in ongewervelden. Planten maken in tegenstelling tot dieren vooral gebruik van hormonale signalen om een immuunrespons op gang te brengen. Wanneer een plant geïnfecteerd wordt, maakt deze bijvoorbeeld salicylzuur aan, een metaboliet dat zich via de vaten door de plant verspreidt en de plant resistentie verleent tegen de ziekteverwekker.[85]

Het geavanceerde verworven immuunsysteem van gewervelden ontstond bij de gemeenschappelijke voorouder van de Gnathostomata. Veel van de eiwitten en celtypen die typisch zijn voor de verworven afweer, zoals immunoglobulinen en lymfocyten, zijn uniek in het dierenrijk en komen enkel bij gewervelden voor.[86] Een doorslaggevende stap was de ontwikkeling van de eerste lymfoïde organen, zoals een thymus en milt. Pas bij de intrede van terrestrische gewervelden – op het land levende amfibieën, reptielen en zoogdieren – ontstond een volledig lymfevatenstelsel met lymfeklieren en beenmerg, en een compleet antilichaamrepertoire (met IgM en IgG). Hiermee konden deze dieren zich effectiever verweren tegen lichaamsvreemde invloeden uit de terrestrische omgeving.[86]
Zie ook
[bewerken | brontekst bewerken]Noten
- ↑ Hoewel de naam anders doet vermoeden, komen PAMPs niet alleen voor op pathogene micro-organismen, maar ook op niet-pathogene micro-organismen.
- ↑ Toll-like receptor 4 is een dimerisch eiwit dat verankerd is in het celmembraan (grijs). Het heeft een groot, leucine-rijk bindingsdomein (hoefijzervormig) dat interactie kan aangaan met LPS (rood), een celwandcomponent van gramnegatieve bacteriën.
- ↑ Het systeem kan geactiveerd worden via drie verschillende routes: de klassieke route (geïnitieerd doordat vroege complement-eiwitten zich binden aan een pathogeen beladen met antilichamen), de lectineroute (door binding van mannose) en de alternatieve route (door rechtstreekse binding van oppervlakte-eiwitten van een pathogeen). Alle routes leiden uiteindelijk tot de splitsing en activatie van het centrale complement-eiwit C3.[19]
- ↑ Iedere B-lymfocyt en iedere T-lymfocyt heeft dus slechts één enkele antigene specificiteit. Een lymfocyt heeft doorgaans tienduizenden antigeenreceptoren op zijn membraan, dit om het contact met antigenen in het lichaam te faciliteren. Al deze receptoren zijn identiek aan elkaar (voor een gegeven lymfocyt).
- ↑ Antigeenpresenterende cellen bezitten MHC-klasse-II (MHC-II) op hun membraan. Deze MHC-eiwitten pakken peptiden op van gefagocyteerde micro-organismen in endosomen. Ze worden naar het celmembraan getransporteerd, waar ze de peptiden presenteren aan naïeve T-cellen.
- ↑ Th1-cellen stimuleren voornamelijk de cellulaire afweer, Th2-cellen voornamelijk de humorale afweer. Folliculaire helper-T-cellen (Tfh) sturen de antilichaamproductie in de lymfeknopen en Th17-cellen rekruteren ontstekingscellen via IL-17.[38]
- ↑ IgG zijn krachtige antilichamen, omdat ze naast hun neutraliserende werking ook andere effectormechanismen activeren (fagocytose, activatie van complementsysteem).[32]
- ↑ Darmbacteriën fermenteren vezelrijk voedsel in de dikke darm, en produceren hierbij kleine vetzuren (short-chain fatty acids) die een ontstekingsremmend effect kunnen hebben, onder meer door neutrofielmigratie te beïnvloeden.[57]
Referenties
- ↑ a b (nl) Rijkers et al, pp. 3–12.
- ↑ a b (en) Iwasaki A, Medzhitov R. (2015). Control of adaptive immunity by the innate immune system. Nature Immunology 16: 343–353. ISSN: 1529-2908. DOI: 10.1038/ni.3123.
- ↑ (en) Loker ES, Adema C, Zhang S, Kepler TB (2004). Invertebrate immune systems – not homogeneous, not simple, not well understood. Immunological Reviews 198 (1): 10–24. DOI: 10.1111/j.0105-2896.2004.0117.x.
- ↑ (en) Verhage A, van Wees SC, Pieterse CMJ. (2010). Plant Immunity: It’s the Hormones Talking, But What Do They Say?. Plant Physiology 154 (2): 536–540. DOI: 10.1104/pp.110.161570.
- ↑ (en) Kaufmann SHE. (2019). Immunology's Coming of Age. Frontiers in Immunology 10. DOI: 10.3389/fimmu.2019.00684. Gearchiveerd van origineel op 6 juni 2023.
- ↑ (en) Varadé J, Magadán S, González-Fernández A. (2021). Human immunology and immunotherapy: main achievements and challenges. Cellular & Molecular Immunology 18: 805–828. DOI: 10.1038/s41423-020-00530-6.
- ↑ (en) Corthay, A. (2014). Does the immune system naturally protect against cancer?. Frontiers in Immunology 5: 197. DOI: 10.3389/fimmu.2014.00197.
- ↑ a b (en) Smith P, MacDonald T, Blumberg R. (2012). Principles of Mucosal Immunology. Garland Science, "Secreted Effectors of the Innate Mucosal Barrier". ISBN 978-1-136-66514-1.
- ↑ (en) Alberts et al, pp. 1298–1300.
- ↑ (en) Kuziel GA, Rakoff-Nahoum S. (2022). The gut microbiome. Current Biology 32 (6): R257-R264. DOI: 10.1016/j.cub.2022.02.023.
- ↑ (en) Abt MC, Pamer EG. (2014). Commensal bacteria mediated defenses against pathogens. Current Opinion in Immunology 29: 16-22. DOI: 10.1016/j.coi.2014.03.003.
- ↑ (en) Britten RA, Young VB. (2012). Interaction between the intestinal microbiota and host in Clostridium difficile colonization resistance. Trends in Microbiology 20 (7): 313-319. DOI: 10.1016/j.tim.2012.04.001.
- ↑ (en) Li D, Wu M. (2021). Pattern recognition receptors in health and diseases. Signal Transduction and Targeted Therapy 6 (291). DOI: 10.1038/s41392-021-00687-0.
- ↑ (en) Moresco EM, LaVine D, Beutler B. (2011). Toll-like receptors. Current Biology 21 (13): R488-R493. DOI: 10.1016/j.cub.2011.05.039. Gearchiveerd van origineel op 26 mei 2023.
- ↑ (en) Kanneganti TD, Lamkanfi M, Núñez G. (2007). Intracellular NOD-like Receptors in Host Defense and Disease. Immunity 27 (4): 549-559. DOI: 10.1016/j.immuni.2007.10.002.
- ↑ (en) Sidiq T, Yoshihama S, Downs I, Kobayashi KS. (2016). Nod2: A Critical Regulator of Ileal Microbiota and Crohn’s Disease. Frontiers in immunology 7 (367). DOI: 10.3389/fimmu.2016.00367.
- ↑ a b (en) Rehwinkel J, Gack M. (2021). RIG-I-like receptors: their regulation and roles in RNA sensing. Nature Reviews Immunology 20: 537–551. DOI: 10.1038/s41577-020-0288-3.
- ↑ a b (en) Medzhitov R, Janeway C. (2000). Innate Immunity. New England Journal of Medicine 343 (5): 338-344. PMID 10922424. DOI: 10.1056/NEJM200008033430506.
- ↑ a b c d e (en) Alberts et al, pp. 1301–1302.
- ↑ (en) Gordon, S. (2016). Phagocytosis: An Immunobiologic Process. Immunity: 463–475. DOI: 10.1016/j.immuni.2016.02.026.
- ↑ (en) Hallett, MB. (2020). An Introduction to Phagocytosis. Springer International Publishing, Cham, 1–7. ISBN 978-3-030-40405-5. Gearchiveerd op 28 oktober 2023. Geraadpleegd op 9 december 2022.
- ↑ (en) Cardamone C, Parente R, Feo G, Triggiani M. (2016). Mast cells as effector cells of innate immunity and regulators of adaptive immunity. Immunology Letters: 10–14. DOI: 10.1016/j.imlet.2016.07.003.
- ↑ (en) Huang L, Appleton JA. (2016). Eosinophils in Helminth Infection: Defenders and Dupes. Trends in Parasitology: 798–807. PMID 27262918. DOI: 10.1016/j.pt.2016.05.004.
- ↑ (en) Vivier, E, Tomasello, E, Baratin, M, Walzer, T, Ugolini, S (2008). Functions of natural killer cells. Nature Immunology: 503–510. DOI: 10.1038/ni1582.
- ↑ (en) Wu S, Fu T. (2020). Natural killer cells in cancer biology and therapy. Molecular Cancer 19 (1): 120. PMID: 32762681. DOI:10.1186/s12943-020-01238-x.
- ↑ a b (en) Medzhitov, R. (2008). Origin and physiological roles of inflammation. Nature: 428–435. DOI: 10.1038/nature07201. Gearchiveerd van origineel op 10 mei 2023.
- ↑ (en) Sadik CD, Kim ND, Luster AD. (2011). Neutrophils cascading their way to inflammation. Trends in Immunology: 452–460. DOI: 10.1016/j.it.2011.06.008.
- ↑ (nl) Rijkers et al, pp. 78–82.
- ↑ (en) Merle NS, Church SE, Fremeaux-Bacchi V, Roumenina LT. (2015). Complement system part I – molecular mechanisms of activation and regulation. Frontiers in immunology 6 (262). DOI: 10.3389/fimmu.2015.00262.
- ↑ (en) Daha, M. (2010). Role of complement in innate immunity and infections. Critical Reviews in Immunology 30 (1): 47-52. DOI: 10.1615/critrevimmunol.v30.i1.30.
- ↑ (en) Kotsias, F. (2019). Antigen processing and presentation. Elsevier, 69–121. ISBN 978-0-12-818351-9. Gearchiveerd op 15 juni 2022.
- ↑ a b (nl) Rijkers et al, pp. 10–19.
- ↑ (en) Romagnani, S. (2006). Immunological tolerance and autoimmunity. Internal and Emergency Medicine 1 (3): 187-96. DOI: 10.1007/BF02934736.
- ↑ (en) Sakaguchi S, Yamaguchi T, Nomura T, Ono M. (2008). Regulatory T Cells and Immune Tolerance. Cell 133 (5): 775-787. PMID 18510923. DOI: 10.1016/j.cell.2008.05.009.
- ↑ (en) Knip M, Siljander H. (2008). Autoimmune mechanisms in type 1 diabetes. Autoimmunity Reviews 7 (7): 550-557. DOI: 10.1016/j.autrev.2008.04.008.
- ↑ (en) Andersen MH, Schrama D, Straten P, Becker JC. (2006). Cytotoxic T Cells. Journal of Investigative Dermatology: 32–41. DOI: 10.1038/sj.jid.5700001.
- ↑ a b (en) Chaplin DD, (2010). Overview of the immune response. Journal of Allergy and Clinical Immunology: S3–S23. PMID 20176265. DOI: 10.1016/j.jaci.2009.12.980. Gearchiveerd van origineel op 17 juni 2023.
- ↑ a b (en) Saravia J, Chapman NM, Chi H. (2019). Helper T cell differentiation. Cellular & Molecular Immunology: 634–643. PMID 30867582. DOI: 10.1038/s41423-019-0220-6. Gearchiveerd van origineel op 11 november 2022.
- ↑ (en) Vignali DA, Collison LA, Workman CJ. (2008). How regulatory T cells work. Nature Reviews Immunology: 523–532. PMID 18566595. DOI: 10.1038/nri2343. Gearchiveerd van origineel op 8 mei 2023.
- ↑ (en) Murphy & Weaver, p. 400.
- ↑ (en) Alberts et al, p. 1373.
- ↑ (en) VanBlargan LA, Goo L, Pierson TC. (2016). Deconstructing the Antiviral Neutralizing-Antibody Response: Implications for Vaccine Development and Immunity. Microbiology and Molecular Biology Reviews 80 (4): 989-1010. DOI: 10.1128/MMBR.00024-15.
- ↑ (en) Hurt AC, Wheatley AK. (2021). Neutralizing Antibody Therapeutics for COVID-19. Viruses: 628. PMID 33916927. DOI: 10.3390/v13040628.
- ↑ (en) Forthal DN. (2014). Functions of Antibodies. Microbiology Spectrum: 2.4.21. DOI: 10.1128/microbiolspec.AID-0019-2014.
- ↑ a b (en) Murphy & Weaver, pp. 473–475.
- ↑ (en) Guthmiller J, Utset HA, Wilson PC. (2021). B Cell Responses against Influenza Viruses: Short-Lived Humoral Immunity against a Life-Long Threat. Viruses 13 (6): 965. DOI: 10.3390/v13060965.
- ↑ (en) Tracey KJ. (2002). The inflammatory reflex. Nature 420: 853–859. DOI: https://doi.org/10.1038/nature01321.
- ↑ (en) Taneja, V. (2018). Sex Hormones Determine Immune Response. Frontiers in Immunology: 1931. PMID 30210492. DOI: 10.3389/fimmu.2018.01931. Gearchiveerd van origineel op 28 oktober 2023. Geraadpleegd op 23 december 2022.
- ↑ (en) Bouman A, Heinemann MJ, Faas MM. (2005). Sex hormones and the immune response in humans. Human Reproduction Update: 411–423. DOI: 10.1093/humupd/dmi008.
- ↑ (en) Chakraborty B, Byemerwa J, Krebs T, Lim F, Chang C. (2022). Estrogen Receptor Signaling in the Immune System. Endocrine Reviews. DOI: 10.1210/endrev/bnac017.
- ↑ (en) Trigunaite A, Dimo J, Jørgensen TN. (2015). Suppressive effects of androgens on the immune system. Cellular Immunology: 87–94. DOI: 10.1016/j.cellimm.2015.02.004.
- ↑ a b c (en) Besedovsky L, Lange T, Born J. (2012). Sleep and immune function. Pflügers Archiv - European Journal of Physiology: 121–137. PMID 22071480. DOI: 10.1007/s00424-011-1044-0. Gearchiveerd van origineel op 28 oktober 2023. Geraadpleegd op 23 december 2022.
- ↑ a b (en) Childs CE, Calder PC, Miles EA. (2019). Diet and Immune Function. Nutrients: 1933. PMID 31426423. DOI: 10.3390/nu11081933.
- ↑ (en) Irwin MR. (2019). Sleep and inflammation: partners in sickness and in health. Nature Reviews Immunology 19 (11): 702–715. DOI:10.1038/s41577-019-0190-z.
- ↑ (en) Besedovsky L, Lange T, Haack M. (2019). The Sleep-Immune Crosstalk in Health and Disease. Physiological Reviews: 1325–1380. PMID 30920354. DOI: 10.1152/physrev.00010.2018.
- ↑ (en) Garbarino S, Lanteri P, Bragazzi NL, Magnavita N, Scoditti E. (2021). Role of sleep deprivation in immune-related disease risk and outcomes. Communications Biology: 1304. PMID 34795404. DOI: 10.1038/s42003-021-02825-4. Gearchiveerd van origineel op 21 april 2023.
- ↑ (en) Vinolo MA, Rodrigues HG, Nachbar RT, Curi R. (2011). Regulation of Inflammation by Short Chain Fatty Acids. Nutrients: 858–876. PMID 22254083. DOI: 10.3390/nu3100858. Gearchiveerd van origineel op 1 juni 2023.
- ↑ (en) Venter C, Eyerich S, Sarin T, Klatt K. (2020). Nutrition and the Immune System: A Complicated Tango. Gearchiveerd op 22 december 2022. Nutrients 12 (3): 818. PMID: 32204518. DOI:10.3390/nu12030818.
- ↑ (en) Chapel H, Prevot J, Gaspar HB, Español T, Bonilla FA. (2014). Primary Immune Deficiencies – Principles of Care. Frontiers in Immunology. PMID 25566243. DOI: 10.3389/fimmu.2014.00627.
- ↑ (en) Cirillo E, Giardino G, Gallo V. (2015). Severe combined immunodeficiency-an update: Severe combined immunodeficiencies. Annals of the New York Academy of Sciences: 90–106. DOI: 10.1111/nyas.12849.
- ↑ Hiv. RIVM (23-06-2022). Gearchiveerd op 23 februari 2023. Geraadpleegd op 28-01-2023.
- ↑ (en) Deeks SG, Overbaugh J, Phillips A, Buchbinder S. (2015). HIV infection. Nature Reviews Disease Primers: 15035. DOI: 10.1038/nrdp.2015.35. Gearchiveerd van origineel op 29 januari 2023.
- ↑ a b (en) Davidson A, Diamond B. (2001). Autoimmune Diseases. New England Journal of Medicine: 340–350. DOI: 10.1056/NEJM200108023450506.
- ↑ (en) Dörner T, Furie R. (2019). Novel paradigms in systemic lupus erythematosus. The Lancet: 2344–2358. DOI: 10.1016/S0140-6736(19)30546-X.
- ↑ a b (nl) Rijkers et al, pp. 21–22.
- ↑ (en) Rosato E, Pisarri S, Salsano F. (2010). Current strategies for the treatment of autoimmune diseases. Journal of Biological Regulators and Homeostatic Agents: 251–259. PMID 20846473.
- ↑ (en) Allergies: Overview. Institute for Quality and Efficiency in Health Care (IQWiG) (2020). Gearchiveerd op 3 juni 2023.
- ↑ (en) Randall KL, Hawkins CA. (2018). Antihistamines and allergy. Australian Prescriber: 42–45. PMID 29670310. DOI: 10.18773/austprescr.2018.013.
- ↑ (en) Garn H, Renz H. (2007). Epidemiological and immunological evidence for the hygiene hypothesis. Immunobiology: 441–452. DOI: 10.1016/j.imbio.2007.03.006.
- ↑ (en) Garn H, Potaczek DP, Pfefferle PI. (2021). The Hygiene Hypothesis and New Perspectives—Current Challenges Meeting an Old Postulate. Frontiers in Immunology. PMID 33815389. DOI: 10.3389/fimmu.2021.637087.
- ↑ a b Claas, F. (2016). Transplantatie en afstoting. Bohn Stafleu van Loghum, Houten, 401–420. ISBN 978-90-368-0257-4. Gearchiveerd op 28 oktober 2023. Geraadpleegd op 27 februari 2023.
- ↑ (en) Allison TL (2016). Immunosuppressive Therapy in Transplantation. Nursing Clinics of North America: 107–120. DOI: 10.1016/j.cnur.2015.10.008.
- ↑ (en) Andrés A. (2005). Cancer incidence after immunosuppressive treatment following kidney transplantation. Critical Reviews in Oncology/Hematology 56 (1): 71–85. DOI:10.1016/j.critrevonc.2004.11.010.
- ↑ (en) Greenwood, B. (2014). The contribution of vaccination to global health: past, present and future. Philos Trans R Soc Lond B Biol Sci 369 (1645): 20130433. DOI: 10.1098/rstb.2013.0433.
- ↑ (en) Andre FE, Booy R, Bock HL, Clemens J. (2017). Vaccination greatly reduces disease, disability, death and inequity worldwide. Bull World Health Organ 86 (2): 140–146. DOI: 10.2471/BLT.07.040089.
- ↑ a b (en) Iwasaki A, Omer SB. (2020). Why and How Vaccines Work. Cell: 290–295. PMID 33064982. DOI: 10.1016/j.cell.2020.09.040. Gearchiveerd van origineel op 11 maart 2023.
- ↑ (en) Anderson RP, Jabri B. (2013). Vaccine against autoimmune disease: antigen-specific immunotherapy. Current Opinion in Immunology: 410–417. PMID 23478068. DOI: 10.1016/j.coi.2013.02.004.
- ↑ (en) Swann JB, Smyth MJ. (2007). Immune surveillance of tumors. Journal of Clinical Investigation: 1137–1146. DOI: 10.1172/JCI31405. Gearchiveerd van origineel op 28 oktober 2023. Geraadpleegd op 6 augustus 2023.
- ↑ a b c Krieken J, Medema RH. (2017). Fundamentele aspecten van kanker. Bohn Stafleu van Loghum, Houten, 3–28. ISBN 978-90-368-0441-7. Gearchiveerd op 28 oktober 2023. Geraadpleegd op 27 februari 2023.
- ↑ (en) Carlino MS, Larkin J, Long GV. (2021). Immune checkpoint inhibitors in melanoma. The Lancet: 1002–1014. DOI: 10.1016/S0140-6736(21)01206-X.
- ↑ (en) Onoi K, Chihara Y, Uchino J, Shimamato T, Morimoto Y. (2020). Immune Checkpoint Inhibitors for Lung Cancer Treatment: A Review. Journal of Clinical Medicine: 1362. PMID 32384677. PMC PMC7290914. DOI: 10.3390/jcm9051362.
- ↑ (en) Hegde PS, Chen DS. (2020). Top 10 Challenges in Cancer Immunotherapy. Immunity: 17–35. DOI: 10.1016/j.immuni.2019.12.011.
- ↑ (en) Barrangou R. (2015). The roles of CRISPR–Cas systems in adaptive immunity and beyond. Current Opinion in Immunology: 36–41. DOI: 10.1016/j.coi.2014.12.008.
- ↑ (en) Leulier F, Lemaitre B. (2008). Toll-like receptors — taking an evolutionary approach. Nature Reviews Genetics: 165–178. DOI: 10.1038/nrg2303.
- ↑ (en) Jh D. (2015). An Overview of Plant Immunity. Journal of Plant Pathology & Microbiology. DOI: 10.4172/2157-7471.1000322.
- ↑ a b (en) Cooper MD, Alder MN. (2006). The Evolution of Adaptive Immune Systems. Cell: 815–822. PMID 16497590. DOI: 10.1016/j.cell.2006.02.001.
Literatuur
- (en) Murphy KM, Weaver, C. (2016). Janeway's Immunobiology, 9th edition. Garland Science. ISBN 978-0-8153-4551-0.
- (en) Alberts, B. (2022). Molecular Biology of The Cell, 7th. W.W. Norton & Company, "The Innate and Adaptive Immune Systems". ISBN 978-0-393-42708-0.
- (nl) Rijkers, G. T. (2016). Leerboek Immunologie. Bohn Stafleu van Loghum. ISBN 978-90-368-0257-4.
- (en) Abbas A, Lichtman AH. (2021). Cellular and Molecular Immunology, 10th edition. Elsevier. ISBN 978-0-323-75748-5.
- (en) Actor, J. (2019). Introductory Immunology. Academic Press, "Chapter 1: A Functional Overview of the Immune System and Immune Components". ISBN 978-0-12-816572-0.
- (en) Heine, H. (2018). Innate Immunity of Plants, Animals and Humans. Springer Berlin. ISBN 978-3-540-73930-2.
