Ziekte van Parkinson
| Ziekte van Parkinson | ||||
|---|---|---|---|---|
| ||||
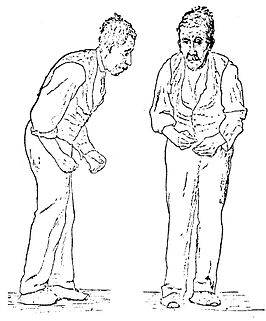
Illustratie van de ziekte van Parkinson door Sir William Richard Gowers uit A Manual of Diseases of the Nervous System in 1886
| ||||
| ||||
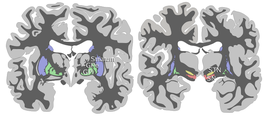
Schematische weergave van een doorsnede van de menselijke hersenen; rood is de substantia nigra, blauw het striatum, geel de nucleus subthalamicus, groen de globus pallidus
| ||||
| Synoniemen | ||||
| Latijn | paralysis agitans[1][2][3][4] morbus parkinsoni[3] | |||
| Nederlands | schudverlamming[2][4] sidderverlamming[4] | |||
| Coderingen | ||||
| ICD-10 | G20 | |||
| ICD-9 | 332 | |||
| DiseasesDB | 9651 | |||
| MedlinePlus | 000755 | |||
| eMedicine | neuro/304 neuro/635 in young pmr/99 rehab | |||
| standaarden | ||||
| NHG-standaard | M98/samenvatting | |||
| ||||
De ziekte van Parkinson[4] is een degeneratieve ziekte in het centraal zenuwstelsel waarbij zenuwcellen langzaam afsterven ("degenereren"). Dit leidt in eerste plaats tot stoornissen in de motoriek; parkinson wordt daarom als bewegingsstoornis beschouwd. Gedragsstoornissen als gevolg van Parkinson zijn echter minstens even groot als de lichamelijke gevolgen.
De symptomen komen langzaam op en worden naarmate de ziekte vordert ernstiger. In de beginfase van de ziekte bestaan de voornaamste symptomen uit schudden, spasmen, traagheid in beweging en moeite met lopen.[6] Daarnaast kunnen ook gedrags- en cognitieve problemen voorkomen. In latere stadia is er een verhoogde kans op dementie.[6] Ruim één derde van de parkinsonpatiënten lijdt aan depressie.[7] De kenmerkende verschijnselen samen worden aangeduid met de naam parkinsonisme. Officieel is de term parkinsonismen een verzamelnaam voor een aantal aandoeningen die lijken op de ziekte van Parkinson, maar ze zijn toch anders. Parkinsonismen veroorzaken vergelijkbare klachten als parkinson. Maar medicijnen die gebruikt worden om de symptomen te onderdrukken werken niet of minder goed bij parkinsonismen. Ook het verloop van de ziekte is anders. Vormen van Parkinsonisme zijn onder meer Lewy Body Dementie (LBD), Vasculair parkinsonisme, Progressieve supranucleaire paralyse (PSP) en Multisysteem atrofie-parkinson.
De oorzaak van de ziekte van Parkinson is doorgaans idiopathisch (onbekend). De ziekte ontstaat waarschijnlijk vanwege een combinatie van genetische en omgevingsfactoren. Familieleden van patiënten hebben een grotere kans om de ziekte ook te krijgen.[8] Mensen die in aanraking zijn gekomen met bepaalde pesticiden en mensen die eerder hoofdletsel hebben opgelopen, lopen meer risico de ziekte te ontwikkelen, terwijl rokers en mensen die koffie of thee drinken geen verhoogd risico hebben.[9]
Er is geen middel waarmee parkinson kan worden genezen. Wel bestaan er behandelingen, zoals medicijnen op basis van L-DOPA, die de symptomen kunnen onderdrukken.[6]
Jaarlijks wordt op 11 april de Wereld Parkinsondag georganiseerd om extra aandacht voor deze ziekte te vragen en fondsen te werven.
Geschiedenis
[bewerken | brontekst bewerken]De ziekte is vernoemd naar de Engelse arts James Parkinson (1755-1824), die de ziekte in 1817 beschreef in zijn essay "On the Shaking Palsy". De Franse arts Jean-Martin Charcot (1825-1893) kon als eerste aantonen dat de ziekte van Parkinson (met onder andere rusttremor) en multiple sclerose (met o.a. intentietremor) twee verschillende aandoeningen zijn.
Voorkomen
[bewerken | brontekst bewerken]In 2013 leden wereldwijd 5,9 miljoen mensen aan parkinson en overleden ongeveer 103.000 mensen aan de gevolgen van de ziekte.[10][11] In Nederland leden in 2006 naar schatting 50.000 patiënten aan parkinson. Verwacht wordt dat dit in 2025, als gevolg van de vergrijzing, is toegenomen tot 75.000 patiënten.[12] In België werd het aantal mensen dat aan deze ziekte lijdt in 2022 op 40.000 geschat.
Parkinson komt vooral voor bij mensen boven de 60. In die leeftijdscategorie komt de ziekte voor bij 1% van de bevolking.[13] Mannen krijgen vaker parkinson dan vrouwen.[8] Wanneer parkinson voorkomt bij mensen jonger dan 40 à 50 jaar spreekt men van een early onset, ofwel parkinson met vroeg begin.[14] Na de diagnose is de gemiddelde levensverwachting nagenoeg gelijk aan die van gezonde mensen. Wel komt het voor dat men overlijdt aan nierfalen, de gevolgen van longontsteking of hartfalen, als gevolg van verminderde gesteldheid als gevolg van de ziekte van Parkinson.
Oorzaken
[bewerken | brontekst bewerken]- Erfelijkheid. In 5-10% van de gevallen is de ziekte van Parkinson een erfelijke ziekte. Op dit moment zijn er ongeveer zes genen bekend die de ziekte kunnen veroorzaken. Voor diagnostische doeleinden is tegenwoordig mutatieanalyse mogelijk van LRRK2(PARK8),SNCA (PARK 1 of 4), Parkin (PARK2), PINK1(PARK6), DJ-1(PARK7) en ATP13A2(PARK9). Daarnaast zijn er genen bekend die de kans dat iemand de ziekte krijgt fors doen toenemen. Wereldwijd wordt bij 5-20% van de patiënten met de ziekte van Parkinson en een autosomaal dominante familieanamnese de LRRK2-mutatie gevonden. Deze mutatie komt ook voor bij 1-2% van de patiënten met een negatieve familieanamnese. Afhankelijk van welk gen een rol speelt, wijkt het verloop soms enigszins af van de grootste groep patiënten: erfelijke vormen beginnen meestal jonger en verlopen langzamer of juist sneller.[15]
- Vergiftiging. Bij een andere minderheid is er sprake van gifstoffen. Mangaanvergiftiging is zo'n oorzaak en is door de EU als beroepsziekte erkend. Ook andere neurotoxische stoffen zoals zware metalen, koolmonoxide en insecticiden kunnen de ziekte van Parkinson veroorzaken. Door een ongeluk met vergiftigde heroïne is ontdekt dat de stof MPTP een vorm van de ziekte van Parkinson kan veroorzaken. Deze stof wordt nu gebruikt in dierproeven om muizen een op de ziekte van Parkinson gelijkende ziekte te laten krijgen.
- Chemische bestrijdingsmiddelen. Al meer dan honderd jaar wordt er gezocht naar insecticiden en pesticiden als oorzakelijke factor in het ontstaan van de ziekte van Parkinson. Mensen die werken en wonen in bepaalde agrarische gebieden hebben een sterk verhoogd risico om de ziekte te ontwikkelen.[16][17] Daarbij worden met name maneb, paraquat, chlordaan, DDT, chloorpyrifos, diazinon, rotenon en malathion met parkinson in verband gebracht. In Frankrijk[18] en Duitsland[19] is parkinson daarom erkend als beroepsziekte. Als iemand de ziekte heeft opgelopen en lange tijd een risicoberoep gehad heeft, dan heeft diegene recht op een uitkering van de overheid, tenzij een andere oorzaak gevonden wordt.
- Pcb's. Ook beroepsmatige blootstelling aan pcb's wordt in verband gebracht met de ziekte van Parkinson. Ook in concentraties zoals die bij de bevolking in het algemeen worden aangetroffen, blijken pcb's in staat de normale dopaminefunctie in de hersenen te verstoren.[20] Een aanzienlijke hoeveelheid dier- en laboratoriumonderzoek komt tot een soortgelijke conclusie.
- Organische oplosmiddelen. Blootstelling aan organische oplosmiddelen, met name trichlooretheen dat gebruikt wordt in stomerijen, wordt sterk in verband gebracht met parkinson.[21]
- Veroudering. Hoewel de ziekte van Parkinson ook bij jonge mensen voorkomt, wordt de kans om de ziekte te krijgen bij het ouder worden steeds groter (de ziekte treft gemiddeld 3 op de 1000 mensen, van de 70+'ers 20 op de 1000).
- Infectie. Aan de encefalitisepidemie die tussen 1917 en 1926 over de wereld ging, bleken talloze mensen (soms pas na jaren) halfzijdige parkinsonverschijnselen te hebben overgehouden.
- Onbekend (idiopathisch). In verreweg de meeste gevallen bleef de oorzaak onbekend.
Vermoedelijk speelt hier erfelijkheid een beperkte rol. De combinatie van een genetisch bepaalde, aangeboren kwetsbaarheid met schadelijke omgevingsfactoren zou de oorzakelijke factor kunnen zijn.
Men neemt aan dat door deze of nog andere oorzaken de cellen van de zwarte kernen hun eigen celdood (apoptose) programmeren. In de afstervende cellen worden bij microscopisch onderzoek "lewy-lichaampjes" aangetroffen, die het eiwit alfa-synucleïne bevatten, waarmee bij de ziekte van Parkinson kennelijk iets mis gaat.
Rol van dopamine
[bewerken | brontekst bewerken]De cellen van de substantia nigra hebben als taak dopamine te produceren en die via hun uitlopers naar het striatum, onderdeel van de basale ganglia, te brengen. Dit is het zogeheten nigrostriatale circuit. Er lopen ook zenuwbanen vanuit basale ganglia naar het limbische systeem (het mesolimbische circuit) en naar de prefrontale cortex (het mesocorticale circuit). Bij het ouder worden treedt een verlies op aan neuronen in de substantia nigra, dat geschat wordt op 3% per tien jaar. Bij de ziekte van Parkinson is sprake van een sterkere reductie van neuronen door apoptose in dit gebied. Men schat dat symptomen pas ontstaan als er sprake is van een reductie van 60 tot 70% van de neuronen van deze zwarte stof. Naast de degeneratie van dopamineproducerende neuronen vindt ook degeneratie plaats van andere neuronen, waaronder adrenerge, serotonerge en cholinerge neuronen.
- Stoornissen in motoriek. Door het dopaminetekort in de basale ganglia, gaan hersenkernen, die belangrijk zijn voor het uitvoeren van bewegingen middels voortdurende inhibitie en selectieve excitatie van corticale gebieden (zie ook extrapiramidaal systeem), slechter functioneren. Hierbij is dus vooral het nigrostriatale circuit betrokken. Langzaam en weinig bewegen, trillen, voorovergebogen lopen en stijve spieren zijn het gevolg (zie verder). Naast controle van excitatiepatronen in motorische gebieden van de cortex lijken de basale ganglia dezelfde functie te vervullen ten opzichte van delen van de cortex geassocieerd met cognitieve en affectieve functies.
- Celafbraak in andere delen van het zenuwstelsel leidt onder meer tot reukstoornissen, stoornissen van het autonome zenuwstelsel, psychische stoornissen (depressie, initiatief verlies) en cognitieve stoornissen (geheugen, tempo van informatieverwerking en executieve functies) als gevolg (zie verder).
- Bewegingstraagheid en trillingen. Het dopaminetekort veroorzaakt bewegingstraagheid, stijfheid en (bij sommige patiënten) een overmaat aan trillingen. De trillingen blijken vooral veroorzaakt te worden door een circuit tussen globus pallidus, cerebellum en thalamus.[22]
Symptomen
[bewerken | brontekst bewerken]
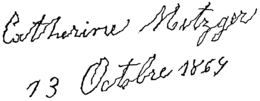
De ziekte van Parkinson veroorzaakt in eerste instantie motorische symptomen.[25] De symptomen beginnen meestal aan één zijde van het lichaam en blijven aan die zijde altijd het ernstigst. Niet-motorische symptomen zijn onder andere autonome stoornissen, neuropsychiatrische problemen (zoals verstoringen van de stemming en cognitie), zintuiglijke stoornissen en verstoorde slaappatronen. De niet-motorische symptomen komen vaak 10-20 jaar voordat een parkinsondiagnose gesteld kan worden.[26]
De eerste verschijnselen zijn vaak erg subtiel, waardoor het lastig kan zijn de juiste diagnose te stellen. In de vroegste stadia kan het voorkomen dat een van de armen niet meezwaait bij het lopen, of dat men klein en kriebelig gaat schrijven (zie de afbeelding rechts). Geleidelijk aan worden bewegen en alledaagse bezigheden steeds moeilijker. De snelheid waarmee de ziekte voortschrijdt verschilt van patiënt tot patiënt.
De ziekte is in te delen in stadia (indeling volgens Hoehn en Yahr):[27]
- Stadium I: verschijnselen aan één kant van het lichaam;
- Stadium II: verschijnselen aan beide kanten van het lichaam, er zijn geen evenwichtsstoornissen;
- Stadium III: verschijnselen aan beide kanten van het lichaam, met evenwichtsstoornissen; de patiënt kan nog zelfstandig functioneren;
- Stadium IV: verschijnselen aan beide kanten van het lichaam, met evenwichtsstoornissen; de patiënt heeft dagelijks hulp nodig;
- Stadium V: ernstig geïnvalideerde toestand; de patiënt is aan stoel of bed gebonden en behoeft verpleegkundige zorg.
Motoriek
[bewerken | brontekst bewerken]Er worden vier motorische kernsymptomen onderscheiden:
- rusttremor, het trillen van hand(en), arm(en) of be(e)n(en) wanneer iemand stilzit;
- rigiditeit, stijfheid van de ledematen;
- traagheid in beweging; en
- een verstoorde lichaamshouding.
Deze symptomen worden hieronder in meer detail beschreven.
Tremor is het meest bekende verschijnsel van de ziekte van Parkinson en is vaak ook het meest opvallend.[25] Het komt daarnaast het meest voor, hoewel bijna een derde van de patiënten geen tremor heeft in het beginstadium van de ziekte.[25] In de meeste gevallen gaat het om een rusttremor, waarbij het trillen het sterkst is wanneer het ledemaat niet wordt gebruikt. De tremor neemt af als het ledemaat wordt aangespannen en ook tijdens de slaap is de tremor minder.[25] Vooral bij de uiteinden van de ledematen (dat wil zeggen de handen en voeten) is de tremor goed zichtbaar. In de beginfase van de ziekte is de tremor vaak unilateraal en komt het in slechts één arm of been voor. Naarmate de ziekte vordert, breidt de tremor zich uit naar beide lichaamshelften.[25]
Rigiditeit verwijst naar de stijfheid van spieren en weerstand tegen het bewegen van de ledematen, die wordt veroorzaakt door een verhoogde spierspanning.[25] Bij parkinsonisme kan de stijfheid zowel uniform ("lodenpijprigiditeit") als trillend ("tandradrigiditeit") zijn.[25][28][29][30] Rigiditeit kan gepaard gaan met pijn aan de gewrichten, wat vaak een van de eerste uitingen van de ziekte is.[25] In de vroege stadia is de rigiditeit vaak asymmetrisch en de spieren in de nek en schouder zijn doorgaans eerder aangedaan dan de spieren in de ledematen en het gezicht.[31]
Bradykinesie, of traagheid in beweging, is nog een kenmerk van parkinson.[28][32][33] Het uitvoeren van gelijktijdige of opeenvolgende bewegingen is vaak verstoord.[25] Dit valt als eerste op bij alledaagse taken waarvoor fijne motoriek benodigd is, zoals schrijven en aankleden.[25] De bradykinesie is niet voor elke beweging gelijk en is afhankelijk van zowel het type beweging als de emotionele toestand van de persoon. Het kan voorkomen dat iemand die vrijwel niet meer kan lopen nog wel in staat is te fietsen.[25] Het lijkt de meeste patiënten beter af te gaan wanneer zij een externe cue (bijvoorbeeld een aanmoediging) krijgen.[25][34]
Een instabiele houding is kenmerkend voor de latere stadia van de ziekte en leidt ertoe dat patiënten vaak vallen.[35] Instabiliteit komt vooral voor in de eindstadia, en jongere patiënten hebben er minder last van.[28] Hoe vaak iemand valt, is afhankelijk van de ernst van de ziekte.[25]
Andere motorische verschijnselen die worden onderscheiden zijn onder meer stoornissen in de lichaamshouding en de loopgang. Patiënten hebben de neiging steeds harder te gaan lopen, met kleine passen. Omdat een normaal looppatroon niet goed lukt, laten patiënten zich voorover vallen en "lopen" ze op hun opvangreactie.[25] Ook het slikken en spreken kunnen verstoord zijn (mede) door speekselvloed.[36] Sommige patiënten hebben een maskergelaat, een uitdrukkingsloos gezicht, of schrijven klein en kriebelig (zie de afbeelding hierboven). Er is echter nog veel meer variëteit in de typen motorische symptomen die voorkomen bij de ziekte van Parkinson.[25]
Psychische symptomen
[bewerken | brontekst bewerken]Hoewel de ziekte van Parkinson vaak wordt gezien als een motorische stoornis, maken neuropsychiatrische stoornissen vaak ook een belangrijk deel van de symptomen uit. Hieronder worden onder meer spraak-, cognitie-, gedrags- en gedachtestoornissen verstaan.[25]
Vanaf het begin van de ziekte kunnen cognitieve stoornissen optreden. In gevorderde stadia komen dit soort stoornissen vaker voor.[25][37] Stoornis van de executieve functies (EF) komt het vaakst voor, waardoor patiënten problemen kunnen ondervinden met planning, cognitieve flexibiliteit, inhibitie, werkgeheugen en aandacht.[37][38] Verder kan de tijdwaarneming zijn aangetast en kan er een algemene traagheid in informatieverwerking ontstaan.[37][38] Het geheugen kan aangetast zijn, voornamelijk het ophalen van aangeleerde informatie.[37] Het kan echter helpen externe cues geven, waardoor opgeslagen informatie alsnog opgehaald kan worden.[37] Visuospatiële problemen, waaronder gezichtsherkenning en oriëntatie, komen ook regelmatig voor.[37][38]
Het risico voor patiënten met de ziekte van Parkinson om dementie te krijgen is twee tot zes keer zo groot als voor gezonde personen.[25][37] Ook in dit geval geldt dat het risico groter wordt naarmate de ziekte vordert.[37]
Veranderingen in stemming en gedrag zonder cognitieve beperkingen komen onder parkinsonpatiënten meer voor dan in de gezonde bevolking en komen vooral voor wanneer iemand lijdt aan zowel parkinson als dementie. Depressie, apathie en angst komen het meest voor.[25] Het stellen van de diagnose depressie is erg lastig, aangezien de symptomen sterk overeenkomen met andere verschijnselen die bij parkinson vaak voorkomen, zoals een vervlakt affect, dementie, verminderde gezichtsuitdrukkingen, zacht praten en weinig bewegen.[39] Stoornissen in de impulsbeheersing, medicatiemisbruik, eetbuien, hyperseksualiteit en pathologisch gokken komen ook voor.[25][40] Deze laatste groep symptomen wordt mogelijk veroorzaakt door de medicatie die gebruikt wordt om de andere parkinsonsymptomen te onderdrukken.[40] Ongeveer 4% van de patiënten met de ziekte van Parkinson krijgt last van psychotische symptomen, zoals wanen en hallucinaties. Ook dit wordt in verband gebracht met medicatiegebruik: de symptomen nemen toe met intensiever gebruik van levodopa.[41][42]
Overig
[bewerken | brontekst bewerken]Slaapproblemen komen ook regelmatig voor en kunnen ernstiger worden door medicatie.[25] Deze problemen uiten zich vooral in vermoeidheid overdag, verstoringen van de remslaap, of slapeloosheid.[25] Tot 13% van de patiënten die dopaminerge medicatie gebruiken worden overvallen door slaap.[43]
Autonoom zenuwstelsel
[bewerken | brontekst bewerken]Bij parkinson treden veranderingen in het autonome zenuwstelsel op. Onder de meest voorkomende verschijnselen vallen orthostatische hypotensie (dalen van de bloeddruk bij overeind komen, met duizeligheid als gevolg), een vettige huid en overmatige transpiratie, urine-incontinentie en seksuele disfuncties, waaronder erectiestoornis.[25] Obstipatie kan zo ernstig worden dat de gezondheid eronder kan lijden.[44]
Zintuigen
[bewerken | brontekst bewerken]Zintuiglijke verschijnselen die voorkomen bij parkinson zijn onder andere reukstoornissen, verminderde pijnwaarneming en paresthesie (een prikkelend gevoel in de huid).[25] Deze symptomen ontstaan soms al jaren voordat de ziekte kan worden vastgesteld.[25]
Bij parkinson kunnen ook verschillende stoornissen in het zicht voorkomen, waaronder een beperkte knippersnelheid, droge ogen, beperkingen in het vloeiend volgen van bewegingen met de ogen en het maken van saccades (het snel en automatisch heen en weer bewegen van de ogen), moeite met direct omhoog kijken en wazig of dubbelzicht.[25][45] Ook hebben patiënten meer moeite met goed kunnen zien in de schemer.[bron?]
Diagnose
[bewerken | brontekst bewerken]De diagnose wordt gesteld door een neuroloog op basis van de klinische verschijnselen bij onderzoek in de spreekkamer. Er kan nader onderzoek worden gedaan om andere oorzaken van parkinsonisme uit te sluiten met bijvoorbeeld een CT- of MRI-scan. Deze onderzoeken kunnen de ziekte van Parkinson niet aantonen. Bepaald onderzoek met isotopen, zoals de DAT-scan (een soort SPECT-scan) en de 18F-dopa-PET-scan kunnen wél het tekort aan dopamine in het striatum zichtbaar maken.
De diagnose wordt bevestigd door een goede reactie op het antiparkinsonmedicijn levodopa. Ziekten met deels vergelijkbare symptomen (met name in het begin van de ziekte) maar met een minder goede reactie op medicijnen, heten parkinsonismen. Voorbeelden zijn multisysteematrofie (MSA), progressieve supranucleaire parese (PSP), Lewy-body-dementie (LBD), corticobasale degeneratie (CBD) en ook parkinsonverschijnselen als gevolg van een herseninfarct of door bijwerkingen van medicijnen zoals antipsychotica.
Behandeling
[bewerken | brontekst bewerken]Er bestaat nog geen behandeling waarvan bewezen is dat ze de ziekte afremt of tot staan brengt. Alleen symptoombestrijding is mogelijk, wat voor de kwaliteit van het leven van de patiënt heel belangrijk is. Uiteindelijk overlijden parkinsonpatiënten doorgaans aan longontsteking en hartfalen.
Medicatie: levodopa (L-DOPA)
[bewerken | brontekst bewerken]Medicamenteus wordt de ziekte behandeld door het tekort aan stimulatie door dopamine in de basale ganglia aan te vullen. Dopamine zelf kan niet door de bloed-hersenbarrière. Daarom wordt de precursor van (een stof die in de hersenen wordt omgezet in) dopamine, namelijk levodopa, voorgeschreven. Levodopa wordt, om bijwerkingen tegen te gaan, altijd gecombineerd met een stof die de omzetting in dopamine buiten de hersenen afremt (een "perifere decarboxylaseremmer"; carbidopa of benserazide). Soms wordt levodopa/carbidopa gecombineerd met entacapone dat de werkingsduur van levodopa verlengt. Levodopa wordt in de resterende zenuwcellen van de substantia nigra alsnog omgezet in dopamine en naar het basale ganglia gebracht.
Bij het voortschrijden van de ziekte neemt het aantal zenuwcellen in de substantia nigra steeds verder af, en daarmee vermindert hun vermogen om levodopa op te nemen en deze stof in de vorm van dopamine geleidelijk weer af te geven. Hierdoor zal de werking van de levodopa minder constant worden: periodes van bijwerkingen (bijvoorbeeld een teveel aan onwillekeurige bewegingen dyskinesieën) worden afgewisseld met periodes waarin de medicatie haar werking verliest ("off-verschijnselen"). Geleidelijke toediening wordt daarom met het vorderen van de ziekte erg belangrijk. Soms wordt de levodopa daarom zelfs met behulp van een pompje rechtstreeks in de darm gebracht. Omdat dopamine op een andere plek in de hersenen (limbisch systeem) invloed heeft op psychische functies, zijn hallucinaties een beruchte bijwerking van een te hoge dosering parkinsonmiddelen (psychose).
Medicatie: andere middelen met een dopamineachtig effect
[bewerken | brontekst bewerken]MAO-B-remmers, zoals selegiline of rasagiline bevorderen het hergebruik van dopamine in de hersenen en werken gunstig in op parkinsonverschijnselen. Zie hieronder voor het veronderstelde neuroprotectieve effect. Dopamineagonisten zoals ropinirol en pramipexol bootsen de werking van dopamine in het striatum na.
Revalidatie
[bewerken | brontekst bewerken]- Verwijzing naar een revalidatiearts kan zinvol zijn om met parkinson toch optimaal te functioneren en ervoor te zorgen dat verhoging van de medicatie, met eventuele bijwerkingen, kan worden uitgesteld, doordat de parkinsonpatiënt ondanks zijn beperkingen beter kan functioneren.
- Onderzoek wijst uit dat parkinsonpatiënten beter kunnen lopen als hun bewegingen gestuurd worden door geluiden en trillingen in een bepaald ritme. Patiënten die op deze wijze met cueing training in hun eigen omgeving werden behandeld, gingen beter en sneller lopen, konden grotere passen zetten, voelden zich zekerder en waren minder snel vermoeid. Zowel geluiden als trillingen bleken effectieve methoden van cueing te zijn.
- Vaardigheden die bemoeilijkt worden door de rigiditeit en de hypokinesie, bijvoorbeeld opstaan, omdraaien in bed enzovoorts kunnen in stand gehouden worden of verbeteren door oefeningen. Eten en drinken en verstaanbaar spreken kunnen getraind worden met behulp van logopedie.
- Voor het behouden van de zelfredzaamheid kan een ergotherapeut samen met de patiënt kijken naar hulpmiddelen en voorzieningen.
- Indien gewenst kan een beroep worden gedaan op een parkinsonverpleegkundige.
Operatie
[bewerken | brontekst bewerken]Als operatieve behandeling wordt bij parkinson deep brain stimulation (DBS) in toenemende mate toegepast. Hierbij wordt een elektrode in delen van de hersenen geplaatst waarvan bekend is dat die invloed hebben op bepaalde verschijnselen bij de ziekte van Parkinson (zoals de globus pallidus en de nucleus subthalamicus). Via deze elektrode worden vervolgens vanuit een onderhuids geïmplanteerde elektrostimulator (net zoals bij een hartpacemaker) elektrische impulsen naar de beoogde hersencellen gestuurd. Dit heeft als doel verschijnselen zoals tremor, rigiditeit en bewegingsarmoede te verminderen.
Toekomstige ontwikkelingen
[bewerken | brontekst bewerken]- Neuroprotectie. Er is dringend behoefte aan een middel dat niet alleen de symptomen verlicht, zoals de huidige medicamenten, maar ook de ziekte zelf afremt. Van onder andere selegiline is dit verwacht, maar tot nu toe stelden alle hoopgevende kandidaten teleur. Rasagiline leek recent in een dosering van 1 mg dd een beschermend effect te hebben op patiënten met een beginnende ziekte van Parkinson, maar in een dosis van 2 mg dd niet(?)[46]
- Stamcellen. De ziekte van Parkinson is een van de ziekten die men ooit hoopt te genezen met behulp van stamceltherapie. De therapie wordt nu aangeboden in het buitenland, maar is niet werkzaam.
- Gentherapie. Recent onderzoek laat zien dat lijders aan de ziekte mogelijk baat hebben bij gentherapie.[47]
Patiëntenvereniging
[bewerken | brontekst bewerken]De Parkinson Vereniging houdt zich bezig met lotgenotencontact, informatie en voorlichting, ondersteuning van wetenschappelijk onderzoek en belangenbehartiging.
Trivia
[bewerken | brontekst bewerken]- De fluweelboon, Mucuna pruriens, een middel dat in de Ayurveda voorkomt, blijkt levodopa te bevatten en wordt soms als alternatieve behandelwijze toegepast.[48][49]
Voetnoten
- ↑ a b Pinkhof, H. (1935). Vertalend en verklarend woordenboek van uitheemsche geneeskundige termen, 2de druk. De Erven F. Bohn, Haarlem.
- ↑ a b c d Haan, H.R.M. de & Dekker, W.A.L. (1955-1957). Groot woordenboek der geneeskunde. Encyclopaedia medica. L. Stafleu, Leiden.
- ↑ a b Jochems, A.A.F. & Joosten, F.W.M.G. (2003). Coëlho Zakwoordenboek der geneeskunde, 27ste druk. ElsevierGezondheidszorg, Doetinchem.
- ↑ a b c d Everdingen, J.J.E. van, Eerenbeemt, A.M.M. van den (2012). Pinkhof Geneeskundig woordenboek, 12de druk. Bohn Stafleu Van Loghum, Houten.
- ↑ Reuter, P. (2007). Springer Klinisches Wörterbuch. Springer Medizin Verlag, Heidelberg.
- ↑ a b c Alzheimer Nederland, Parkinson – Alzheimer Nederland. Geraadpleegd op 2 februari 2017.
- ↑ (en) Sveinbjornsdottir, S. (11 juli 2016). The clinical symptoms of Parkinson's disease.. Journal of Neurochemistry 139: 318–324. ISSN: 0022-3042. PMID 27401947. DOI: 10.1111/jnc.13691.
- ↑ a b (en) Kalia, L.V., & Lang, A.E. (29 augustus 2015). Parkinson's disease.. Lancet (London, England) 386 (9996): 896–912. PMID 25904081. DOI: 10.1016/s0140-6736(14)61393-3.
- ↑
- ↑ (en) Collaborators Global Burden of Disease Study 2013 Mortality and Causes of Death (17 december 2014). Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013.. Lancet 385: 117–71. PMID 25530442. PMC 4340604. DOI: 10.1016/S0140-6736(14)61682-2.
- ↑ (en) Collaborators Global Burden of Disease Study 2013 (22 augustus 2015). Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013.. Lancet (London, England) 386 (9995): 743–800. PMID 26063472. PMC 4561509. DOI: 10.1016/s0140-6736(15)60692-4.
- ↑ Wetenschappelijke bijeenkomst van het Prinses Beatrix Fonds op 26 augustus 2006
- ↑ (en) Carroll, William M. (2016). International Neurology. John Wiley & Sons, p. 188. ISBN 9781118777367.
- ↑ (en) Mosley, Anthony D. (2010). The encyclopedia of Parkinson's disease, 2e editie. Facts on File, New York, p. 89. ISBN 9781438127491.
- ↑ B.P.C. van de Warrenburg, H. Scheffer, P. Heutink en B.R. Bloem (2007). De ziekte(n) van Parkinson: recente genetische inzichten. Ned Tijdschr Geneeskd. 151: 1665-8.
- ↑ (en) Hancock DB, Martin ER, Mayhew GM, et al. Pesticide exposure and risk of Parkinson's disease: a family-based case-control study. (2008) BMC Neurol 8:6. PMID 18373838 gratis volledige artikel.Onder meer besproken in Shaw G. New Study Links Parkinson's and Pesticides[dode link]. Neurology Now September/October 2008; Volume 4(5); Pp 9,13.
- ↑ (en) Costello S, Cockburn M, Bronstein J, et al. Parkinson's disease and residential exposure to maneb and paraquat from agricultural applications in the central valley of California. (2009) Am J Epidemiol 169:919-926. PMID 19270050 gratis volledige artikel.
- ↑ Parkinson een beroepsziekte bij boeren?. www.beroepsziekten.nl. Amsterdam UMC (14 juli 2023). Geraadpleegd op 12 mei 2024.
- ↑ Duitsland erkent Parkinson als beroepsziekte. www.beroepsziekten.nl. Amsterdam UMC (7 mei 2024). Geraadpleegd op 12 mei 2024.
- ↑ (en) Caudle WM, Richardson JR, Delea KC, et al. Polychlorinated biphenyl-induced reduction of dopamine transporter expression as a precursor to Parkinson's disease-associated dopamine toxicity. (2006) Toxicol Sci 92:490-499. PMID 16702228 gratis volledige artikel.
- ↑ (en) Lock EA, Zhang J, Checkoway H. (1 februari 2013). Solvents and Parkinson disease: a systematic review of toxicological and epidemiological evidence.. Toxicology and Applied Pharmacology. 2013 Feb 1;266(3):345–55. 266 (3): 345–55. ISSN: 1096-0333. PMID 23220449. PMC 3621032. DOI: 10.1016/j.taap.2012.11.016. Dit is een open access artikel.
- ↑ Annals of Neurology, 2011 Vol. 69, Issue 2 Pages A9–A15, 221–431. Pallidal dysfunction drives a cerebellothalamic circuit into Parkinson tremor Rick C. Helmich MD1,2 et al.
- ↑ Foto gemaakt door Arthur Londe, uit Nouvelle Iconographie de la Salpètrière, vol. 5, p. 226
- ↑ Charcot, J.-M., & Sigerson, G. (1879). Lectures on the diseases of the nervous system, 2e editie. Henry C. Lea, Philadelphia, p. 113.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z Jankovic, J. (april 2008). Parkinson's disease: clinical features and diagnosis. Journal of Neurology, Neurosurgery, and Psychiatry 79 (4): 368–76. PMID 18344392. DOI: 10.1136/jnnp.2007.131045.
- ↑ A timeline for Parkinson's disease. Geraadpleegd op 13 februari 2020.
- ↑ (en) Goetz, C. G., Poewe, W., Rascol, O., Sampaio, C., Stebbins, G. T., Counsell, C., ... & Yahr, M. D. (13 juni 2004). Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations the Movement Disorder Society Task Force on rating scales for Parkinson's disease. Movement Disorders 19 (9): 1020–1028. DOI: 10.1002/mds.20213.
- ↑ a b c Samii, A., Nutt, J.G., Ransom, B.R. (29 mei 2004). Parkinson's disease. Lancet 363 (9423): 1183–93. PMID 15172778. DOI: 10.1016/S0140-6736(04)16305-8.
- ↑ Banich, M.T., & Compton, R.J. (2011). Cognitive neuroscience. Wadsworth, Cengage learning, Belmont, CA, VS, "Motor control", 108–44. ISBN 0-8400-3298-6.
- ↑ Longmore, Murray, Wilkinson, Ian B., Turmezei, Tom, & Cheung, Chee Kay (4 januari 2007). Oxford Handbook of Clinical Medicine. Oxford University Press, 486. ISBN 978-0-19-856837-7.
- ↑ O'Sullivan, Susan B., & Schmitz, Thomas J. (2007). Physical Rehabilitation, 5de editie. F.A. Davis, Philadelphia, "Parkinson's Disease", 856–57.
- ↑ Hauser, Robert A., Parkinson Disease Clinical Presentation: History, Physical Examination, Staging. eMedicine (6 juli 2016).
- ↑ Chou, Kelvin L., Parkinson disease symptoms and diagnosis. UptoDate (24 oktober 2014).
- ↑ Rodriguez-Oroz, M.C., Jahanshahi, M., Krack, P., Litvan, I., Macias, R., Bezard, E. & Obeso, J.A. (december 2009). Initial clinical manifestations of Parkinson's disease: features and pathophysiological mechanisms. Lancet Neurol 8 (12): 1128–139. PMID 19909911. DOI: 10.1016/S1474-4422(09)70293-5.
- ↑ (en) Yao, S.C., Hart, A.D., & Terzella, M.J. (mei 2013). An evidence-based osteopathic approach to Parkinson disease. Osteopathic Family Physician 5 (3): 96–101. DOI: 10.1016/j.osfp.2013.01.003.
- ↑ (en) Russell, J.A., Ciucci, M.R., Connor, N.P., & Schallert, T. (23 juni 2010). Targeted exercise therapy for voice and swallow in persons with Parkinson's disease. Brain Research 1341: 3–11. PMID 20233583. PMC 2908992. DOI: 10.1016/j.brainres.2010.03.029.
- ↑ a b c d e f g h (en) Caballol, N., Martí, M.J., & Tolosa, E. (september 2007). Cognitive dysfunction and dementia in Parkinson disease. Movement Disorders 22 (Suppl 17): S358–66. PMID 18175397. DOI: 10.1002/mds.21677.
- ↑ a b c (en) Parker, K.L., Lamichhane, D., Caetano, M.S., Narayanan, N.S. (oktober 2013). Executive dysfunction in Parkinson's disease and timing deficits. Front. Integr. Neurosci. 7. PMID 24198770. PMC 3813949. DOI: 10.3389/fnint.2013.00075.
- ↑ (en) Murray, Evan D., Buttner, Edgar A., & Price, Bruce H. (2012). Bradley's Neurology in Clinical Practice: Expert Consult – Online and Print, 6e (Bradley, Neurology in Clinical Practice e-dition 2v Set), 6de editie. Elsevier/Saunders, Philadelphia, PA, "Depression and Psychosis in Neurological Practice", 102–03. ISBN 1-4377-0434-4.
- ↑ a b (en) Ceravolo, R., Frosini, D., Rossi, C., & Bonuccelli, U. (december 2009). Impulse control disorders in Parkinson's disease: definition, epidemiology, risk factors, neurobiology and management. Parkinsonism Relat. Disord. 15 (Suppl 4): S111–15. PMID 20123548. DOI: 10.1016/S1353-8020(09)70847-8.
- ↑ Shergill, S.S., Walker, Z., & Le Katona, C. (oktober 1998). A preliminary investigation of laterality in Parkinson's disease and susceptibility to psychosis. J. Neurol. Neurosurg. Psychiatr. 65 (4): 610–11. PMID 9771806. PMC 2170290. DOI: 10.1136/jnnp.65.4.610.
- ↑ (en) Friedman, J.H. (juni 2010). Parkinson's disease psychosis 2010: A review article. Parkinsonism Relat. Disord. 16 (9): 553–60. PMID 20538500. DOI: 10.1016/j.parkreldis.2010.05.004.
- ↑ (en) Yeung, E.Y.H., & Cavanna, A.E. (2014). Sleep Attacks in Patients With Parkinson's Disease on Dopaminergic Medications: A Systematic Review. Movement Disorders Clinical Practice 1 (4): 307–16. DOI: 10.1002/mdc3.12063.
- ↑ (en) Barichella, M., Cereda, E., & Pezzoli, G. (oktober 2009). Major nutritional issues in the management of Parkinson's disease. Mov. Disord. 24 (13): 1881–92. PMID 19691125. DOI: 10.1002/mds.22705.
- ↑ (en) Armstrong, R.A. (maart 2008). Visual signs and symptoms of Parkinson's disease. Clin. Exp. Optom. 91 (2): 129–38. PMID 18271776. DOI: 10.1111/j.1444-0938.2007.00211.x.
- ↑ Double blind, delayed-start trial of rasagiline in Parkinson's disease; Olanow CW, Rascol O, Hauser R, Feigin PD, Jankovic J, Lang A, Langston W, Melamed E, Poewe W, Stocchi F, Tolosa E; ADAGIO Study Investigators. N Engl J Med. 2009 Sep 24;361(13):1268-78
- ↑ LeWitt PA et al. AAV2-GAD gene therapy for advanced Parkinson's disease: a double-blind, sham-surgery controlled, randomised trial. The Lancet Neurology, Volume 10, Issue 4, 309-331. Editorial: At last, a gene therapy for Parkinson's disease?. The Lancet Neurology, Volume 10, Issue 4, 290-291.
- ↑ De ziekte van Parkinson, een Ayurvedisch perspectief
- ↑ apotheek.nl Levodopa met Carbidopa
Aanvullende literatuur
- L. Backman & L. Farde (2005). The role of Dopamine systems in Cognitive Aging. In: Cognitive Neuroscience of Aging (pp. 58–84). Oxford University Press. ISBN 0-19-515674-9.
- Pirozzolo. F.J. e.a. (1982). Dementia in Parkinson disease: a neuropsychological analysis. Brain and Cognition, 71-83.
Externe links
- ParkinsonNet, voor patiënten en professionals met gecontroleerde informatie over de ziekte van Parkinson
- Parkinson Vereniging
- ParkinsonPlaza, informatie voor parkinsonpatiënten en hun omgeving
