Virus (biologie): verschil tussen versies
taalspecificatie is wel fijn denk ik, omdat veruit de meeste literatuur Engelstalig is |
Stuk erbij over afweer en bestrijding |
||
| Regel 151: | Regel 151: | ||
=== Kanker === |
=== Kanker === |
||
Aan het ontstaan van [[kanker]] liggen verschillende erfelijke en omgevingsfactoren ten grondslag. Van virussen is al sinds het begin van de twintigste eeuw een rol bij de ontwikkeling van tumoren vastgesteld (of tenminste aannemelijk gemaakt).<ref name="Oncologie">{{Citeer boek|auteur = Krieken J, Medema R. |datum = 2017 |titel = Leerboek oncologie | chapter = Fundamentele aspecten van kanker |uitgever =Bohn Stafleu van Loghum |ISBN = 978-90-368-0442-4|taal =en}} [https://repository.ubn.ru.nl/bitstream/handle/2066/202079/202079.pdf Vrije toegang tot hoofdstuk].</ref> De bekendste vormen van kanker die door virussen worden veroorzaakt zijn [[Hepatocellulair carcinoom|levercarcelcinoom]] en [[baarmoederhalskanker]], respectievelijk door het [[hepatitis B-virus]] en het [[humaan papillomavirus]].<ref>{{Citeer journal|auteur=Hausen, H. |jaar= 1991 |titel=Viruses in human cancers |journal=Science |volume=254 |issue= 5035|pages=1167-1173|doi= 10.1126/science.1659743|taal=en}}</ref> Andere carcinogene virussen zijn bijvoorbeeld het [[epstein-barrvirus]], [[merkelcelpolyomavirus]] en [[humaan herpesvirus 8]]. Het mechanisme waarmee deze virussen kanker verwekken is grondig bestudeerd. Tijdens een infectie integreert het virale genoom in het DNA van de gastheercel. Bepaalde genen van de gastheer, bijvoorbeeld genen die betrokken zijn bij de [[celcyclus]]- en [[celgroei]]machinerie, kunnen daarbij ontregeld raken. Via een complex, meerstapsproces zal de getroffen cel zich uiteindelijk ongebreideld gaan delen en een tumor veroorzaken.<ref name="Oncologie" /> De frequentie van virale kankers kan preventief worden verminderd door vaccinatie of therapeutisch door de infecties te behandelen.<ref>{{citeer web| auteur=Udakis, L.| titel=Viruses and cancer| taal=en| uitgever= Microbiology society | datum = 2012 | accessdate= 04-02-2021 | url = https://microbiologysociety.org/publication/briefing/viruses-and-cancer.html}}</ref> |
Aan het ontstaan van [[kanker]] liggen verschillende erfelijke en omgevingsfactoren ten grondslag. Van virussen is al sinds het begin van de twintigste eeuw een rol bij de ontwikkeling van tumoren vastgesteld (of tenminste aannemelijk gemaakt).<ref name="Oncologie">{{Citeer boek|auteur = Krieken J, Medema R. |datum = 2017 |titel = Leerboek oncologie | chapter = Fundamentele aspecten van kanker |uitgever =Bohn Stafleu van Loghum |ISBN = 978-90-368-0442-4|taal =en}} [https://repository.ubn.ru.nl/bitstream/handle/2066/202079/202079.pdf Vrije toegang tot hoofdstuk].</ref> De bekendste vormen van kanker die door virussen worden veroorzaakt zijn [[Hepatocellulair carcinoom|levercarcelcinoom]] en [[baarmoederhalskanker]], respectievelijk door het [[hepatitis B-virus]] en het [[humaan papillomavirus]].<ref>{{Citeer journal|auteur=Hausen, H. |jaar= 1991 |titel=Viruses in human cancers |journal=Science |volume=254 |issue= 5035|pages=1167-1173|doi= 10.1126/science.1659743|taal=en}}</ref> Andere carcinogene virussen zijn bijvoorbeeld het [[epstein-barrvirus]], [[merkelcelpolyomavirus]] en [[humaan herpesvirus 8]]. Het mechanisme waarmee deze virussen kanker verwekken is grondig bestudeerd. Tijdens een infectie integreert het virale genoom in het DNA van de gastheercel. Bepaalde genen van de gastheer, bijvoorbeeld genen die betrokken zijn bij de [[celcyclus]]- en [[celgroei]]machinerie, kunnen daarbij ontregeld raken. Via een complex, meerstapsproces zal de getroffen cel zich uiteindelijk ongebreideld gaan delen en een tumor veroorzaken.<ref name="Oncologie" /> De frequentie van virale kankers kan preventief worden verminderd door vaccinatie of therapeutisch door de infecties te behandelen.<ref>{{citeer web| auteur=Udakis, L.| titel=Viruses and cancer| taal=en| uitgever= Microbiology society | datum = 2012 | accessdate= 04-02-2021 | url = https://microbiologysociety.org/publication/briefing/viruses-and-cancer.html}}</ref> |
||
==Afweer en bestrijding== |
|||
===Immuunsysteem=== |
|||
{{Zie ook|Meer informatie: [[Immuunsysteem]]}} |
|||
Gewervelde dieren hebben een complex afweersysteem om virale infecties te bestrijden. Orgaansystemen van dieren zijn allereerst omgeven door dicht op elkaar liggende [[epitheel]]cellen. Deze cellen vormen een fysieke en chemische barrière voor ziekteverwekkers: ze produceren slijm en vocht die afvoerend werken en rijk zijn aan antimicrobiële stoffen. Daarnaast komen in het lichaam [[fagocyt]]en voor: grote witte bloedcellen die lichaamsvreemde deeltjes, waaronder virussen en bacteriën, aftasten en opruimen. Het epitheel en de fagocyten zijn onderdeel van het ''aangeboren immuunsysteem''. Het aangeboren immuunsysteem is vaak voldoende om een infectie te voorkomen. Wanneer een virusdeeltje toch het lichaam binnendringt en zich vermenigvuldigt, komt het ''verworven immuunsysteem'' op gang, dat specifiek de ingedrongen virussoort zal aanvallen en elimineren.<ref>{{Citeer boek|auteur = Rijkers G, Kroese F, Kallenberg C. |datum =2016 |titel = Immunologie|uitgever =Bohn Stafleu van Loghum |ISBN = 978-90-368-0257-4|page=26|taal =nl}}</ref> |
|||
[[Bestand:HIV-infected T cell (6813384933).jpg|thumb|Een [[T-cel]] die door [[hiv]] geïnfecteerd is]] |
|||
De verworven afweer is erop gericht zowel vrije virusdeeltjes als geïnfecteerde lichaamscellen te neutraliseren. Het belangrijkste mechanisme om virusdeeltjes te bestrijden is de productie van [[antilichaam|antilichamen]] (humorale afweer). Antilichamen zijn eiwitten die aan de bloedbaan worden afgegeven en zich specifiek aan de viruscapside kunnen binden. Na binding is het virus niet langer infectieus. Zoogdieren produceren een breed scala aan antilichamen. Vooral [[IgM]] en [[IgG]] zijn voor neutralisatie van virussen van belang.{{Refn|group=kleine-letter|IgM wordt slechts enkele weken door de cellen van het immuunsysteem geproduceerd. IgG wordt voor onbepaalde tijd geproduceerd en is vooral actief in het bloedserum.<ref>{{Citeer boek|auteur =Baron S. |datum = 1996|titel = Medical Microbiology, 4th edition|chapter = Chapter 50: Immune Defenses|ISBN =0-9631172-1-1|taal =en}} [https://www.ncbi.nlm.nih.gov/books/NBK8423/ Vrije toegang tot hoofdstuk].</ref>}} Hoge waarden van IgG in het bloed wijst meestal op [[afweer|immuniteit]]. |
|||
De bestrijding van geïnfecteerde cellen gebeurt via [[cytotoxische T-cel]]len (cellulaire afweer). Lichaamscellen die geïnfecteerd zijn door een virus zullen [[antigeen|antigenen]] – kleine fragmentjes van de virale eiwitten – presenteren op hun membraan. Wanneer een T-cel een verdacht antigeen tegenkomt, zal de cel door speciale cytotoxische T-cellen worden gedood en opgeruimd. De cellulaire afweer tegen virussen wordt begunstigd door [[interferon]]en. Dat zijn hormoonachtige stofjes die met de virusreplicatie interfereren.<ref name="pmid11256746">{{citeer journal | auteur = Le Page C, Génin P, Baines MG, Hiscott J. | title = Interferon activation and innate immunity | journal = Reviews in Immunogenetics | volume = 2 | issue = 3 | pages = 374-86 | year = 2000 | taal=en| pmid = 11256746 }}</ref> |
|||
Veel virussen blijken de afweermechanismen van de gastheer te kunnen beïnvloeden, waardoor zij de immuunrespons omzeilen. [[Hiv]] ontwijkt het immuunsysteem bijvoorbeeld door voortdurend de aminozuursequentie van zijn capside-eiwitten te veranderen (antigeenvariatie). De immuunrespons van de gastheer is hierdoor altijd aspecifiek en het virus veroorzaakt een [[chronische ziekte|chronische infectieziekte]]. Andere ontwijkingsstrategieën zijn onder meer remming van fagocytose of antigeenpresentatie, resistentie tegen [[cytokine]]n en ontsnapping aan [[apoptose]].<ref name="pmid15297608">{{citeer journal | auteur = Hilleman MR | title = Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 101 |issue= 2 | pages = 14560–66 | date = 2004 | taal=en| pmid = 15297608 | doi = 10.1073/pnas.0404758101}}</ref><ref>{{nl}}{{sc|Hoepelman}} ''et al''. pp. 35–36.</ref> |
|||
===Preventie en behandeling=== |
|||
Een virus is volledig afhankelijk van de stofwisseling en machinerie van de gastheercel. Om deze reden is het moeilijk een gerichte behandeling tegen een virusinfectie te ontwikkelen die geen schade toebrengt aan de gastheer zelf. Immers, processen remmen die ook voor de gastheercel zelf van belang zijn, leidt snel tot toxische effecten van de behandeling. De meest effectieve geneeskundige benadering om virusziekten tegen te gaan is [[vaccinatie]]. Voorts is er ook een aantal [[antivirale middelen]] ontwikkeld die specifiek op de virale processen ingrijpen en de replicatiecyclus verhinderen. |
|||
====Vaccins==== |
|||
Vaccinatie is de meest succesvolle toepassing van immunologische principes in de gezondheidszorg. Een [[vaccin]] wordt gedefinieerd een middel dat een gerichte immuunrespons opwekt zonder dat daarbij ziekteverschijnselen ontstaan. Na toediening is het gevaccineerde individu beschermd tegen de betreffende ziekteverwekker. Al lang voor de ontdekking van virussen werd vaccinatie toegepast om infectieziekten te voorkomen. Het inzetten van vaccins bij grote delen van de bevolking heeft geleid ertoe geleid dat de [[morbiditeit]] (ziekte) en [[mortaliteit]] (overlijden) van virusziekten als [[polio]], [[mazelen]], [[bof]] en [[rodehond|rubella]] in de loop der jaren drastisch gedaald zijn.<ref>{{Citeer journal|auteur=Greenwood, B. |jaar= 2014|titel= The contribution of vaccination to global health: past, present and future|journal= Philos Trans R Soc Lond B Biol Sci|volume= 369|issue= 1645|pages=20130433|doi= 10.1098/rstb.2013.0433|taal=en}}</ref><ref>{{Citeer web| taal = en | auteur = Andre F, Booy R, Bock H, Clemens J.| titel= Vaccination greatly reduces disease, disability, death and inequity worldwide | uitgever=Bulletin of the World Health Organization | url= https://www.who.int/bulletin/volumes/86/2/07-040089/en/ | datum= 2008 | accessdate=26-02-2021}}</ref> [[Pokken]] en [[runderpest]] zijn dankzij vaccinatie reeds uitgeroeid.<ref>{{Citeer journal|auteur= Roser M, Ochmann S, Behrens H, Ritchie H, Dadonaite B. |jaar=2014 |titel= Eradication of Diseases |journal=Our World in Data |url=https://ourworldindata.org/eradication-of-diseases|taal=en|accessdate=26-02-2021}}</ref> Om vaccins te produceren worden [[biotechnologie|biotechnologische]] technieken aangewend. Klassieke vaccinpreparaten bestaan uit [[geïnactiveerd vaccin|gedode]] of sterk [[levend vaccin|verzwakte]] virusdeeltjes. Deze zijn dus niet meer ziekteverwekkend, maar bevatten wel de antigenen om het immuunsysteem te activeren. Ook kan een vaccin worden bereid dat uitsluitend de capside-eiwitten bevat ([[subunit-vaccin]]). Door toevoeging van een [[immunologisch adjuvant|adjuvant]], zoals aluminiumzouten, kan de werkzaamheid van vaccins sterk worden verhoogd.<ref>{{Citeer boek|auteur = Rijkers G, Kroese F, Kallenberg C. |datum =2016 |titel = Immunologie|uitgever =Bohn Stafleu van Loghum |ISBN = 978-90-368-0257-4|pages=430-433|taal =nl}}</ref> |
|||
====Antivirale middelen==== |
|||
[[Bestand:Guanosine-acyclovir-comparison.png|thumb|upright=0.65|De structuur van de DNA-base [[guanosine]] en het antivirale middel [[aciclovir]]]] |
|||
[[Antivirale middelen]] zijn stoffen die interfereren met de replicatiecyclus van virussen. De meeste antivirale middelen die op de markt zijn gebracht behoren tot de [[Nucleosideanalogon|nucleosideanalogen]]: op DNA-bouwstenen gelijkende moleculen die virussen tijdens replicatie onbedoeld in hun genoom opnemen. Vanaf het moment dat een nucleosideanalogon is ingebouwd, stopt de polymerisatie van de keten. Het genetisch materiaal kan dan niet verder worden gekopieerd. Voorbeelden van bekende nucleosideanalogen zijn [[aciclovir]], [[stavudine]] en het recente [[remdesivir]].<ref>{{Citeer boek|auteur =Bogner E, Holzenburg A. |datum = |titel =New Concepts of Antiviral Therapy |uitgever = Springer Science & Business Media|ISBN = 978-0-387-31047-3 |pages= 191-195|taal =en}}</ref><ref>{{Citeer journal|auteur= De Clercq E, Li G.|jaar= 2016|titel= Approved Antiviral Drugs over the Past 50 Years |journal= Clinical Microbiology Reviews|volume= 29|issue= 3|pages=695-747|doi= 10.1128/CMR.00102-15|taal=en}}</ref> Antivirale middelen kunnen ook de vasthechting aan de gastheercel verhinderen of virale enzymen blokkeren. |
|||
De meeste virusremmers zijn slechts werkzaam tegen specifieke soorten en hebben dus een geringe therapeutische breedte. Tegen [[hiv]], [[hepatitis B]] en [[hepatitis C|C]], [[herpesvirussen]] en [[influenzavirus]]sen bestaat inmiddels een uitgebreid arsenaal aan antivirale middelen, maar tegen veel andere virusinfecties nog niet of nauwelijks. Om resistentie tegen antivirale middelen te voorkomen worden vaak combinatietherapieën toegepast. Het voorschrijven van meerdere virusremmers met verschillende aangrijpingspunten vergroot het antivirale effect en beperkt de kans op resistentie aanzienlijk.<ref name>{{nl}}{{sc|Hoepelman}} ''et al''. pp. 52–53.</ref> |
|||
== Ontstaan en evolutie van virussen == |
== Ontstaan en evolutie van virussen == |
||
| Regel 173: | Regel 198: | ||
Anno 2020 heeft nog geen van deze hypotheses geleid tot een sluitende theorie voor het ontstaan van virussen, en vindt er continu wetenschappelijk onderzoek plaats om de vragen te beantwoorden over de herkomst van virussen. |
Anno 2020 heeft nog geen van deze hypotheses geleid tot een sluitende theorie voor het ontstaan van virussen, en vindt er continu wetenschappelijk onderzoek plaats om de vragen te beantwoorden over de herkomst van virussen. |
||
== Bestrijding van een virusinfectie == |
|||
Een virus[[infectie]] verloopt volgens een ander mechanisme dan een [[bacteriën|bacteriële]] of een [[schimmelinfectie]], en kan niet met [[antibiotica]] of [[antimycotica]] worden bestreden. Er zijn [[stof (scheikunde)|stoffen]] die specifiek de werking van sommige typen virussen verstoren, en die als [[geneesmiddel]] kunnen worden ingezet. Deze zogeheten [[antivirale middelen]] werken doordat zij het koppelen van virussen aan de gastheercel bemoeilijken, of doordat ze de werking van de virale enzymen in de gastheercel blokkeren. |
|||
== Virussen: levend of niet? == |
== Virussen: levend of niet? == |
||
Versie van 27 feb 2021 00:56
Een virus is een submicroscopisch infectieus deeltje dat zich uitsluitend kan vermenigvuldigen in levende cellen.[1] Alle bekende levensvormen kunnen door een virus geïnfecteerd worden, van dieren en planten tot micro-organismen zoals bacteriën en archaea. Virussen komen voor in vrijwel elk ecosysteem en zijn zeer talrijk aanwezig in lucht, water en bodem. De wetenschap die virussen onderzoekt heet de virologie, een deelgebied van de microbiologie.
Wanneer een virus een cel infecteert, zal deze cel – de zogenaamde gastheercel – duizenden identieke kopieën van het oorspronkelijke virus gaan produceren. Een individueel virusdeeltje, of virion, bestaat uit: genetisch materiaal, een lang DNA- of RNA-molecuul dat codeert voor eiwitten; een eiwitmantel, de capside, die het genetisch materiaal omgeeft en beschermt; en in sommige gevallen, een buitenomhulsel van lipiden, de envelop. De meeste virussen zijn te klein om met een lichtmicroscoop te worden waargenomen; ze zijn ongeveer honderd keer zo klein als de meeste bacteriën.
De evolutionaire oorsprong van virussen is onduidelijk. Virussen zijn vermoedelijk verschillende keren ontstaan uit ‘ontsnapte’ stukken DNA of RNA van levende organismen. Over de vraag of virussen zelf levend zijn, bestaat eveneens geen consensus. Hoewel ze genetisch materiaal bezitten en evolueren, hebben ze geen eigen stofwisseling en zijn ze voor hun replicatie volledig afhankelijk van hun gastheer. Virussen zijn om deze reden wel omschreven als "organismen aan de rand van het leven" en als zelfreplicatoren.[2][3]
Virussen zijn formidabele ziekteverwekkers voor de mens, landbouwgewassen en vee. Gewervelde dieren beschikken over een complex afweermechanisme tegen virussen. Sommige virussen, zoals herpesvirussen of hiv, kunnen aan het immuunsysteem ontsnappen en veroorzaken dan een chronische infectieziekte. Ter voorkoming van een virale infectie zijn verschillende vaccins ontwikkeld. Door succesvolle vaccinatiestrategieën zijn enkele virale infectieziekten inmiddels uitgeroeid.
Microbiologie
Structuur
De meeste virussen zijn ongeveer honderd keer zo klein als een bacteriële cel. De diameter ligt gewoonlijk tussen de 20 en 300 nanometer. De uitwendige structuur (morfologie) is uiteenlopend. De meeste virussen zijn niet met een lichtmicroscoop waar te nemen: onderzoekers maken gebruik van elektronenmicroscopen om hun structuur te ontrafelen.[4] Om het contrast tussen virusdeeltjes en de achtergrond te vergroten, worden de virusdeeltjes gekleurd met oplossingen van zware metalen, zoals wolfraam, die de elektronen verstrooien. De verstrooide elektronen worden opgevangen door een detector, zodat het virusdeeltje digitaal wordt afgetekend.[5]
Het complete virusdeeltje, zoals het buiten de gastheercel voorkomt, noemt men het virion en bestaat uit een nucleïnezuur omgeven door een beschermende eiwitmantel, de capside. De capside is opgebouwd uit meerdere identieke subunits (capsomeren).[4] Sommige virussen hebben hieromheen een envelop van lipiden. De capside wordt gecodeerd door het virale genoom en de vorm ervan is bepalend voor het morfologisch onderscheid tussen virussoorten.[6] De capside is relatief stevig en kan mechanisch worden onderzocht door middel van atoomkrachtmicroscopie.[7] Er wordt globaal onderscheid gemaakt tussen vier morfologieën:
- Helixvormig
- Deze virussen zijn samengesteld uit één type capsomeer dat rond een centrale as is gewonden tot een lange, spiraalvormige structuur. Het genetische materiaal (meestal enkelstrengs RNA), wordt binnen de eiwithelix gestabiliseerd door interacties tussen het negatief geladen nucleïnezuur en de positief geladen eiwitten. De lengte van de capside verhoudt zich met de lengte van het nucleïnezuur; de breedte is afhankelijk van de grootte en rangschikking van capsomeren. Het tabaksmozaïekvirus is een voorbeeld van een helixvirus.[4]
- Icosaëdrisch
- De meeste virussen die dieren infecteren hebben de vorm van een icosaëder (twintigvlak). Een regelmatige icosaëder is de optimale manier om een stabiele, gesloten mantel te vormen uit identieke capsomeren. Het minimaal vereiste aantal capsomeren is twaalf, elk samengesteld uit vijf identieke subunits. Veel virussen, zoals het rotavirus, hebben meer dan twaalf capsomeren en lijken daardoor bijna bolvormig.[4]
- Omgeven door een envelop
- Sommige virussoorten zijn omgeven door een buitenomhulsel (envelop), bestaande uit een dubbellaag van lipiden. Deze envelop maakt het virus niet zelf aan, maar is afgeleid van het celmembraan van de gastheer. Bekende voorbeelden van virussen met een envelop zijn influenzavirussen, hiv en coronavirussen.[8] Dergelijke virussen zijn voor hun infectiviteit afhankelijk van hun envelop: wanneer deze wordt vernietigd (bijvoorbeeld door zeep) dan wordt het virion inactief.[4]
- Complex
- Deze virussen hebben een capside die uit zowel een helix als icosaëder bestaat, en vaak nog extra structuren bezit zoals eiwitstaarten of een complexe buitenwand. Vooral bacteriofagen vertonen dergelijke complexe structuren: deze virussen hebben een icosaëdrische kop die in verbinding staat met een helixvormige staart, een zeshoekige basis en enkele uitstekende eiwitfilamenten (pootjes). Hun 'lichaam' werkt als een soort moleculaire injectiespuit. De faag hecht zich met zijn pootjes aan de bacteriële gastheer vast en injecteert vervolgens zijn virale genoom naar binnen.[9]
Virussen die afwijken van deze gangbare morfologieën zijn onder meer het pokkenvirus en het mimivirus. Het pokkenvirus bevat een schijfvormige structuur, de nucleoïde, waarin het genetisch materiaal is opgeslagen. Hieromheen bevindt zich een inwendig membraan. Het pokkenvirus is pleomorf en kan zowel ovale als rechthoekige vormen aannemen.[10] Het mimivirus is een reuzenvirus; de capside is meer dan 400 nm breed en heeft een draderig oppervlak. Reuzenvirussen zijn zo groot, dat sommige soorten in eerste instantie werden aangezien als bacteriën. Het mimivirus heeft een opmerkelijk groot genoom, waarin genen voorkomen die zelfs voor een rudimentaire stofwisseling coderen.[11] Ten slotte zijn er nog virussen die archaea infecteren. Ook veel van deze virussen vertonen een ongewone structuur.[12]
- Elektronenmicroscopische opnames van virusdeeltjes die uit cellen vrijkomen
-
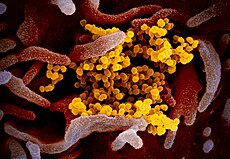
Het nieuwe coronavirus SARS-CoV-2 (geel) uit gekweekte cellen van een patiënt
-
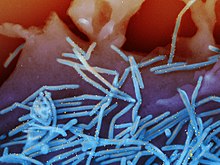
Het respiratoir syncytieel virus (blauwe staafjes) op longepitheelcellen
-
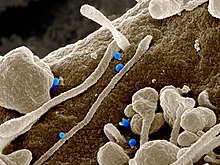
Het Krim-Congo-hemorragische koortsvirus (blauw) uit cellen van een patiënt
Genoom
| Eigenschap | Parameters |
|---|---|
| Nucleïnezuur |
|
| Vorm |
|
| Streng-configuratie |
|
| Sense |
|
Het genetisch materiaal (genoom) van virussen is uitgesproken divers en variabel. Virussen vertonen een grotere diversiteit in genoomstructuur dan alle planten, dieren, archaea of bacteriën bijeen. De kleinste virussen hebben maar drie genen, de grootste hebben er honderden of duizenden. Er zijn miljoenen verschillende soorten virussen bekend, maar slechts 7.000 soorten zijn in detail beschreven.[13] Vanaf het begin van de eenentwintigste eeuw raakte sequencing van virussen in een stroomversnelling.[14][15] In 2020 telde de database van het NCBI meer dan 190.000 complete genoomsequenties.
Alle levende wezens op aarde hebben een genoom dat opgebouwd is uit dubbelstrengs DNA. Virussen onttrekken zich aan deze wetmatigheid: hun genomen bestaan ofwel uit DNA of uit RNA, en zijn vervolgens ofwel dubbelstrengs ofwel enkelstrengs.[1] Virussen die klinisch relevant zijn voor de mens hebben meestal kleine genomen en bestaan uit dubbelstrengs DNA of enkelstrengs RNA. Van vrijwel al deze virussen is het genoom ontcijferd en geannoteerd.
Een viraal genoom kan lineair of circulair zijn. Lineaire genomen hebben twee uiteinden, net zoals bij de chromosomen van de mens. Een circulair genoom is een gesloten ring en heeft een grotere stabiliteit. Bij sommige virussen is het genoom opgedeeld in een aantal losse stukken die onafhankelijk functioneren. Dergelijke genomen wordt gesegmenteerd genoemd. Bij RNA-virussen codeert elk segment vaak voor één eiwit. Soms komen de segmenten in verschillende virions voor.[16]
Enkelstrengse virale genomen kunnen ofwel sense (positief) of antisense (negatief) zijn, afhankelijk van hun nucleotidesequentie. In het geval van de sense-configuratie is de nucleotidevolgorde exact hetzelfde als in het virale mRNA dat eruit gevormd wordt na transcriptie. Een genoom in de antisense-configuratie is daarentegen complementair ten opzichte van hun mRNA.[1]
Genetische mutatie
Virussen hebben een sterk muterend karakter. De genetische code van een virus is in vergelijking met organismen relatief instabiel en ondergaat voortdurend veranderingen: mutaties. Veranderingen in het genetisch materiaal van een virus kunnen leiden tot veranderingen in de functie van virale eiwitten. Hierdoor ontstaan er nieuwe virale serotypen of virussen met een sterkere virulentie of infectiviteit.
Er zijn twee mechanismen te onderscheiden waarbij de genetica van virussen verandert:
- Het best bestudeerde mechanisme is antigene drift. Dit is het proces waarbij kleine mutaties (puntmutaties) optreden en na verloop van tijd accumuleren. Hoewel deze mutaties individueel gezien geen invloed hebben op de eigenschappen van het virus, leveren ze het virus gezamenlijk een subtiel evolutionair voordeel op. Antigene drift kan ervoor zorgen dat virussen resistentie ontwikkelen tegen een antiviraal middel of ontsnappen aan het immuunsysteem.[17][18]
- Soms komt het voor dat twee stukken genetisch materiaal, afkomstig van twee verschillende virussen, door middel van recombinatie of reassortment vermengd raken tot een nieuw genoom. Doordat er sprake is van een totaal nieuwe combinatie van genetisch materiaal, ontstaat er een nieuw subtype virus. Dit proces noemt men antigene shift. De jaarlijkse terugkeer van een nieuw griepvirus is hieraan toe te schrijven. In bijzondere gevallen kan een pandemie ontspringen aan een antigene shift.[19] Ook bij gesegmenteerde virussen is dit mogelijk. De genoomsegmenten van deze virussen kunnen zodanig recombineren dat er 'nakomelingen' ontstaan met nieuwe unieke kenmerken. Recombinatie komt voor in zowel RNA- als DNA-virussen.[18]
Replicatiecyclus
Een virusdeeltje kan zich niet zelfstandig voortplanten. Om zich te vermenigvuldigen (repliceren), is het virus genoodzaakt om gebruik te maken van de stofwisseling en machinerie van een levende gastheercel. Een virale infectie begint met een virion die zich vasthecht aan het oppervlak van een gastheercel. Het virusdeeltje brengt zijn virale DNA of RNA de gastheercel in. De cel wordt hierdoor geprogrammeerd om duizenden kopieën van het oorspronkelijke virus aan te maken. Nadat het genetisch materiaal en de capside-eiwitten zijn aangemaakt, voegen deze zich spontaan samen tot nieuwe virions. De duizenden virions komen vrij en kunnen nieuwe cellen infecteren.[1]
De replicatiecyclus kent vijf belangrijke stappen:
- Aanhechting. Het virion hecht zich vast aan het oppervlak van een geschikte gastheercel. Eiwitten die zich op de capside bevinden gaan interacties aan met eiwitten op de gastheercel. Alleen bij een sterke interactie vindt vasthechting plaats.[20]
- Internalisatie. Het genetisch materiaal wordt naar binnen geleid. Bij dierlijke cellen zal het hele virion de gastheercel binnengaan. Bij cellen met een celwand (planten en bacteriën), wordt het genoom meestal geïnjecteerd, terwijl de capside buiten blijft.[21]
- Synthese. Het vrijgekomen genetisch materiaal wordt in de cel gekopieerd (replicatie) en door ribosomen vertaald tot virale eiwitten (translatie). Er worden zowel structuureiwitten als enzymen aangemaakt
- Assemblage. Het gekopieerde genetisch materiaal wordt met nieuwe capside-eiwitten verpakt tot nieuwe virions. Dit assemblageproces verloopt spontaan.[b]
- Vrijlating. De virions verlaten de cel door middel van afsnoering of lyse. Bij afsnoering blijft de cel in leven, bij lyse barst de cel open terwijl de virions vrijkomen.
Replicatie van dierlijke virussen
Een belangrijk aspect bij de infectie van mens of dier is de aanwezigheid van de virusenvelop. Veel dierlijke virussen, met name de RNA-virussen, zijn omgeven door een lipide dubbellaag (envelop). In de envelop zijn uitstekende glycoproteïnen verankerd die een binding aangaan met receptoren op de gastheercel. Na vasthechting wordt het virion door middel van endocytose of membraanfusie opgenomen.

Binnen de cel wordt het genetisch materiaal gekopieerd en getransleerd. Synthese van de virale glycoproteïnen vindt plaats in het endoplasmatisch reticulum en golgi-apparaat. Vanuit daar worden de eiwitten getransporteerd naar de buitenzijde van het celmembraan. De nieuwe virions zullen vervolgens de cel verlaten en daarbij een deel van het celmembraan, inclusief de virale glycoproteïnen, om zich heen sluiten (afsnoering).[22] Sommige virussen ontlenen hun envelop niet aan het celmembraan maar aan het kernmembraan of golgi-apparaat. Dit is bijvoorbeeld het geval bij herpesvirussen.[23]
De meest ingewikkelde replicatiecyclus komt voor bij een groep RNA-virussen die retrovirussen worden genoemd. Deze virussen beschikken over een speciaal enzym genaamd reverse-transcriptase. Dit enzym kan een DNA-molecuul synthetiseren op basis van een RNA-sjabloon.[c] Wanneer een retrovirus een cel infecteert, zal het reverse-transcriptase een viraal DNA-molecuul produceren. Dit losse DNA-molecuul integreert in een van de chromosomen van de gastheer. Het virale DNA wordt nu door de cel tot expressie gebracht. De geïnfecteerde gastheercel is veranderd in een duurzame virusproducent. Van medisch belang is het retrovirus hiv dat de dodelijke ziekte aids veroorzaakt. De replicatiecyclus van hiv is exemplarisch voor alle retrovirussen.[22]
Replicatie van bacteriofagen
Van alle bekende virussen zijn bacteriofagen veruit het best bestudeerd.[24] Onderzoek naar bacteriofagen heeft duidelijk gemaakt dat deze en sommige andere virussen twee karakteristieke replicatiecycli gebruiken om zich te vermenigvuldigen: de lytische cyclus en de lysogene cyclus.[25] Kenmerkend voor de lytische cyclus is het laatste stadium van de infectie, waarbij de bacteriële cel lyseert (openbarst) terwijl de fagen vrijkomen. Dergelijke fagen (virulente fagen) kunnen binnen enkele uren een volledige bacteriële kolonie vernietigen. De meeste bacteriofagen leven echter samen met hun gastheer in de lysogene cyclus. Deze cyclus laat toe dat een faag zich repliceert zonder de gastheercel te doden. Het genoom van de faag integreert in het chromosoom van de bacterie en wordt zo doorgegeven aan dochtercellen. Op een gegeven moment kan het virus loskomen en de lytische cyclus activeren.[22]
Gastheerbereik

Bij alle vormen van leven zijn virussen bekend. Planten, dieren en schimmels, maar ook eencellige protisten (bijvoorbeeld amoeben) zijn gastheren voor virussen. Ook prokaryoten, dus bacteriën en archaea, kunnen door virussen geïnfecteerd worden. Virussen zijn meestal gespecialiseerd op een beperkt aantal gastheren. Interacties tussen de capside van het virus en receptoren op de cel zorgen ervoor dat het virus zich alleen aan een specifieke gastheercel kan hechten. Vermoedelijk zijn deze receptoren evolutionaire overblijfselen die de gastheercel oorspronkelijk een voordeel boden, maar later hun functie verloren en toen door virussen werden aangegrepen voor infectie.[22]
Sommige virussen hebben een breed gastheerbereik. Het westnijlvirus is bijvoorbeeld in staat om muggen, vogels, paarden en mensen te infecteren.[26] Andere virussen hebben een veel smaller gastheerbereik en zijn maar voor één specifieke soort besmettelijk. Zo is het mazelenvirus geheel op de menselijke soort gespecialiseerd. Een virale infectie is bovendien vaak beperkt tot een bepaald weefseltype. Het verkoudheidsvirus slaat bijvoorbeeld alleen toe in de epitheelcellen van de luchtwegen, en het hiv bindt alleen aan receptoren die voorkomen op bepaalde immuuncellen.[22]
Virusziekten bij de mens

Virussen zijn de oorzaak van een grote verscheidenheid aan menselijke ziekten. Voorbeelden van bekende virale infectieziekten zijn onder meer verkoudheid, griep, waterpokken en koortslip. Ernstigere ziekten zoals hondsdolheid, ebola, aids, vogelpest en SARS hebben eveneens een virale etiologie. De mate waarin een virus zijn gastheer ziek maakt noemt men de virulentie. De virulentie van een soort hangt meestal van meerdere eigenschappen af en kan in de tijd toenemen door het verwerven van virulentiegenen.[28]
Ziekteverschijnselen van virale infecties kunnen op verschillende wijzen tot stand komen. Lyserende virussen ontregelen de cel tijdens hun replicatie in dusdanige mate dat de cel doodgaat en uiteenvalt. Bij meercellige organismen leidt dit tot weefselschade en mogelijk zelfs tot orgaanfalen. Naast directe celdood kan een virale infectie ook aanleiding geven tot een overmatige immuunrespons. Het lichaam geeft dan teveel antilichamen, ontstekingsstimulerende cytokinen of complement-eiwitten af, waardoor de lichaamseigen cellen beschadigd raken en koortsachtige symptomen ontstaan.[29]
Hoewel virussen de gezondheid van een organisme kunnen verstoren, zijn er ook veel soorten die ongemerkt met de gastheer samenleven. Een bekend voorbeeld is het herpes-simplexvirus, dat maandenlang in dormante toestand in het menselijk lichaam kan circuleren. Dit fenomeen wordt latentie genoemd en komt ook voor bij andere herpesvirussen, waaronder het epstein-barrvirus, dat klierkoorts veroorzaakt, en het varicella-zostervirus, dat waterpokken en gordelroos veroorzaakt.[30] Onder bepaalde omstandigheden kan een latent virus voordelig zijn voor de gastheer, doordat ze het immuunsysteem versterkt.[31]
Epidemiologie en virusuitbraken
De epidemiologie (Grieks: epidemos = onder het volk voorkomend) bestudeert het voorkomen en de verspreiding van ziekten in populaties. Ze probeert de determinanten van een ziekte op te sporen door het verzamelen van kwantitatieve gegevens. De virale epidemiologie is er op gericht manieren te vinden om de verspreiding van virussen in kaart te brengen en in te perken. Met behulp van statistische modellen kunnen epidemiologen de effecten voorspellen van interventies zoals immunisaties, groepsbehandelingen, screening en isolatiemaatregelen.[32]
Het belangrijkste verspreidingsmechanisme van virussen in populaties is horizontale overdracht, overdracht van persoon tot persoon.[d] Horizontale overdracht treedt op bij fysiek contact en uitwisseling van lichaamsvloeistoffen. Hieronder vallen ook uitgeademde aerosolen waarin virusdeeltjes voorkomen en dierlijke vectoren (muggen, vlooien en teken) die het virus van gastheer naar gastheer brengen.[33] Karakteristiek voor virussen is dat ze vaak gespecialiseerd zijn in een specifieke overdrachtsroute. De snelheid waarmee virale infecties worden overgedragen, hangt af van factoren als bevolkingsdichtheid, het aandeel vatbare individuen, de kwaliteit van de gezondheidszorg en het seizoen.[34][35]
Epidemiologen zoeken naar manieren om de infectieketen tijdens een virusuitbraak te doorbreken. Een eerste stap is het vinden van de bron van de uitbraak en identificatie van het virus. Wanneer de virusstam bekend is, kan de transmissieketen worden doorbroken door het opbouwen van groepsimmuniteit, idealiter via vaccinatie.[32] Totdat een vaccin is ontwikkeld, zijn sanitaire voorzieningen en ontsmetting van groot belang om de mens en omgeving vrij te houden van virusdeeltjes. Na een zekere incubatieperiode – de tijd tussen moment van besmetting en de eerste symptomen – begint er een periode van overdraagbaarheid: de tijd waarin een besmet individu een ander kan besmetten. Kennis van de lengte van beide periodes is essentieel bij het beheersen van uitbraken.[36]
Epidemieën en pandemieën

Wanneer een zeer hoog aantal individuen in een populatie, gemeenschap of regio besmet raken, spreekt men van een epidemie. Een epidemie die grote delen van de wereld treft, wordt een pandemie genoemd. Recente voorbeelden van pandemieën zijn aids, de Mexicaanse griep en ziekten van nieuwe coronavirussen.[36] Bij de opkomst en neergang van virusziekten in de samenleving spelen vele factoren een rol. Behalve de genetische flexibiliteit van virussen zijn ook sociaal-culturele factoren een belangrijk gegeven.[e]
Gedurende de twintigste eeuw vonden vier pandemieën plaats die veroorzaakt werden door het influenzavirus. De Spaanse griep die in 1918 tientallen miljoenen slachtoffers eiste, was hiervan veruit de meest dodelijke. Opmerkelijk bij de Spaanse griep was het feit dat vooral gezonde jongvolwassenen ernstig ziek werden, dit in tegenstelling tot andere griepuitbraken, die voornamelijk een gevaar vormen voor ouderen of mensen met een anderszins verzwakt immuunsysteem.[38]
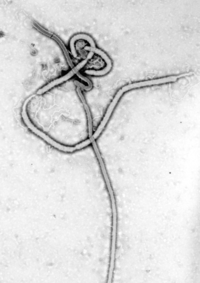
Verschillende zeer dodelijke virale stammen behoren tot de filovirussen. Dit zijn filamenteuze virussen die bij de mens hemorragische koorts veroorzaken. Het marburgvirus, voor het eerst ontdekt in 1967, kreeg in april 2005 veel media-aandacht na een uitbraak in Angola.[39] Het ebolavirus heeft sinds 1976, toen het voor het eerst werd vastgesteld, met tussenpozen uitbraken met hoge sterftecijfers veroorzaakt. De meest ernstige uitbraak vond plaats in West-Afrika tussen 2013 en 2016.[40]
Het severe acute respiratory syndrome (SARS) en Middle East respiratory syndrome (MERS) zijn luchtwegeninfecties die veroorzaakt worden door nieuwe typen coronavirussen. Van coronavirussen is algemeen bekend dat ze milde infecties veroorzaken bij mensen, dus de virulentie en snelle verspreiding van SARS-infecties – die in juli 2003 ongeveer 800 doden veroorzaakten – waren betrekkelijk onverwacht.[41]
Een gerelateerd coronavirus ontstond in november 2019 in Wuhan. Het virus, SARS-CoV-2 genaamd, verspreidde zich door in hoog tempo over de continenten. In diverse delen van de wereld werden strenge maatregelen genomen om de verspreiding tegen te gaan. Het internationale verkeer werd stilgelegd, openbare ruimtes werden gesloten en in veel dichtbevolkte steden werden lockdowns afgekondigd.[42]
Kanker
Aan het ontstaan van kanker liggen verschillende erfelijke en omgevingsfactoren ten grondslag. Van virussen is al sinds het begin van de twintigste eeuw een rol bij de ontwikkeling van tumoren vastgesteld (of tenminste aannemelijk gemaakt).[43] De bekendste vormen van kanker die door virussen worden veroorzaakt zijn levercarcelcinoom en baarmoederhalskanker, respectievelijk door het hepatitis B-virus en het humaan papillomavirus.[44] Andere carcinogene virussen zijn bijvoorbeeld het epstein-barrvirus, merkelcelpolyomavirus en humaan herpesvirus 8. Het mechanisme waarmee deze virussen kanker verwekken is grondig bestudeerd. Tijdens een infectie integreert het virale genoom in het DNA van de gastheercel. Bepaalde genen van de gastheer, bijvoorbeeld genen die betrokken zijn bij de celcyclus- en celgroeimachinerie, kunnen daarbij ontregeld raken. Via een complex, meerstapsproces zal de getroffen cel zich uiteindelijk ongebreideld gaan delen en een tumor veroorzaken.[43] De frequentie van virale kankers kan preventief worden verminderd door vaccinatie of therapeutisch door de infecties te behandelen.[45]
Afweer en bestrijding
Immuunsysteem
Gewervelde dieren hebben een complex afweersysteem om virale infecties te bestrijden. Orgaansystemen van dieren zijn allereerst omgeven door dicht op elkaar liggende epitheelcellen. Deze cellen vormen een fysieke en chemische barrière voor ziekteverwekkers: ze produceren slijm en vocht die afvoerend werken en rijk zijn aan antimicrobiële stoffen. Daarnaast komen in het lichaam fagocyten voor: grote witte bloedcellen die lichaamsvreemde deeltjes, waaronder virussen en bacteriën, aftasten en opruimen. Het epitheel en de fagocyten zijn onderdeel van het aangeboren immuunsysteem. Het aangeboren immuunsysteem is vaak voldoende om een infectie te voorkomen. Wanneer een virusdeeltje toch het lichaam binnendringt en zich vermenigvuldigt, komt het verworven immuunsysteem op gang, dat specifiek de ingedrongen virussoort zal aanvallen en elimineren.[46]
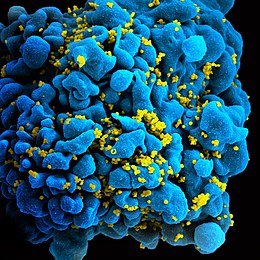
De verworven afweer is erop gericht zowel vrije virusdeeltjes als geïnfecteerde lichaamscellen te neutraliseren. Het belangrijkste mechanisme om virusdeeltjes te bestrijden is de productie van antilichamen (humorale afweer). Antilichamen zijn eiwitten die aan de bloedbaan worden afgegeven en zich specifiek aan de viruscapside kunnen binden. Na binding is het virus niet langer infectieus. Zoogdieren produceren een breed scala aan antilichamen. Vooral IgM en IgG zijn voor neutralisatie van virussen van belang.[f] Hoge waarden van IgG in het bloed wijst meestal op immuniteit.
De bestrijding van geïnfecteerde cellen gebeurt via cytotoxische T-cellen (cellulaire afweer). Lichaamscellen die geïnfecteerd zijn door een virus zullen antigenen – kleine fragmentjes van de virale eiwitten – presenteren op hun membraan. Wanneer een T-cel een verdacht antigeen tegenkomt, zal de cel door speciale cytotoxische T-cellen worden gedood en opgeruimd. De cellulaire afweer tegen virussen wordt begunstigd door interferonen. Dat zijn hormoonachtige stofjes die met de virusreplicatie interfereren.[48]
Veel virussen blijken de afweermechanismen van de gastheer te kunnen beïnvloeden, waardoor zij de immuunrespons omzeilen. Hiv ontwijkt het immuunsysteem bijvoorbeeld door voortdurend de aminozuursequentie van zijn capside-eiwitten te veranderen (antigeenvariatie). De immuunrespons van de gastheer is hierdoor altijd aspecifiek en het virus veroorzaakt een chronische infectieziekte. Andere ontwijkingsstrategieën zijn onder meer remming van fagocytose of antigeenpresentatie, resistentie tegen cytokinen en ontsnapping aan apoptose.[49][50]
Preventie en behandeling
Een virus is volledig afhankelijk van de stofwisseling en machinerie van de gastheercel. Om deze reden is het moeilijk een gerichte behandeling tegen een virusinfectie te ontwikkelen die geen schade toebrengt aan de gastheer zelf. Immers, processen remmen die ook voor de gastheercel zelf van belang zijn, leidt snel tot toxische effecten van de behandeling. De meest effectieve geneeskundige benadering om virusziekten tegen te gaan is vaccinatie. Voorts is er ook een aantal antivirale middelen ontwikkeld die specifiek op de virale processen ingrijpen en de replicatiecyclus verhinderen.
Vaccins
Vaccinatie is de meest succesvolle toepassing van immunologische principes in de gezondheidszorg. Een vaccin wordt gedefinieerd een middel dat een gerichte immuunrespons opwekt zonder dat daarbij ziekteverschijnselen ontstaan. Na toediening is het gevaccineerde individu beschermd tegen de betreffende ziekteverwekker. Al lang voor de ontdekking van virussen werd vaccinatie toegepast om infectieziekten te voorkomen. Het inzetten van vaccins bij grote delen van de bevolking heeft geleid ertoe geleid dat de morbiditeit (ziekte) en mortaliteit (overlijden) van virusziekten als polio, mazelen, bof en rubella in de loop der jaren drastisch gedaald zijn.[51][52] Pokken en runderpest zijn dankzij vaccinatie reeds uitgeroeid.[53] Om vaccins te produceren worden biotechnologische technieken aangewend. Klassieke vaccinpreparaten bestaan uit gedode of sterk verzwakte virusdeeltjes. Deze zijn dus niet meer ziekteverwekkend, maar bevatten wel de antigenen om het immuunsysteem te activeren. Ook kan een vaccin worden bereid dat uitsluitend de capside-eiwitten bevat (subunit-vaccin). Door toevoeging van een adjuvant, zoals aluminiumzouten, kan de werkzaamheid van vaccins sterk worden verhoogd.[54]
Antivirale middelen

Antivirale middelen zijn stoffen die interfereren met de replicatiecyclus van virussen. De meeste antivirale middelen die op de markt zijn gebracht behoren tot de nucleosideanalogen: op DNA-bouwstenen gelijkende moleculen die virussen tijdens replicatie onbedoeld in hun genoom opnemen. Vanaf het moment dat een nucleosideanalogon is ingebouwd, stopt de polymerisatie van de keten. Het genetisch materiaal kan dan niet verder worden gekopieerd. Voorbeelden van bekende nucleosideanalogen zijn aciclovir, stavudine en het recente remdesivir.[55][56] Antivirale middelen kunnen ook de vasthechting aan de gastheercel verhinderen of virale enzymen blokkeren.
De meeste virusremmers zijn slechts werkzaam tegen specifieke soorten en hebben dus een geringe therapeutische breedte. Tegen hiv, hepatitis B en C, herpesvirussen en influenzavirussen bestaat inmiddels een uitgebreid arsenaal aan antivirale middelen, maar tegen veel andere virusinfecties nog niet of nauwelijks. Om resistentie tegen antivirale middelen te voorkomen worden vaak combinatietherapieën toegepast. Het voorschrijven van meerdere virusremmers met verschillende aangrijpingspunten vergroot het antivirale effect en beperkt de kans op resistentie aanzienlijk.[57]
Ontstaan en evolutie van virussen
Virussen zijn onderhevig aan genetische verandering en ondergaan evolutie.
Virussen worden overal aangetroffen waar zich leven bevindt. De precieze herkomst van virussen is onduidelijk. Dat komt onder andere doordat virussen geen fossiele resten achterlaten. Daarom worden moleculaire technieken toegepast om uit te vinden hoe virussen zijn ontstaan. Viraal genetisch materiaal integreert zich van tijd tot tijd in de kiembanen van de gastheer-organismes, van waaruit zij kunnen worden overgedragen aan het nageslacht. Die overdracht kan vele generaties doorgaan. Dit verschijnsel levert informatie voor paleovirologen, waarmee zij een virus reconstrueren dat vele miljoenen jaren geleden moet hebben bestaan.
Enkele hypotheses voor het ontstaan van virussen zijn:
- Verlies van celfunctionaliteit door parasitisme
- De voorlopers van de huidige virussen waren wellicht ooit kleine cellen die op grotere cellen parasiteerden. Na verloop van tijd verloren zij de genen die niet essentieel waren voor hun parasitisme. Deze hypothese wordt ondersteund door het bestaan van de bacteriën rickettsia en chlamydia, die zich - net zoals virussen - alleen kunnen vermenigvuldigen via gastheercellen. Deze bacteriën hebben waarschijnlijk de genen verloren die hen in staat stelden zich zelfstandig voort te planten. Daardoor zijn ze afhankelijk geworden van parasitisme. Hetzelfde zou met de voorlopers van virussen gebeurd kunnen zijn.
- Herkomst uit DNA van grotere organismes
- Sommige virussen zijn wellicht ontstaan uit stukjes DNA of RNA die "ontsnapten" uit de genen van grotere organismes, bijvoorbeeld via plasmides, een streng DNA buiten het chromosaal DNA, of via springende genen, een stukje DNA op een chromosoom, dat in het genoom van plaats kan verwisselen.
- Gelijktijdige evolutie met de eerste cellen
- Volgens deze hypothese evolueerden virussen uit complexe eiwitten en nucleïnezuren, tegelijkertijd met het ontstaan van de eerste cellen. De eerste virussen zouden van het begin al afhankelijk zijn geweest van cellulair leven. Een aanwijzing voor deze hypothese is het bestaan van viroïden. Dit zijn moleculen van RNA die niet beschikken over een eiwitmantel zoals een virus. Viroïden kunnen echter wel planten infecteren.
- Een andere aanwijzing voor deze hypothese is het bestaan van virussen die afhankelijk zijn van de aanwezigheid van andere virussoorten in de gastheercel. Dit worden satellietvirussen genoemd – Een voorbeeld hiervan is het hepatitis D-virus dat afhankelijk is van het hepatitis B-virus voor het maken van een eiwitmantel. Satellietvirussen vormen wellicht evolutionaire tussenproducten of overgangsvormen van viroïden naar virussen.
In het verleden waren er problemen met al deze hypotheses: de regressieve hypothese verklaarde niet waarom zelfs de kleinste cellulaire parasieten op geen enkele manier op de huidige virussen lijken. De ontsnappingshypothese kan de complexe capsides en andere structuren van virussen niet verklaren. Daarnaast houdt de eerste-virus-hypothese geen rekening met het feit dat virussen afhankelijk zijn van gastheercellen. Virussen worden nu erkend als aloud en vernomen wordt dat hun oorsprong ver voor de scheiding van het leven in de drie domeinen ligt. Deze ontdekking heeft er toe geleid dat hedendaagse virologen de drie klassieke hypothesen overdenken en opnieuw evalueren.
Het bewijs voor een voorouderlijke wereld van RNA-cellen en computeranalyses van viraal- en gastheer-DNA-sequenties leveren een beter begrip op van de evolutionaire relaties tussen verschillende soorten virussen en kunnen helpen de voorouders te bepalen van de hedendaagse virussen. Zulke analyses hebben nog niet kunnen aantonen welke hypothese precies correct is. Het is onwaarschijnlijk dat alle bekende virussen een gemeenschappelijke voorouder hebben.
Anno 2020 heeft nog geen van deze hypotheses geleid tot een sluitende theorie voor het ontstaan van virussen, en vindt er continu wetenschappelijk onderzoek plaats om de vragen te beantwoorden over de herkomst van virussen.
Virussen: levend of niet?
Er is geen sluitende definitie van leven. Hierdoor is er geen eenduidig antwoord op de vraag of virussen leven.
Een organisme met de volgende zeven eigenschappen wordt beschouwd als levend, namelijk: homeostase, organisatie, stofwisseling, groei, aanpassingen, prikkelbaarheid (reacties op de omgeving) en voortplanting. Virussen voldoen niet aan alle criteria.[58]
Argumenten dat een virus niet leeft:
- Buiten een gastheercel zijn virussen biologisch inactief.[59]
- Virussen zijn afhankelijk van de stofwisseling van de gastheercel.
- Virussen hebben een levende cel nodig om vermenigvuldigd te worden.
- Virussen zijn niet-cellulair.
- Virussen hebben geen stofwisseling.
- Virussen groeien niet.
Argumenten dat een virus wel leeft:
- Wanneer virussen de gastheercel binnenkomen, wordt het viraal nucleïnezuur geactiveerd. Dat gebeurt weliswaar geheel door toedoen van de gastheercel.
- Vanuit medisch standpunt worden virussen als levend gezien omdat zij infectieziekten bij de mens veroorzaken.
- Het feit dat virussen afhankelijk zijn van organismen om actief te blijven, is geen bewijs dat ze niet leven. Er zijn ook bacteriën die in cellen leven en daarvan afhankelijk zijn.[60]
- Het mimivirus heeft een soort stofwisseling.
- Virussen zijn onderhevig aan evolutie.
Classificatie
Virussen worden onderverdeeld in taxonomische groepen op basis van morfologie, genoomstructuur en replicatiewijze.[6] Vanaf het midden van de twintigste eeuw werd het eerste classificatiesysteem voor virussen ontwikkeld. Dit systeem was in lijn met de voor planten en dieren gangbare taxonomie van Linnaeus, en bevatte soort, geslacht, familie en orde.[61] Het systeem bleef lange tijd in zwang en werd gaandeweg verbeterd. Binnen de moderne virusclassificatie neemt de rang familie een belangrijke plaats in. Virusfamilies (herkenbaar aan het achtervoegsel -viridae) hebben doorgaans karakteristieke eigenschappen en zijn, ook vanuit klinisch perspectief, meestal goed te onderscheiden.[62]
In 1966 werd het International Committee on Taxonomy of Viruses (ICTV) opgericht. Het ICTV stelde zich ten doel een inclusief, consensus-gebaseerde taxonomie te creëren die de evolutie van virussen weerspiegelt. Aanvankelijk leek het door de hoge mutatiesnelheid onmogelijk om verre verwantschappen tussen virustaxa met zekerheid vast te stellen. Als aanvulling op de conventionele hiërarchie werd daarom ook het classificatiesysteem van Baltimore gebruikt. Vanaf 2018 werd het classificatiesysteem van het ICTV, dankzij een sterke toename van kennis omtrent de vroege evolutie van virussen, grondig herzien.[63]
ICTV-classificatie
Het International Committee on Taxonomy of Viruses is verantwoordelijk voor het volgen en ratificeren van veranderingen op het gebied van virustaxonomie. Dankzij zeer snelle ontwikkelingen in DNA-sequencing sinds de jaren 2010 kon een taxonomische lijst worden samengesteld die de volledige diversiteit van virussen behelst. Omdat verschillende basale (vroege) evolutionaire relaties werden opgehelderd, kregen de taxonomische niveaus fylum, rijk en imperium een plaats in het systeem. Vanaf 2019 bestaat de ICTV-classificatie uit 4 imperia, 9 rijken, 16 fyla, 2 subfyla, 36 klassen, 55 orden, 8 onderorden, 168 families, 103 onderfamilies, 1421 geslachten, 68 ondergeslachten en 6590 soorten.[64] De huidige hiërarchie is als volgt opgebouwd.
- Imperium (-viria)
Classificatie van Baltimore

Viroloog en Nobelprijswinnaar David Baltimore bedacht in 1971 een zevengroepig classificatiesysteem.[65] Samen met de ICTV-classificatie werd de Baltimore-classificatie een van de meest gangbare manieren om virusdiversiteit in te delen.[66][67][68]
De Baltimore-classificatie is gebaseerd op de structuur van het genoom en de wijze van replicatie. Alle virussen maken tijdens hun replicatie messenger-RNA aan, en dit kan op basis van zeven verschillende mechanismen. Het genoom kan enkelstrengs (ss) of dubbelstrengs (ds) zijn, RNA of DNA bevatten, en kan gebruik maken van reverse-transcriptase (RT). Daarnaast kunnen ssRNA-virussen sense (+) of antisense (–) zijn.[66] Zodoende zijn virussen te verdelen in zeven groepen:
- I: dsDNA-virussen (bijv. adenovirussen, herpesvirus)
- II: ssDNA-virussen (bijv. parvovirus)
- III: dsRNA-virussen (bijv. reovirussen)
- IV: (+)ssRNA-virussen (bijv. coronavirussen, picornavirussen)
- V: (−)ssRNA-virussen (bijv. influenzavirussen)
- VI: ssRNA-RT-virussen (bijv. retrovirussen)
- VII: dsDNA-RT-virussen (bijv. hepadnavirussen)
Nomenclatuur
In de vroege dagen van de virologie werden virussen vernoemd naar hun pathogene eigenschappen of hun de ontdekker. Zo werd de virusfamilie die leveraandoeningen veroorzaakte Hepadnaviridae genoemd (hepar betekent 'lever'). Vanaf het begin van de jaren 1950 tot het midden van de jaren 1960 – een periode waarin veel nieuwe virussen werden ontdekt – was het gebruikelijk om virusnamen samen te stellen met behulp van afkortingen en initialen.[6] Zo werd de naam Picornaviridae afgeleid van pico en RNA, en Papovaviridae van papilloma, polyoma en vacuole. Moderne virusnomenclatuur staat onder toezicht van het ICTV. Het benoemen van een nieuw taxon is gebonden aan verschillende regels.[69]
Geschiedenis van het onderzoek naar virussen
Beginselen
Louis Pasteur was bioloog en ontwikkelde vaccinatie tegen hondsdolheid. Het lukte hem echter niet de veroorzaker van deze ernstige ziekte te vinden. Pasteur speculeerde daarom over een pathogeen dat hondsdolheid veroorzaakte, maar dat te klein zou zijn om door een microscoop waargenomen te kunnen worden. In 1884 bedacht de Franse microbioloog Charles Chamberland het Chamberlandfilter dat over zulke kleine poriën beschikte dat bacteriën daar niet doorheen konden en uit de oplossing konden worden gefilterd. Kleinere deeltjes konden het filter nog wel passeren, zodat het onzichtbare pathogeen over zou blijven.
In 1892 gebruikte de Russische bioloog Dmitri Ivanovsky een dergelijk filter om iets te bestuderen wat later het tabaksmozaïekvirus bleek te zijn. Daarvoor vermaalde hij bladextracten van geïnfecteerde tabaksplanten. De restanten bleven zelfs na de filtratie door het filter besmettelijk. Ivanovsky suggereerde dat de besmetting werd veroorzaakt door een gif dat aangemaakt zou zijn door de bacteriën, maar deed hier geen verder onderzoek naar.
In 1898 herhaalde de Nederlandse microbioloog Martinus Beijerinck de experimenten en kwam tot de veronderstelling dat er in de gefiltreerde oplossing een nieuw soort pathogeen zou moeten zitten. Hij nam waar dat de pathogeen zich enkel vermenigvuldigde in cellen die zichzelf bezig waren te delen, maar omdat zijn experimenten niet konden aantonen dat het veroorzaakt werd door een vaste materie, noemde hij het pathogeen een contagium vivum fluidum en deed hij een her-introductie van het woord virus. Beijerinck bleef in de veronderstelling dat virussen vloeibaar waren, een theorie die later werd ontkracht door Wendell Stanley, die liet zien dat ze uit deeltjes bestonden.
20ste eeuw en moderne ontdekkingen

Aan het begin van de 20e eeuw ontdekte de Engelse bacterioloog Frederick Twort een groep virussen die in staat waren bacteriën te infecteren, de bacteriofagen. De Frans-Canadese microbioloog Félix d'Herelle beschreef dat wanneer virussen samen met bacteriën op een petrischaaltje met agar werden geplaatst, plekken ontstonden met dode bacteriën. Bacteriofagen werden aangekondigd als de potentiële behandeling voor ziekten zoals tyfeuze koorts en cholera, maar hun ontdekking raakte in de vergetelheid na de ontdekking van penicilline. Door de toenemende mate van resistentie tegen antibiotica is er een hernieuwde interesse ontstaan in het therapeutisch gebruik van bacteriofagen.
Aan het eind van de 19e eeuw werden virussen gedefinieerd aan de hand van hun besmettelijkheid, hun doordringbaarheid door filters, en hun benodigde gastheer. In 1906 bedacht Ross Granville Harrison een methode om kunstmatig weefsel te laten groeien in de lymfe. En in 1913 gebruikten E. Steinhardt, C. Israeli en R.A. Lambert deze methode om het virus vaccinia in fragmenten van het hoornvlies van cavia's te laten groeien. In 1928 maakten H.B. Maitland en M.C. Maitland meer vacciniavirus door middel van suspensies van vermalen nieren van kippen. Van hun methode werd niet veelvuldig gebruik gemaakt totdat in de jaren 50 van de twintigste eeuw het poliovirus op grote schaal werd gemaakt ter productie van vaccins.
Een andere doorbraak vond plaats in 1931 toen de Amerikaanse pathologen Ernest William Goodpasture en Alice Miles Woodruff influenza en een aantal andere virussen kweekten in bevruchte kippeneieren. In 1949 kweekten John Franklin Enders, Thomas Weller en Frederick Robbins het poliovirus in opgekweekte menselijke embryocellen; dit was de eerste keer dat een virus werd gekweekt zonder gebruik van dierlijk materiaal. Dit werk leidde ertoe dat Jonas Salk in staat was een effectief vaccin tegen polio te ontwikkelen.
De eerste afbeeldingen van virussen verschenen toen in 1931 elektronenmicroscopie werd uitgevonden door de Duitse ingenieurs Ernst Ruska en Max Knoll. In 1935 bestudeerde de Amerikaanse biochemicus en viroloog Wendell Meredith Stanley het tabaksmozaïekvirus en ontdekte dat dit voornamelijk bestond uit proteïnen (eiwitten).
Niet lang hierna werd er onderscheid gemaakt tussen onderdelen die bestonden uit proteïnen- en RNA-onderdelen. Het tabaksmozaïekvirus was het eerste virus dat werd gekristalliseerd waardoor de structuur van dit virus beter onderzocht kon worden. De eerste röntgenkristallografie van gekristalliseerde virussen werden gemaakt in 1941 door Bernal en Fankuchen. Op basis van deze opnames ontdekte Rosalind Franklin in 1955 de volledige structuur van virussen. In datzelfde jaar lieten Heinz Fraenkel-Conrat en Robley Williams zien dat het RNA en de eiwitmantel van een gezuiverd tabaksmozaïekvirus zichzelf in elkaar kunnen zetten om zo een functioneel virus te vormen. Dit doet vermoeden dat dit simpele mechanisme waarschijnlijk de manier is waarop virussen worden gemaakt in hun gastheercellen.
De tweede helft van de 20e eeuw werden er vele nieuwe virussen ontdekt. Het merendeel van de meer dan 2.000 bekende dieren-, planten- en bacterie-virussen werd ontdekt in dit tijdsbestek. In 1957 werd het equine arterivirus en de veroorzaker van boviene virale diarree, een pestivirus, ontdekt. In 1963 werd het hepatitis B-virus ontdekt door Baruch Blumberg, in 1965 beschreef Howard Martin Temin het eerste retrovirus. Het enzym reverse-transcriptase, dat retrovirussen gebruiken om DNA-kopieën te maken van hun RNA, werd voor het eerst beschreven in 1970 door Howard Martin Temin en David Baltimore onafhankelijk van elkaar. In 1983 isoleerde het team van Luc Montagnier aan het Pasteur-instituut in Frankrijk voor het eerst het retrovirus dat nu bekend staat als hiv. In 1989 ontdekte het team van Michael Houghton van Chiron Corporation het hepatitis C-virus.
Zie ook
Noten
Referenties
Literatuur
|