Periodiek systeem: verschil tussen versies
naamgeving |
Vertaling van de Engelse versie van dit artikel. Verdere uitbreiding en verbeteringen volgen. |
||
| Regel 1: | Regel 1: | ||
[[File:14LaAc periodic table IIb.jpg|thumb|right|375px|Modern periodiek systeem, van wie de 18-kolom opmaak gezien word als de standaard- of populaire vorm <ref>Scerri 2007</ref>]] |
|||
[[Bestand:Менд.jpg|thumb|Dmitri Mendelejev]] |
|||
Het '''periodiek systeem der elementen''' is een [[tabel]] met daarin een systematische weergave van alle [[Chemisch element|scheikundige elementen]]. Op deze manier kunnen de [[scheikunde|chemische]] en [[natuurkunde|fysische]] eigenschappen van de elementen in kaart worden gebracht en zelfs voorspeld worden. Deze tabel, ook de '''tabel van [[Dmitri Mendelejev|Mendelejev]]''' genoemd, kent een lange [[Geschiedenis van het periodiek systeem|geschiedenis]]. Alle bekende elementen staan op volgorde van [[atoomnummer]] zodanig ingedeeld dat de elementen uit dezelfde [[Periode (scheikunde)|periode]] naast elkaar staan en elementen uit dezelfde [[Chemische groep|groep]] boven elkaar. Tevens staan de elementen die tot hetzelfde [[Blok van het periodiek systeem|blok]] en dezelfde [[Reeks van het periodiek systeem|reeks]] behoren bij elkaar in de buurt. |
|||
Het '''Periodiek systeem''' is een tabellarische schikking van de [[Chemisch element|chemische elementen]], geordend op hun [[atoomnummer]] (aantal protonen in de atoomkern), [[elektronenconfiguratie]] en terugkerende [[stofeigenschap|stofeigenschappen]]. De tabel bevat ook vier rechthoekige [[blok van het periodiek systeem|blokken]]: s-, p-, d- en f-blokken. Over het algemeen zijn binnen één rij (periode) de linkse elementen metalen en de rechtse elementen niet-metalen. |
|||
De rijen van de tabel worden [[periode (scheikunde)|periodes]] genoemd; de kolommen worden [[groep (periodiek systeem)|groepen]]. Zes groepen (kolommen) hebben namen en nummers: bijvoorbeeld, de elementen uit groep 17 zijn de [[halogeen|halogenen]] en groep 18 zijn de [[edelgas|edelgassen]]. Het periodiek systeem kan gebruikt worden om connecties te vinden tussen de eigenschappen van elementen, en de eigenschappen te ontdekken van nieuwe of nog onbekende elementen. Het periodiek systeem is een nuttig raamwerk om chemisch gedrag mee te analyseren, en wordt uitgebreid gebruikt in de chemie en andere wetenschappen. |
|||
Hoewel er voorgangers bestaan, werd de eerste herkenbare tabel gepubliceerd door [[Dmitri Mendelejev]] in 1869. Hij ontwikkelde zijn tabel om periodieke tendensen aan te tonen in de toen gekende elementen. Mendelejev voorspelde ook enkele eigenschappen van toen onbekende elementen, waarvan hij verwachte dat die de gaten in de tabel zouden vullen. Toen die elementen werden ontdekt bleken zijn voorspellingen grotendeels correct te zijn geweest. Mendelejev's periodiek systeem is sindsdien uitgebreid en verfijnd door het ontdekken of synthetiseren van meer nieuwe elementen en het ontwikkelen van nieuwe theoretische modellen om het chemisch gedrag te verklaren. |
|||
Alle elementen van atoomnummer 1 ([[waterstof (element)|waterstof]]) tot 118 ([[ununoctium]]) werden ontdekt of gesynthetiseerd, en elementen 113, 115, 117 en 118 werden op 30 december 2015 door de [[IUPAC]] bevestigd.<ref>{{cite web|url=http://www.bbc.co.uk/news/science-environment-35220823|title=Chemistry: Four elements added to periodic table|work=BBC News}}</ref> De eerste 94 elementen verschijnen in de natuur, hoewel sommigen zeer weinig voorkomen en eerst in een laboratorium gesynthetiseerd werden voor ze in de natuur ontdekt werden.<ref group = "n">De elementen die origineel door synthesis ontdekt werden en later in de natuur zijn technetium (Z=43), promethium (61), astaat (85), neptunium (93), and plutonium (94).</ref> Elementen met atoomnummer 95 tot 118 zijn enkel gesynthetiseerd in laboratoria. Er werd aangetoond dat elementen 95 tot 100 ooit in de natuur voorkwamen, maar nu niet meer.<ref name="emsley">{{cite book|last=Emsley|first=J.|title=Nature's Building Blocks: An A-Z Guide to the Elements|edition=New|year=2011|publisher=Oxford University Press|location=New York, NY|isbn=978-0-19-960563-7}}</ref> Men is momenteel bezig met het synthetiseren van elementen met hogere atoomnummers. Men heeft ook meerdere synthetische [[radionuclide|radionuclides]] van elementen die in de natuur verschijnen in een lab kunnen produceren. |
|||
==Overzicht== |
|||
== Periodiek systeem der elementen == |
|||
{| align=center bd=1 cp=0 cs=1 style="border-style:none;border-width:0px" |
{| align=center bd=1 cp=0 cs=1 style="border-style:none;border-width:0px" |
||
| |
| |
||
| Regel 218: | Regel 226: | ||
|} |
|} |
||
Elk chemisch element heeft een uniek atoomnummer, wat het aantal protonen in de atoomkern voorstelt.<ref group = "n">Een nulde element ([[neutronium]]) (d.i. een stof die compleet uit neutronen bestaat), word in enkele alternatieve voorstellingen opgenomen, zoals in het Chemische sterrenstelsel.</ref> De meeste elementen hebben verschillende aantallen [[neutron|neutronen]] tussen verschillende atomen, en deze varianten worden [[isotoop|isotopen]] genoemd. Bijvoorbeeld, koolstof heeft drie isotopen die in de natuur voorkomen: alle koolstofatomen hebben zes protonen en de meeste hebben ook zes neutronen, maar ongeveer 1% heeft zeven neutronen en een zeer kleine fractie heeft er acht. In het periodiek systeem worden isotopen niet onderscheidden, maar worden samen gegroepeerd als één element. Elementen zonder stabiele isotopen krijgen de atoommassa van hun stabielste isotoop, waar zulke massa's vermeld worden, tussen haakjes.<ref name="Greenwood">Greenwood & Earnshaw, pp. 24–27</ref> |
|||
(..) = dit element komt van nature niet (meer) op aarde voor.{{Bron?|Zo heb ik het op school ook geleerd, maar volgens de lemma's Neptunium en Plutonium (zie aldaar) zijn er geringe sporen van Np en Pu in de natuur aangetroffen|2012|09|20}} De elementen met atoomnummers vanaf 112 zijn, op flerovium en livermorium na, (nog) niet geratificeerd door het IUPAC. In plaats daarvan wordt een [[systematische elementnaam]] gebruikt. |
|||
In een standaard periodiek systeem worden de elementen naar stijgend atoomnummer (aantal [[proton (deeltje)|protonen]] in de [[atoomkern]]) geordend. Een nieuwe rij ([[periode (scheikunde)|periode]]) begint wanneer een nieuwe elektronenschil zijn eerste elektron krijgt. Kolommen ([[groep (periodiek systeem)|groepen]]) worden vastgesteld door de [[elektronenconfiguratie]] van de atoom; elementen met eenzelfde aantal elektronen in een bepaalde schil vallen onder dezelfde kolom (bv. [[zuurstof]] en [[seleen]] zitten in dezelfde kolom omdat ze beide vier elektronen hebben in de buitenste p-schil). Elementen met gelijkaardige chemische eigenschappen vallen in het algemeen in dezelfde groep in het periodiek systeem, hoewel in het f-blok, en in sommige gevallen in het d-blok, de elementen in dezelfde periode ook gelijkaardige eigenschappen hebben. Het is dus relatief makkelijk om de chemische eigenschappen van een element te voorspellen als men de eigenschappen van de aangrenzende elementen kent.<ref>Gray, p. 6</ref> |
|||
== Elementen die niet in de natuur voorkomen == |
|||
Er zijn elementen die niet in de natuur voorkomen. Dit zijn [[technetium]] (<sub>43</sub>Tc) en [[promethium]] (<sub>61</sub>Pm) en alle elementen met een [[atoomnummer]] hoger dan uranium (<sub>92</sub>U), de zogenaamde [[transuraan element|transurane elementen]]. Deze elementen kunnen alleen door middel van [[kernreactie]]s synthetisch vervaardigd worden. |
|||
In 2016 heeft het periodiek systeem 118 bevestigde elementen. Elementen 113, 115, 117 en 118 werden officieel bevestigd door de [[IUPAC]] in december 2015, hoewel hun officiële namen nog onbeslist zijn.<ref>[http://www.iupac.org/news/news-detail/article/discovery-and-assignment-of-elements-with-atomic-numbers-113-115-117-and-118.html Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118]. IUPAC (2015-12-30)</ref> Daarom worden ze momenteel geïdentificeerd volgens hun atoomnummer (bv. "Element 113"), of volgens hun voorlopige [[systematische elementnaam]] ("Ununtrium", symbool "Uut").<ref>{{cite journal |last=Koppenol |first=W. H. |title=Naming of New Elements (IUPAC Recommendations 2002) |journal=Pure and Applied Chemistry |year=2002 |volume=74 |issue=5 |pages=787–791 |url=http://media.iupac.org/publications/pac/2002/pdf/7405x0787.pdf |format=PDF |doi=10.1351/pac200274050787}}</ref> |
|||
De elementen die in de tabel in het wit zijn weergegeven en waarvan de namen beginnen met 'unun-' zijn elementen waarvoor nog geen naam is vastgesteld door de [[IUPAC]]. Voor sommige van deze elementen is al een synthesemethode bedacht en/of bevestigd, voor anderen nog niet. Omdat de IUPAC nog geen naam aan deze elementen heeft gegeven, krijgen deze elementen een voorlopige naam. Een naam als [[ununtrium]] (<sub>113</sub>Uut) betekent niets anders dan dat dit element het atoomnummer 113 heeft: ''un-un-tri'' is afgeleid van het [[Latijn]] voor ''een-een-drie''. In januari 2016 zette de IUPAC de procedure in gang van het geven van formele namen aan de elementen ununtrium, (Uut, element 113), ununpentium (Uup, element 115), ununseptium (Uus, element 117), en ununoctium (Uuo, element 118).<ref>{{en}}[http://www.theguardian.com/science/2016/jan/04/periodic-tables-seventh-row-finally-filled-as-four-new-elements-are-added Naamgeving nieuwe elementen]</ref> |
|||
94 elementen verschijnen in de natuur; de andere 20 elementen, van americium tot copernicium en flerovium tot livermorium, kunnen enkel in een laboratorium gesynthetiseerd worden. Uit de natuurlijke 94 elementen, zijn er 84 oerelementen, wat betekent dat ze sinds het begin op aarde voorkwamen. De andere 10 natuurlijke elementen ontstaan enkel tijdens het vervallen van de oerelementen.<ref name="emsley"/> Het zwaarste geobserveerde element in macroscopische hoeveelheden in pure vorm is einsteinium (element 99). Astaat (element 85) is nog nooit geobserveerd geweest; francium kon enkel gefotografeerd worden in de vorm van het licht dat microscopische hoeveelheden (300 000 atomen) uitstralen.<ref>{{cite book| title = The Chemistry of the Actinide and Transactinide Elements| editor1-last = Morss| editor1-first=L.R.|editor2-first = N.M.|editor2-last = Edelstein| editor3-last = Fuger|editor3-first = J.| last = Silva|first = Robert J.| chapter = Fermium, Mendelevium, Nobelium and Lawrencium| publisher = [[Springer Science+Business Media]]| year = 2006| isbn = 1-4020-3555-1| location = Dordrecht, The Netherlands| edition = 3rd| ref = CITEREFHaire2006}}</ref> |
|||
== Verdeling van de elektronen == |
|||
Er zijn 7 [[elektronenschil]]len en deze worden aangeduid met de letters K, L, M, N, O, P, Q . Elke schil is onderverdeeld in verschillende subschillen, die naargelang van de toename van het aantal elektronen in deze volgorde worden gevuld. De subschillen worden aangegeven door een letter uit de reeks s(harp), p(rincipal), d(iffuse), f(undamental), g, h, i, j, k, ... (de termen komen van de atoomspectra). De indeling in elektronenschillen is van groot belang voor de chemische eigenschappen van een element. |
|||
== Groeperingen == |
|||
Dit geheel wordt meestal verduidelijkt met een tabel: |
|||
===Groepen=== |
|||
{| class="wikitable" align=center |
|||
Een ''groep'' of ''familie'' is een verticale kolom in het periodiek systeem. Groepen hebben meestal belangrijkere periodieke tendensen dan periodes en blokken, die later uitgelegd worden. Moderne kwantummechanische theorieën van atoomstructuur leggen groep tendensen uit door het feit dat elementen binnen dezelfde groep algemeen dezelfde elektronenconfiguratie in hun buitenste [[elektronenschil]] hebben.<ref>Scerri 2007, p. 24</ref> Hierdoor hebben elementen in eenzelfde groep gelijkaardige eigenschappen en is er een duidelijke tendens bij stijgende atoomnummers.<ref>{{cite book |last=Messler|first=R. W.|title=The essence of materials for engineers|year=2010|publisher=Jones & Bartlett Publishers|location=Sudbury, MA|isbn=0-7637-7833-8|page=32}}</ref> Maar in sommige delen van de tabel, voornamelijk het d-blok en f-blok, kunnen de horizontale gelijkheden even belangrijk zijn als verticale gelijkheden.<ref>{{Cite book |last=Bagnall|first=K. W.|year=1967|contribution=Recent advances in actinide and lanthanide chemistry|title=Advances in chemistry, Lanthanide/Actinide chemistry|volume=71|pages=1–12|publisher=American Chemical Society|doi=10.1021/ba-1967-0071|editor1-first=P.R.|editor1-last=Fields|editor2-first=T.|editor2-last=Moeller |series=Advances in Chemistry |isbn=0-8412-0072-6 |postscript=.}}</ref><ref>{{cite book |last1=Day|first1=M. C., Jr.|last2=Selbin|first2=J.|title=Theoretical inorganic chemistry|year=1969|publisher=Nostrand-Rienhold Book Corporation|edition=2nd|location=New York|isbn=0-7637-7833-8|page=103}}</ref><ref>{{cite book |last1=Holman|first1=J.|last2=Hill|first2=G. C.|title=Chemistry in context|year=2000|publisher=Nelson Thornes|edition=5th|location=Walton-on-Thames|isbn=0-17-448276-0|page=40}}</ref> |
|||
|- style="background:#CCCCCC" |
|||
| Subschillen:||s||p||d||f||g |
|||
Volgens een internationale naamconventie, worden de groepen genummerd van 1 tot 18 van de linkse kolom (alkalimetalen) tot de rechtse kolom (edelgassen).<ref name="IUPAC">{{cite book |title=Nomenclature of Inorganic Chemistry: Recommendations 1990|last=Leigh |first=G. J. |year=1990 |publisher=Blackwell Science |isbn=0-632-02494-1}}</ref> Vroeger werden ze genummerd met [[Romeinse cijfers]]. In Amerika werden deze cijfers gevolgd door een "A" als de groep deel was van het s- of p-blok, of een "B" als de groep deel uitmaakte van het d-blok. De Romeinse cijfers kwamen overeen met het laatste cijfer van de moderne naamconventie (bv. [[titaangroep|groep 4]] was IVB en [[koolstofgroep|groep 14]] was groep IVA). In Europa was de nummering gelijksoortig, behalve dat de "A" gebruikt werd voor groepen 1-9 en "B" voor groepen 10 en hoger. Groepen 8, 9 en 10 werden ook beschouwd als één groep met driemaal de breedte, die in beide notaties als groep VIII bekend was. In 1988 kwam het nieuwe IUPAC naamsysteem in gebruik, en de oude groepen werden afgeschaft.<ref>{{cite journal |last1=Fluck |first1=E.|year=1988 |title=New Notations in the Periodic Table |journal=Pure Appl. Chem.|volume=60|pages=431–436 |publisher=[[International Union of Pure and Applied Chemistry|IUPAC]]|doi=10.1351/pac198860030431 |url=http://www.iupac.org/publications/pac/1988/pdf/6003x0431.pdf|accessdate=24 March 2012 |issue=3 }}</ref> |
|||
Sommige groepen kregen een triviale [[Reeks van het periodiek systeem| reeksnaam]], zoals in de onderstaande tabel te zien, hoewel sommige zelden worden gebruikt. Groepen 3-16 hebben in het Nederlands geen triviale naam (3-10 in het Engels) en worden naar verwezen met hun groepsnummer of de naam van het eerste element in de groep (zoals Scandium groep), omdat ze minder gelijkheden en/of verticale trends hebben.<ref name="IUPAC" /> |
|||
Elementen in dezelfde groep neigen tot het vertonen van patronen in [[atoomstraal]], [[ionisatiepotentiaal]] en [[elektronegativiteit]]. Van top tot bodem per groep zal de atoomstraal van de elementen stijgen, aangezien er meer elektronen zijn en de valentie-elektronen verder van de kern te vinden zullen zijn. Van bovenaf heeft elk opeenvolgend element een lager ionisatiepotentiaal, omdat het makkelijker is een elektron te verwijderen omdat de atomen minder sterk verbonden zijn. Groepen zullen ook van boven naar beneden een lagere elektronegativiteit hebben door de grotere afstand tussen valentie-elektronen en de kern.<ref name="For Dummies">Moore, p. 111</ref> Er zijn echter uitzonderingen, zoals in [[Kopergroep|groep 11]] waar de elektronegativiteit stijgt naarmate je de groep afdaalt.<ref name="Greenwood30"/> |
|||
{| border="0" cellpadding="0" cellspacing="2" style="text-align:center; font-size:85%; background:#f8f8f8; border:1px solid #a9a9a9; max-width:1300px; margin:0 auto; padding:2px;" |
|||
|- |
|- |
||
|- style="line-height:120%; vertical-align:top;" |
|||
| style="background:#DDDDDD"| Elektronen|| '''2''' (2*1) || '''6''' (2*3) || '''10''' (2*5) || '''14''' (2*7) || '''18''' (2*9) |
|||
| colspan=2 style="text-align:left;" | [[Groep (periodiek systeem)|Groepsnummer]] |
|||
! style="background:#e1e1e1;" | [[Alkalimetaal|1]] |
|||
! style="background:#f1f1f1;" | [[Aardalkalimetaal|2]] |
|||
! style="background:#e1e1e1;" | |
|||
! style="background:#f1f1f1;" | [[Scandiumgroep|3]] |
|||
! style="background:#e1e1e1;" | [[Titaangroep|4]] |
|||
! style="background:#f1f1f1;" | [[Vanadiumgroep|5]] |
|||
! style="background:#e1e1e1;" | [[Chroomgroep|6]] |
|||
! style="background:#f1f1f1;" | [[Mangaangroep|7]] |
|||
! style="background:#e1e1e1;" | 8 |
|||
! style="background:#f1f1f1;" | 9 |
|||
! style="background:#e1e1e1;" | 10 |
|||
! style="background:#f1f1f1;" | [[Kopergroep|11]] |
|||
! style="background:#e1e1e1;" | [[Zinkgroep|12]] |
|||
! style="background:#f1f1f1;" | [[Boorgroep|13]] |
|||
! style="background:#e1e1e1;" | [[Koolstofgroep|14]] |
|||
! style="background:#f1f1f1;" | [[Stikstofgroep|15]] |
|||
! style="background:#e1e1e1;" | [[Zuurstofgroep|16]] |
|||
! style="background:#f1f1f1;" | [[Halogeen|17]] |
|||
! style="background:#e1e1e1;" | [[Edelgas|18]] |
|||
|- style="line-height:120%; vertical-align:top;" |
|||
| colspan=2 style="text-align:left; vertical-align:top;" | CAS <small>(Amerika,</small><br><small>patroon A-B-A)</small> |
|||
| style="background:#e1e1e1;" | IA |
|||
| style="background:#f1f1f1;" | IIA |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | IIIB |
|||
| style="background:#e1e1e1;" | IVB |
|||
| style="background:#f1f1f1;" | VB |
|||
| style="background:#e1e1e1;" | VIB |
|||
| style="background:#f1f1f1;" | VIIB |
|||
| colspan=3 style="background:#e1e1e1; border-top:1px solid #b8b8b8;" | VIIIB |
|||
| style="background:#f1f1f1;" | IB |
|||
| style="background:#e1e1e1;" | IIB |
|||
| style="background:#f1f1f1;" | IIIA |
|||
| style="background:#e1e1e1;" | IVA |
|||
| style="background:#f1f1f1;" | VA |
|||
| style="background:#e1e1e1;" | VIA |
|||
| style="background:#f1f1f1;" | VIIA |
|||
| style="background:#e1e1e1;" | VIIIA |
|||
|- style="line-height:120%; vertical-align:top;" |
|||
| colspan=2 style="text-align:left;" | oud IUPAC <small>(Europa,</small><br><small>patroon A-B)</small> |
|||
| style="background:#e1e1e1;" | IA |
|||
| style="background:#f1f1f1;" | IIA |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | IIIA |
|||
| style="background:#e1e1e1;" | IVA |
|||
| style="background:#f1f1f1;" | VA |
|||
| style="background:#e1e1e1;" | VIA |
|||
| style="background:#f1f1f1;" | VIIA |
|||
| colspan=3 style="background:#e1e1e1; border-top:1px solid #b8b8b8;" | VIII |
|||
| style="background:#f1f1f1;" | IB |
|||
| style="background:#e1e1e1;" | IIB |
|||
| style="background:#f1f1f1;" | IIIB |
|||
| style="background:#e1e1e1;" | IVB |
|||
| style="background:#f1f1f1;" | VB |
|||
| style="background:#e1e1e1;" | VIB |
|||
| style="background:#f1f1f1;" | VIIB |
|||
| style="background:#e1e1e1; font-size:95%;" | Group<br>0 |
|||
|- style="text-align:left; line-height:120%; vertical-align:top;" |
|||
| colspan=2 style="height:4.2em;" | [[Triviale naam]] |
|||
| style="background:#e1e1e1;" | Alkalimetalen |
|||
| style="background:#f1f1f1;" | Aardalkalimetalen |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | Halogenen |
|||
| style="background:#e1e1e1;" | Edelgassen |
|||
|- style="line-height:120%; text-align:left; vertical-align:top;" |
|||
| colspan=2 | Naam volgens element |
|||
| style="background:#e1e1e1;" | Lithium groep |
|||
| style="background:#f1f1f1;" | Beryllium groep |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | Scandium groep |
|||
| style="background:#e1e1e1;" | Titanium groep |
|||
| style="background:#f1f1f1;" | Vanadium groep |
|||
| style="background:#e1e1e1;" | Chroom groep |
|||
| style="background:#f1f1f1;" | Mangaan groep |
|||
| style="background:#e1e1e1;" | ijzer groep |
|||
| style="background:#f1f1f1;" | Kobalt groep |
|||
| style="background:#e1e1e1;" | Nikkel groep |
|||
| style="background:#f1f1f1;" | Koper groep |
|||
| style="background:#e1e1e1;" | Zink groep |
|||
| style="background:#f1f1f1;" | Boor groep |
|||
| style="background:#e1e1e1;" | koolstof groep |
|||
| style="background:#f1f1f1;" | Stikstof groep |
|||
| style="background:#e1e1e1;" | Zuurstof groep |
|||
| style="background:#f1f1f1;" | Fluor groep |
|||
| style="background:#e1e1e1;" | Helium ''of'' Neon groep |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-1-element|Periode 1]] |
|||
| style="background:#DDDDDD"| Schillen|| || || || || |
|||
| style="background:#e7ff8f;" | [[Waterstof|H]] |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#c0ffff;" | [[Helium|He]] |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-2-element|Periode 2]] |
|||
| style="background:#DDDDDD"| K ||1s || || || || |
|||
| style="background:#ff6666;" | [[Lithium (element)|Li]] |
|||
| style="background:#ffdead;" | [[Beryllium|Be]] |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#cccc99;" | [[Boor (element)|B]] |
|||
| style="background:#a1ffc3;" | [[Koolstof|C]] |
|||
| style="background:#e7ff8f;" | [[stikstof (element) | N]] |
|||
| style="background:#e7ff8f;" | [[zuurstof (element) | O]] |
|||
| style="background:#e7ff8f;" | [[Fluor (element) | F]] |
|||
| style="background:#c0ffff;" | [[Neon (element) | Ne]] |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-3-element|Periode 3]] |
|||
| style="background:#DDDDDD"| L ||2s||2p|| || || |
|||
| style="background:#ff6666;" | [[Natrium | Na]] |
|||
| style="background:#ffdead;" | [[Magnesium | Mg]] |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#f1f1f1;" | |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#cccccc;" | [[Aluminium | Al]] |
|||
| style="background:#cccc99;" | [[Silicium | Si]] |
|||
| style="background:#a1ffc3;" | [[Fosfor | P]] |
|||
| style="background:#a1ffc3;" | [[Zwavel|S]] |
|||
| style="background:#e7ff8f;" | [[Chloor (element)|Cl]] |
|||
| style="background:#c0ffff" | [[Argon | Ar]] |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-4-element|Periode 4]] |
|||
| style="background:#DDDDDD"| M ||3s||3p||3d|| || |
|||
| style="background:#ff6666;" | [[Kalium | K]] |
|||
| style="background:#ffdead;" | [[Calcium | Ca]] |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#ffc0c0;" | [[Scandium | Sc]] |
|||
| style="background:#ffc0c0;" | [[Titanium | Ti]] |
|||
| style="background:#ffc0c0;" | [[Vanadium | V]] |
|||
| style="background:#ffc0c0;" | [[Chroom (element) | Cr]] |
|||
| style="background:#ffc0c0;" | [[Mangaan | Mn]] |
|||
| style="background:#ffc0c0;" | [[ijzer (element) | Fe]] |
|||
| style="background:#ffc0c0;" | [[Kobalt | Co]] |
|||
| style="background:#ffc0c0;" | [[Nikkel | Ni]] |
|||
| style="background:#ffc0c0;" | [[koper (element) | Cu]] |
|||
| style="background:#ffc0c0;" | [[Zink (element) | Zn]] |
|||
| style="background:#cccccc;" | [[Gallium | Ga]] |
|||
| style="background:#cccc99;" | [[Germanium | Ge]] |
|||
| style="background:#cccc99;" | [[Arseen | As]] |
|||
| style="background:#a1ffc3;" | [[Seleen | Se]] |
|||
| style="background:#e7ff8f;" | [[Broom (element)|Br]] |
|||
| style="background:#c0ffff;" | [[Krypton (element) | Kr]] |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-5-element|Periode 5]] |
|||
| style="background:#DDDDDD"| N ||4s||4p||4d||4f|| |
|||
| style="background:#ff6666;" | [[Rubidium|Rb]] |
|||
| style="background:#ffdead;" | [[Strontium|Sr]] |
|||
| style="background:#e1e1e1;" | |
|||
| style="background:#ffc0c0;" | [[Yttrium | Y]] |
|||
| style="background:#ffc0c0;" | [[Zirkonium|Zr]] |
|||
| style="background:#ffc0c0;" | [[Niobium|Nb]] |
|||
| style="background:#ffc0c0;" | [[Molybdeen|Mo]] |
|||
| style="background:#ffc0c0;" | [[Technetium|Tc]] |
|||
| style="background:#ffc0c0;" | [[Ruthenium|Ru]] |
|||
| style="background:#ffc0c0;" | [[Rodium|Rh]] |
|||
| style="background:#ffc0c0;" | [[Palladium (element)|Pd]] |
|||
| style="background:#ffc0c0;" | [[Zilver|Ag]] |
|||
| style="background:#ffc0c0;" | [[Cadmium|Cd]] |
|||
| style="background:#cccccc;" | [[Indium|In]] |
|||
| style="background:#cccccc;" | [[Tin (element) | Sn]] |
|||
| style="background:#cccc99;" | [[Antimoon|Sb]] |
|||
| style="background:#cccc99;" | [[Telluur|Te]] |
|||
| style="background:#e7ff8f;" | [[Jodium (element) | I]] |
|||
| style="background:#c0ffff;" | [[Xenon|Xe]] |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-6-element|Periode 6]] |
|||
| style="background:#DDDDDD"| O ||5s||5p||5d||5f||5g |
|||
| style="background:#ff6666;" | [[Cesium|Cs]] |
|||
| style="background:#ffdead;" | [[Barium|Ba]] |
|||
| style="font-size:95%; background:#ffbfff; padding:0 1px; width:*;" | {{nowrap|[[Lanthanide|La–Yb]]}} |
|||
| style="background:#ffbfff;" | [[Lutetium|Lu]] |
|||
| style="background:#ffc0c0;" | [[Hafnium|Hf]] |
|||
| style="background:#ffc0c0;" | [[Tantaal|Ta]] |
|||
| style="background:#ffc0c0;" | [[Wolfraam|W]] |
|||
| style="background:#ffc0c0;" | [[Renium|Re]] |
|||
| style="background:#ffc0c0;" | [[Osmium|Os]] |
|||
| style="background:#ffc0c0;" | [[Iridium (element) |Ir]] |
|||
| style="background:#ffc0c0;" | [[Platina | Pt]] |
|||
| style="background:#ffc0c0;" | [[Goud|Au]] |
|||
| style="background:#ffc0c0;" | [[Kwik|Hg]] |
|||
| style="background:#cccccc;" | [[Thallium|Tl]] |
|||
| style="background:#cccccc;" | [[Lood (element)|Pb]] |
|||
| style="background:#cccccc;" | [[Bismut|Bi]] |
|||
| style="background:#cccccc;" | [[Polonium|Po]] |
|||
| style="background:#cccc99;" | [[Astaat|At]] |
|||
| style="background:#c0ffff;" | [[Radon (element)|Rn]] |
|||
|- |
|- |
||
| colspan=2 style="text-align:left; XXXfont-size:85%" | [[Periode-7-element|Periode 7]] |
|||
| style="background:#DDDDDD"| P ||6s||6p||6d||6f||6g |
|||
| style="background:#ff6666;" | [[Francium|Fr]] |
|||
| style="background:#ffdead;" | [[Radium|Ra]] |
|||
| style="font-size:95%; background:#ff99cc; padding:0 1px;" | {{nowrap|[[Actinide|Ac–No]]}} |
|||
| style="background:#ff99cc;" | [[Lawrencium|Lr]] |
|||
| style="background:#ffc0c0;" | [[Rutherfordium|Rf]] |
|||
| style="background:#ffc0c0;" | [[Dubnium|Db]] |
|||
| style="background:#ffc0c0;" | [[Seaborgium|Sg]] |
|||
| style="background:#ffc0c0;" | [[Bohrium|Bh]] |
|||
| style="background:#ffc0c0;" | [[Hassium|Hs]] |
|||
| style="background:#e8e8e8;" | [[Meitnerium|Mt]] |
|||
| style="background:#e8e8e8;" | [[Darmstadtium|Ds]] |
|||
| style="background:#e8e8e8;" | [[Röntgenium|Rg]] |
|||
| style="background:#ffc0c0;" | [[Copernicium|Cn]] |
|||
| style="background:#e8e8e8;" | [[Ununtrium|Uut]] |
|||
| style="background:#cccccc;" | [[Flerovium|Fl]] |
|||
| style="background:#e8e8e8;" | [[Ununpentium|Uup]] |
|||
| style="background:#e8e8e8;" | [[Livermorium|Lv]] |
|||
| style="background:#e8e8e8;" |[[Ununseptium|Uus]] |
|||
| style="background:#e8e8e8;" | [[Ununoctium|Uuo]] |
|||
|- |
|- |
||
| colspan="20" style="text-align:left; background:#f0f0f0" | Waterstof (H), hoewel het geplaatst wordt in kolom 1, wordt het niet beschouwd deel te zijn van de groep ''alkalimetalen''. |
|||
| style="background:#DDDDDD"| Q ||7s||7p||7d||7f||7g |
|||
|- |
|||
| colspan="20" style="text-align:left; background:#f0f0f0" | Groep 3: afhankelijk van de bron kunnen Lutetium (Lu) and Lawrencium (Lr) inbegrepen worden; het [[f-blok]] (met 14 lanthanides and 14 actinides) kan ook inbegrepen worden. |
|||
|}</div></div><noinclude> |
|||
<ref name="Fluck 1988">{{cite journal |last1=Fluck |first1=E. |year=1988 |title=New Notations in the Periodic Table |journal=Pure Appl. Chem. |volume=60 |pages=431–436 |publisher=[[International Union of Pure and Applied Chemistry|IUPAC]] |doi=10.1351/pac198860030431 |url=http://www.iupac.org/publications/pac/1988/pdf/6003x0431.pdf |accessdate=24 March 2012 |issue=3 }}</ref><ref>{{cite book|last1=Leigh|first1=G. J.|title=Nomenclature of Inorganic Chemistry: Recommendations 1990|publisher=Blackwell Science|year=1990|ISBN=0-632-02494-1}}</ref><ref>{{cite web|url=http://old.iupac.org/publications/books/rbook/Red_Book_2005.pdf|page=51|title=nomenclature of innorganic chemistry|author=IUPAC|date=2005|accessdate=2013-06-03}}</ref> |
|||
</noinclude> |
|||
===Periode=== |
|||
Een ''periode'' is een horizontale rij in het periodiek systeem. Hoewel de groepen algemeen de duidelijkste periodieke trends vertonen, zijn er enkele regio's waar horizontale trends duidelijker zijn dan de verticale, zoals in het f-blok, waar de [[lanthanide|lanthanides]] en [[actinide|actinides]] twee aanzienlijke horizontale series vormen.<ref>{{Cite book|last=Stoker|first=S. H.|title=General, organic, and biological chemistry|year=2007|page=68|publisher=Houghton Mifflin|location=New York|isbn=978-0-618-73063-6|oclc=52445586}}</ref> |
|||
Elementen in dezelfde periode vertonen trends in atoomstraal, ionisatiepotentiaal, [[elektronenaffiniteit]] en elektronegativiteit. Van links naar rechts in een periode zal de atoomstraal algemeen dalen. Dit komt doordat elk opeenvolgend element een extra proton en elektron heeft, en de elektron dichter naar de kern word getrokken.<ref>{{cite book |last=Mascetta |first=J. |title=Chemistry The Easy Way |year=2003|publisher=Hauppauge |location=New York |isbn=978-0-7641-1978-1 |oclc=52047235|edition=4th |page=50}}</ref> Deze daling in atoomstraal zorgt ervoor dat van links naar rechts in een periode het ionisatiepotentiaal ook zal stijgen. Hoe strakker een atoom gebonden is, hoe meer energie er nodig is om een elektron te verwijderen. Elektronegativiteit stijgt op dezelfde manier als ionisatiepotentiaal door de trekkracht van de kern op de elektronen.<ref name="For Dummies"/> Elektronenaffiniteit toont ook een lichte trend in periodes. Metalen (aan de linkerkant) hebben in het algemeen een lagere elektronenaffiniteit dan niet-metalen (aan de rechterkant), met de uitzondering van edelgassen.<ref>{{cite book |last1=Kotz |first1=J. |last2=Treichel |first2=P.|last3=Townsend |first3=John |title=Chemistry and Chemical Reactivity, Volume 2|edition=7th |year=2009|publisher=Thomson Brooks/Cole |location=Belmont |isbn=978-0-495-38712-1 |oclc=220756597 |page=324}}</ref> |
|||
===Blokken=== |
|||
[[File:Periodic table blocks spdf (32 column).svg|thumb|350px|Links naar rechts: s-, f-, d-, p-blokken in het periodiek systeem]] |
|||
Specifieke regio's van het periodiek systeem kunnen naar verwezen worden als ''blokken'', door de reeks waarin de elektronenschillen van de elementen gevuld worden. Elk blok wordt genoemd naar de schil waarin de "laatste" elektron zich bevindt.<ref name="Gray12"/><ref group = "n">Er is een tegenstrijdigheid en enkele onregelmatigheden in deze conventie. Zo wordt helium als deel van het p-blok beschouwt, maar is werkelijk een s-blok element, en de d-schil in the d-blok is werkelijk pas gevuld tegen de tijd dat groep 11 bereikt is, in plaats van groep 12.</ref> Het [[s-blok]] omvat de eerste twee groepen (alkalimetalen en aardalkalimetalen), alsook waterstof en helium. Het [[p-blok]] omvat de laatste zes groepen, 13 tot 18 in IUPAC (3A tot 8A in Amerika) en bevat onder andere alle [[metalloïden]]. Het d-blok omvat groepen 3 tot 12 (of 3B tot 2B in Amerikaans) en bevat alle [[overgangsmetalen]]. Het [[f-blok]], vaak onder de rest van de tabel, heeft geen groepsnummers en omvat de lanthanides en actinides.<ref>{{cite book |last=Jones |first=C. |title=d- and f-block chemistry |year=2002 |publisher=J. Wiley & Sons |location=New York |isbn=978-0-471-22476-1|oclc=300468713 |page=2}}</ref> |
|||
vormen met elkaar |
|||
===Metalen, metalloïden en niet-metalen=== |
|||
[[File:Periodic table (metals–metalloids–nonmetals, 32 columns).png|300px|right|thumb |
|||
|{{legenda|#eee8aa|Metalen|border=none}} {{legenda|#cccc99|Metalloïden|border=none}} {{legenda|#b0e0e6|Niet-metalen|border=none}} {{legenda|#e8e8e8|Elementen met onbekende chemische eigenschappen|border=none}} <br> Bronnen zijn het oneens over de classificatie van sommige elementen.]] |
|||
Volgens hun gedeelde fysieke en chemische eigenschappen kunnen de elementen geclassificeerd worden in de grote categorieën [[metaal|metalen]], [[metalloïde|metalloïden]] en [[niet-metaal|niet-metalen]]. Metalen zijn in het algemeen glanzende, zeer geleidende vaste lichamen, die allooien vormen met elkaar en zoutachtige ionische verbindingen vormen met niet-metalen (behalve edelgassen). De meeste niet-metalen zijn gekleurde of kleurloze isolerende gassen; niet-metalen die verbindingen vormen met andere niet-metalen hebben een [[covalente binding]]. Tussen de metalen en niet-metalen liggen de metalloïden die tussenliggende eigenschappen bevatten.<ref>{{cite book |last1=Silberberg|first=M. S.|title=Chemistry: The molecular nature of matter and change|year=2006|page=536|publisher=McGraw-Hill|location=New York|edition=4th|isbn=0-07-111658-3}}</ref> |
|||
Metalen en niet-metalen kunnen verder geordend worden in subcategorieën die een gradatie van metallische naar niet-metallische eigenschappen tonen, van links naar rechts in de rijen. De metalen zijn onderverdeeld in de zeer reactieve alkalimetalen, de minder reactieve aardalkalimetalen, de lanthanides en actinides, via de overgangsmetalen, eindigend met de fysiek- en chemisch zwakke hoofdmetalen. De niet-metalen worden onderverdeeld in de polyatomische niet-metalen, die zich het dichtst bij de metalen bevinden en dus enkele licht metallische eigenschappen hebben; de diatomische niet-metalen, die in wezen niet-metallisch zijn; en de monatomische edelgassen, die niet-metallisch en bijna compleet inert zijn. Gespecialiseerde groeperingen, zoals de dwarsmetalen en [[edelmetaal|edelmetalen]], die subcategorieën zijn van de doorgangsmetalen, zijn ook mogelijk en worden soms zo aangegeven.<ref>{{cite book |last1=Manson|first1=S. S.|last2=Halford|first2=G. R.|title=Fatigue and durability of structural materials|year=2006|page=376|publisher=ASM International|location=Materials Park, Ohio|isbn=0-87170-825-6}}</ref><ref>{{cite book |last1=Bullinger|first=H-J.|title=Technology guide: Principles, applications, trends|year=2009|page=8|publisher=Springer-Verlag|location=Berlin|isbn=978-3-540-88545-0}}</ref> |
|||
De elementen in categorieën en subcategorieën verdelen volgens gedeelde eigenschappen is onvolmaakt. Er is een spectrum van eigenschappen binnen elke categorie, en men kan makkelijk overlappingen vinden, zoals het geval is bij de meeste classificatieschema's.<ref>{{cite book |last=Jones|first=B. W.|title=Pluto: Sentinel of the outer solar system|year=2010|publisher=Cambridge University Press|location=Cambridge|isbn=978-0-521-19436-5|pages=169–71}}</ref> Bijvoorbeeld beryllium wordt geclassificeerd als een aardalkalimetaal, hoewel zijn amfotere chemie en neiging om meestal covalente verbindingen te maken zijn eigenschappen van een chemisch zwak hoofdmetaal. Radon wordt geclassificeerd als niet-metaal en edelgas, hoewel het kationische chemie heeft wat beter past bij metalen. Er zijn andere classificatieschema's mogelijk, zoals het verdelen van de elementen volgens [[Goldschmidt-classificatie| affiniteit met een bepaalde chemische fase]] of volgens kristalstructuur. De elementen op deze manier categoriseren dateert van 1869 toen Hinrichs<ref>{{cite journal |last=Hinrichs |first=G. D. |title=On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations|journal=Proceedings of the American Association for the Advancement of Science |year=1869|volume=18 |issue=5|url=http://books.google.com/books?id=vj1SAAAAcAAJ|pages=112–124}}</ref> schreef dat simpele grenzen konden getekend worden op een periodiek systeem om elementen met gelijkaardige eigenschappen te groeperen, zoals metalen en niet-metalen, of de gaselementen. |
|||
==Periodieke Trends== |
|||
===Elektronenconfiguratie=== |
|||
[[File:Klechkovski rule.svg|upright=0.9|thumb|left|Benaderende orde waarin de schillen en subschillen zijn geordend volgens stijgende energie volgens de Madelung regel]] |
|||
De elektronen configuratie, of de organisatie van de elektronen die draaien om neutrale atomen, toont een weerkerend patroon or periodiciteit. De elektronen bezetten een serie elektronenschillen (schil 1, schil 2, enz). Elke schil bevat een of meer subschillen (genaamd s, p, d, f, en g). Zoals het atoomnummer stijgt, zullen elektronen geleidelijk deze schillen en subschillen vullen ongeveer volgens de Madelung regel, zoals te zien in het diagram. De elektronenconfiguratie van [[neon]] bijvoorbeeld is 1s<sup>2</sup> 2s<sup>2</sup> 2p<sup>6</sup>. Met atoomnummer 10 heeft neon 2 elektronen in de eerste schil en 8 elektronen in de tweede schil – 2 in de s-subschil en 6 in de p-subschil. In De taal van het periodiek systeem, de eerste keer dat een elektron een nieuwe schil bezet is de start van een nieuwe periode.<ref name=Myers>{{cite book |last=Myers|first=R.|title=The basics of chemistry|year=2003|pages=61–67|publisher=Greenwood Publishing Group|location=Westport, CT|isbn=0-313-31664-3}}</ref><ref name=chang2>{{cite book |last=Chang|first=R.|title=Chemistry|year=2002|publisher=McGraw-Hill|location=New York|edition=7|isbn=0-07-112072-6|pages=289–310; 340–42}}</ref> |
|||
[[File:Periodic trends.svg|upright=1.35|thumb|right|Periodieke trends (pijlen tonen een stijging aan)]] |
|||
Aangezien de eigenschappen van een element grotendeels bepaalt worden door de elektronenconfiguratie, tonen die eigenschappen weerkerende patronen en periodiek gedrag, met enkele voorbeelden in de onderstaande tabel. Deze periodiciteit, die al [[Johann Döbereiner| lang opgemerkt werden]] voor de [[Niels Bohr|onderliggende theorie werd ontwikkeld]], leidde tot de periodieke wet (de eigenschappen van de elementen herhalen zich in intervallen) en het formuleren van de eerste periodieke systemen.<ref name=Myers/><ref name=chang2/> |
|||
===Atoomstraal=== |
|||
[[File:Empirical atomic radius trends.png|thumb|upright=1.35|left|Atoomnummer uitgezet tegen atoomstraal<ref group="n">De edelgassen, astaat, francium, en alle elementen zwaarder dan [[americium]] werden weggelaten omdat er geen data voor hen bestaat.</ref>]] |
|||
Atoomstraal varieert in een voorspelbare en verklaarbare manier over het hele periodiek systeem. Bijvoorbeeld, de straal daalt in het algemeen met elke periode van de tabel, van alkalimetalen tot edelgassen; en ze stijgen met elke groep. De straal stijgt stijl tussen elk edelgas aan het einde van de periode en het opvolgende alkalimetaal aan het begin van de volgende periode. Deze trends kunnen verklaart worden door de elektronenschil theorie van de atoom; ze waren belangrijk bewijs voor het ontwikkelen en bevestigen van [[kwantummechanica|de kwantum theorie]].<ref name="Greenwood27">Greenwood & Earnshaw, p. 27</ref> |
|||
De elektronen in de 4f-subschil, wat gevuld wordt van [[cerium]] (element 58) tot [[Ytterbium]] (element 70) zijn niet erg effectief in het beschermen van de stijgende nucleaire lading voor de volgende subschillen. De elementen die direct volgen op de lanthanides hebben kleinere atoomstralen dan verwacht en die bijna identiek zijn aan de atoomstralen van de bovenliggende elementen.<ref name="Jolly_contract">{{cite book|last1=Jolly |first=W. L.|year=1991|title=Modern Inorganic Chemistry|page=22 |edition=2nd|publisher=McGraw-Hill|isbn=978-0-07-112651-9}}</ref> Zo heeft hafnium virtueel dezelfde atoomstraal (en chemie) als [[zirkonium]], en [[tantaal]] heeft een gelijkaardige atoomstraal als [[niobium]], enzovoort. Dit wordt de lanthanide samentrekking genoemd. Het effect van de lanthanide samentrekking is merkbaar tot aan [[platina]] (element 78), waarna het vermomd wordt door het relativistisch effect, het inerte paren effect genaamd.<ref name="Greenwood28">Greenwood & Earnshaw, p. 28</ref> De d-blok samentrekking, een gelijkaardig effect tussen het [[d-blok]] en [[p-blok]], is minder opvallend dan de lanthanide samentrekking, maar ontstaat voor een vergelijkbare reden.<ref name="Jolly_contract"/> |
|||
===Ionisatiepotentiaal=== |
|||
[[File:First Ionization Energy.svg|thumb|500px|right|Ionisatiepotentiaal: elke periode begint met een minimum voor de alkalimetalen, en eindigt met een maximum voor de edelgassen]] |
|||
Het eerste ionisatiepotentiaal is de energie die nodig is om één elektron uit een atoom te verwijderen, het tweede ionisatiepotentiaal is de energie die nodig is om een tweede elektron uit de atoom te verwijderen, enzovoort. Bij een gegeven atoom zullen opeenvolgende ionisatiepotentialen stijgen volgens een ionisatiegraad. Magnesium bijvoorbeeld heeft als eerste ionisatiepotentiaal 738 kJ/mol en als tweede 1450 kJ/mol. Elektronen in de dichtere orbitalen ondergaan sterkere elektrostatische aantrekking, waardoor hun verwijdering steeds meer energie vereist. Het ionisatiepotentiaal stijgt richting boven en rechts in het periodiek systeem.<ref name="Greenwood28"/> |
|||
Grote sprongen in opeenvolgende ionisatiepotentialen vinden plaats na het verwijderen van een elektron uit een edelgas configuratie. De twee eerste ionisatiepotentialen van magnesium, zoals eerder vermeld, komen overeen met het verwijderen van de twee 3s elektronen, en het derde ionisatiepotentiaal is 7730 kJ/mol voor de verwijdering van een 2p elektron uit de zeer stabiele, neon-achtige configuratie van Mg<sup>2+</sup>. Gelijkaardige sprongen komen voor in het ionisatiepotentiaal voor andere derde-rij atomen.<ref name="Greenwood28"/> |
|||
===Elektronegativiteit=== |
|||
[[Image:Periodic variation of Pauling electronegativities.png|thumb|right|upright=1.35|Grafiek met stijgende elektronegativiteit met groeiend aantal geselecteerde groepen]] |
|||
[[Elektronegativiteit]] is de neiging van een [[atoom]] om elektronen aan te trekken.<ref name="definition">[[IUPAC]], ''Compendium of Chemical Terminology'' 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006-) [http://goldbook.iupac.org/E01990.html "Electronegativity"]</ref> De elektronegativiteit van atomen wordt beïnvloed door het [[atoomnummer]] en de afstand tussen de [[valentie-elektronen]] en de kern. Hoe hoger de elektronegativiteit, hoe meer een element elektronen aantrekt. Het werd eerst voorgesteld [[Linus Pauling]] in 1932.<ref name="paulingJACS">{{cite journal |author= Pauling, L. |authorlink=Linus Pauling |year= 1932 |journal= [[Journal of the American Chemical Society]] |volume= 54 |issue= 9 |pages= 3570–3582 |title= The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms |doi= 10.1021/ja01348a011}}</ref> In het algemeen stijgt de elektronegativiteit van links naar rechts in een periode en dalen van boven naar onder in een groep. Zo is fluor het meest elektronegatieve element,<ref group="n">Ook al is fluor het meest elektronegatieve elementen in de Pauling schaal, [[neon]] is het meest elektronegatieve element in andere schalen, zoals de Allen schaal.</ref> terwijl [[cesium]] het minst elektronegatief is, tenminste onder de elementen waarover genoeg informatie beschikbaar is.<ref name="Greenwood30">Greenwood & Earnshaw, p. 30</ref> |
|||
Er zijn uitzonderingen op deze algemene regel. Gallium en germanium hebben een hogere elektronegativiteit dan respectievelijk aluminium en silicium, door d-blok samentrekking. Elementen in de vierde periode meteen na de eerste rij van de overgangsmetalen, hebben bijzonder kleine atoomstralen omdat de 3d-elektronen de stijgende nucleaire lading niet goed kunnen afschermen, en kleinere atoomgrootte hangt samen met hogere elektronegativiteit.<ref name="Greenwood30"/> De abnormaal hoge elektronegativiteit van lood, vooral wanneer vergeleken met [[thallium]] en [[bismut]], lijkt een artefact van data selectie (en data beschikbaarheid) – berekeningsmethodes anders dan de Pauling methode tonen een normale periodieke trend voor deze elementen.<ref>{{cite journal |last=Allred |first=A. L. |year=1960 |title=Electronegativity values from thermochemical data |url=http://www.sciencedirect.com/science/article/pii/0022190261801425|journal=Journal of Inorganic and Nuclear Chemistry |volume=17 |issue=3–4 |pages=215–221 |publisher=Northwestern University |doi=10.1016/0022-1902(61)80142-5 |accessdate=11 June 2012 }}</ref> |
|||
===Elektronenaffiniteit=== |
|||
[[File:Electron affinity of the elements.svg|thumb|upright=1.8|right|Afhankelijkheid van elektronenaffiniteit van atoomnummer.<ref>Huheey, Keiter & Keiter, p. 42</ref> Waarden stijgen algemeen over elke periode, wat culmineert tot de halogenen voor ze weer onbezonnen dalen met de edelgassen. Voorbeelden van gelokaliseerde toppen zoals in waterstof, de alkalimetalen en de [[kopergroep|groep 11 elementen]] worden veroorzaakt door een neiging tot het vervolledigen van de s-schil (waarbij de 6s-schil van goud verder gestabiliseerd wordt door relativistische effecten en de aanwezigheid van een gevulde 4f-subschil). Voorbeelden van gelokaliseerde troggen zijn te zien in de aardalkalimetalen, en stikstof, fosfor, mangaan and renium worden veroorzaakt door gevulde s-schillen, of half-gevulde p- of d-schillen.<ref>{{cite book |last1=Siekierski|first1=S.|last2=Burgess|first2=J.|title=Concise chemistry of the elements|publisher=Horwood Publishing|location=Chichester|year=2002|isbn=1-898563-71-3|pages=35‒36}}</ref>]] |
|||
De [[elektronenaffiniteit]] van een atoom is de hoeveelheid energie die vrijkomt wanneer een elektron aan een neutraal atoom wordt toegevoegd om een negatief ion te vormen. Hoewel elektronenaffiniteit veel varieert, zijn er toch zichtbare trends. In het algemeen hebben [[niet-metalen]] meer positieve elektronenaffiniteit dan metalen. [[chloor (element)|Chloor]] trekt het sterkst een extra elektron aan. De elektronenaffiniteit van de edelgassen zijn nog niet beslissend gemeten, dus hebben ze misschien licht negatieve waarden.<ref name=chang>Chang, pp. 307–309</ref> |
|||
In het algemeen zal elektronenaffiniteit toenemen van links naar rechts in een periode. Dit komt door het vullen van de valentie-schil (buitenste schil) van de atoom; een atoom uit groep 17 geeft meer energie vrij dan een atoom uit groep 1 wanneer het een extra elektron krijgt, omdat het zo de valentie-schil vult en het resultaat stabieler is.<ref name=chang/> |
|||
Men zou een trend van dalende elektronenaffiniteit van boven naar onder in een groep verwachten. De extra elektron zal een orbitaal bezetten die verder weg is van de kern. Daarom zou de elektron minder aangetrokken worden door de kern en zou minder energie vrijkomen wanneer die wordt toegevoegd. Daarentegen is één derde van de elementen bij het dalen langs een groep abnormaal, en zwaardere elementen hebben een hogere elektronenaffiniteit dan hun lichtere buren. Dit komt grotendeels door de zwakkere afscherming van d- en f-elektronen. Een gelijke daling in elektronenaffiniteit geldt enkel voor de elementen in groep 1.<ref>Huheey, Keiter & Keiter, pp. 42, 880–81</ref> |
|||
===Metaalkarakter=== |
|||
Hoe lager de waarden van het ionisatiepotentiaal, de elektronegativiteit en de elektronenaffiniteit zijn, hoe metallischer het karakter van een element is. Aan de andere kant zal het niet-metallisch karakter stijgen bij hogere waarden.<ref>{{cite book |last1=Yoder |first1=C. H.|last2=Suydam|first2= F. H.|last3=Snavely|first3=F. A. |year=1975 |title=Chemistry |page=58 |edition=2nd |publisher=Harcourt Brace Jovanovich |isbn=0-15-506465-7}}</ref> Gezien de trends van deze drie eigenschappen, zal het metallisch karakter dalen langs een periode, en met enkele uitzonderingen door de zwakke afscherming van de kern door d- en f-elektronen en relativistische effecten,<ref>Huheey, Keiter & Keiter, pp. 880–85</ref> stijgt het ook bij het afdalen langs een groep. Dus zijn de meest metallische elementen (zoals [[cesium]] of [[francium]]) te vinden in de links onderste hoek van traditionele periodieke systemen, en de meest niet-metallische elementen ([[zuurstof]], [[fluor]], [[chloor]]) in de rechts bovenste hoek. De combinatie van horizontale en verticale trends in metaalkarakter verklaren de trapvormige grenslijn tussen metalen en niet-metalen die te vinden is op sommige periodieke systemen, alsook de gewoonte om soms meerdere elementen dichtbij die lijn te categoriseren als [[Metalloïde|metalloïden]].<ref>{{cite book |last=Sacks|first=O|title=Uncle Tungsten: Memories of a chemical boyhood|year=2009|publisher=Alfred A. Knopf |location=New York|isbn=0-375-70404-3|pages=191, 194}}</ref><ref>Gray, p. 9</ref> |
|||
==Geschiedenis== |
|||
===Eerste pogingen tot systematisering=== |
|||
[[File:Discovery of chemical elements.svg|500px|thumb|De ontdekking van de elementen volgens belangrijke ontwikkelingen voor het periodiek systeem (pre-, per- and post-)]] |
|||
In 1789 publiceerde [[Antoine Lavoisier]] een lijst met 33 [[Chemisch element|chemische elementen]], gegroepeerd als [[Gas (aggregatietoestand)|gassen]], [[metaal|metalen]], [[niet-metaal|niet-metalen]] en aarden.<ref>{{cite book |title=From elements to atoms a history of chemical composition |last=Siegfried |first=R. |year=2002 |page=92 |publisher=Library of Congress Cataloging-in-Publication Data |isbn=0-87169-924-9 |location=Philadelphia, Pennsylvania}}</ref> Chemici zochten de volgende eeuw lang naar een preciezere classificatie. In 1829 observeerde [[Johann Döbereiner]] dat veel elementen in trio's konden gegroepeerd worden, gebaseerd op hun chemische eigenschappen. Bijvoorbeeld, [[Lithium (element)|lithium]], [[natrium]] en [[kalium]] kunnen in een trio gegroepeerd worden als zachte, [[reactiviteit (scheikunde)|reactieve]] elementen. Döberreiner merkte ook op dat wanneer ze gerangschikt werden op atoomgewicht, het tweede lid van elk trio ongeveer het gemiddelde was van het eerste en derde;<ref name="Ball100">Ball, p. 100</ref> dit stond bekent als de Wet van Trio's.<ref>{{cite book |last=Horvitz |first=L.|title=Eureka!: Scientific Breakthroughs That Changed The World |year=2002 |publisher=John Wiley |location=New York|isbn=978-0-471-23341-1 |oclc=50766822 |page=43}}</ref> De Duitse chemicus Leopold Gmelin werkte met dit systeem, en tegen 1843 had hij tien trio's, drie groepen van vier en een groep van vijf geïdentificeerd. [[Jean-Baptiste Dumas]] publiceerde zijn werk in 1857 wat de relaties tussen verschillende groepen metalen beschrijft. Hoewel meerdere chemici relaties konden ontdekken tussen kleine groepen elementen, was er nog geen systeem wat ze allemaal kon bevatten.<ref name="Ball100"/> |
|||
In 1857 observeerde de Duitse chemicus [[Friedrich Kekulé]] dat koolstof vaak met vier andere atomen verbonden is. [[Methaan]] bijvoorbeeld bestaat uit één koolstofatoom en vier waterstofatomen. Dit concept werd bekent als [[valentie (scheikunde)|valentie]]; verschillende elementen binden verschillende aantallen atomen.<ref>{{cite book |last=van Spronsen|first=J. W.|title=The periodic system of chemical elements|year=1969|publisher=Elsevier|location=Amsterdam|isbn=0-444-40776-6|page=19}}</ref> |
|||
In 1862 publiceerde de Franse geoloog [[Alexandre-Émile Béguyer de Chancourtois]] een vroege vorm van het periodiek systeem, wat hij de aardse helix, of schroef noemde. Hij was de eerste die de periodiciteit van de elementen opmerkte. Hij rangschikte de elementen in een spiraal op een cilinder volgens atoomgewicht, en toonde zo dat elementen met gelijkaardige eigenschappen met regelmatige tussenpozen lijken te verschijnen. Dit systeem bevatte enkele ionen en verbindingen samen met de elementen. Zijn werk gebruikte ook geologische termen in plaats van chemische, en bevatte geen schema; hierdoor kreeg het weinig aandacht tot het werk van [[Dmitri Mendelejev]].<ref>{{cite web|url=http://www.annales.org/archives/x/chancourtois.html|publisher=Annales des Mines history page|title=Alexandre-Emile Bélguier de Chancourtois (1820-1886)|accessdate=18 September 2014|language=French}}</ref> |
|||
In 1864 publiceerde de Duitse chemicus [[Julius Lothar Meyer]] een tabel met 44 elementen, gerangschikt volgens valentie. De tabel toonde aan dat elementen met gelijkaardige eigenschappen vaak dezelfde valentie hebben.<ref>Venable, pp. 85–86; 97</ref> Tegelijkertijd publiceerde de Engelse chemicus William Odling een rangschikking van 57 elementen, geordend op atoomgewicht. Hoewel er onregelmatigheden en gebreken in zaten, merkte hij een periodiciteit op in het atoomgewicht van de elementen, en dat deze overeenkomstig waren met "hun normaal verkregen groeperingen."<ref>{{cite journal |last=Odling |first=W.|title=On the proportional numbers of the elements|journal=Quarterly Journal of Science|year=2002 |volume=1|pages=642–648 (643)}}</ref> Odling speelde met het idee van een periodieke wet, maar volgde dit niet op.<ref name="Scerri 2011">{{cite book |last=Scerri|first=E.|title=The periodic table: A very short introduction|year=2011|publisher=Oxford University Press|location=Oxford|isbn=978-0-19-958249-5}}</ref> Hij stelde achteraf (in 1870) een valentie-gebaseerde classificatie voor.<ref>{{cite book |last=Kaji |first=M. |editor1-first=D. H. |editor1-last=Rouvray |editor2-first=R. Bruce |editor2-last=King |title=The periodic table: Into the 21st Century|publisher=Research Studies Press|year =2004|pages=91–122 (95)|chapter=Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s |isbn=0-86380-292-3}}</ref> |
|||
[[File:Newlands periodiska system 1866.png|300px|thumb|[[John Newlands|Newlands's]] periodiek systeem, zoals gepresenteerd aan de Chemical Society in 1866, en gebaseerd op de Wet van Octaven]] |
|||
De Engelse chemicus [[John Newlands]] schreef een reeks werkstukken van 1863 tot 1866, en merkte op dat wanneer de elementen op stijgend atoomgewicht worden geordend, gelijkaardige fysieke en chemische eigenschappen zich voordoen met intervallen van acht; hij vergeleek die periodiciteit met die van muzikale [[octaaf (muziek)|octaven]].<ref>{{cite journal |title = On Relations Among the Equivalents |last= Newlands|first= J. A. R. |journal = Chemical News |volume = 10 |pages = 94–95 |date =20 August 1864 |url =http://web.lemoyne.edu/~giunta/EA/NEWLANDSann.HTML#newlands3}}</ref><ref>{{cite journal |title = On the Law of Octaves |last= Newlands|first= J. A. R.|journal = Chemical News |volume = 12 |page = 83 |date = 18 August 1865 |url =http://web.lemoyne.edu/~giunta/EA/NEWLANDSann.HTML#newlands4}}</ref> Deze zogenoemde Wet van Octaven werd echter bespot door Newlands' tijdgenoten, en de Chemical Society weigerde zijn werk te publiceren.<ref>{{cite book |last=Bryson|first=B.|authorlink=Bill Bryson |title=A Short History of Nearly Everything |publisher=Black Swan|year=2004 |pages=141–142 |isbn=978-0-552-15174-0}}</ref> Newlands kon toch een tabel van de elementen maken, en gebruikte het om het bestaan van onbekende elementen te voorspellen, zoals [[germanium]].<ref>Scerri 2007, p. 306</ref> De Chemical Society erkende het belang van zijn ontdekkingen pas vijf jaar nadat ze het aan Mendelejev toeschreven.<ref>{{cite journal |last1=Brock |first1=W. H. |last2=Knight |first2=D. M. |title=The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society' |journal=Isis |volume=56 |issue=1 |year=1965 |pages=5–25 |publisher=The University of Chicago Press |doi=10.1086/349922 }}</ref> |
|||
In 1867 publiceerde de Deens-Amerikaanse chemicus Gustavus Hinrichs een spiraal periodiek systeem, gebaseerd op atoomgewichten en spectra, en chemische gelijkaardigheden. Het werk werd gezien als idiosyncratisch, opzichtig en ondoorgrondelijk waardoor het minder herkenbaar en minder geaccepteerd werd.<ref>Scerri 2007, pp. 87, 92</ref><ref>{{cite journal | title =American forerunners of the periodic law | last =Kauffman | first = G. B. |journal = Journal of Chemical Education | date=March 1969 | pages = 128–135 (132)|volume=46|issue=3|doi = 10.1021/ed046p128|bibcode = 1969JChEd..46..128K }}</ref> |
|||
===Mendelejev's Tabel=== |
|||
[[File:Medeleeff by repin.jpg|upright=0.7|thumb|left|Dmitri Mendelejev]] |
|||
[[File:Periodic table by Mendeleev, 1869.svg|upright=1.15|thumb|right|Een versie van Mendelejevs 1869 periodiek systeem: ''Een experiment met een systeem van elementen. Gebaseerd op hun atomische gewichten en chemische gelijkaardigheden.'' Deze vroege rangschikking toont de periodes verticaal, en de groepen horizontaal.]] |
|||
De Russische chemieprofessor [[Dmitri Mendelejev]] en de Duitse chemicus [[Julius Lothar Meyer]] publiceerden beide (onafhankelijk) hun periodieke systemen, in 1869 en 1870 respectievelijk.<ref>{{cite journal|last=Mendelejew |first=D.|year=1869 |title=Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente |journal=Zeitschrift für Chemie |pages=405–406 |language=German}}</ref> Mendelejev's systeem was zijn eerste gepubliceerde versie; dat van Meyer was een uitbreiding op zijn vorige systeem uit 1864.<ref>Venable, pp. 96–97; 100–102</ref> Zij maakten beide hun systemen door het opsommen van elementen in rijen en kolommen volgens atoomgewicht, met een nieuwe rij of kolom wanneer de eigenschappen zich begonnen te herhalen.<ref>Ball, pp. 100–102</ref> |
|||
De erkenning en aanvaarding van Mendelejev's systeem kwam van twee beslissingen die hij maakte. De eerste was om leegtes in het systeem te houden, als het leek dat het element nog niet ontdekt was.<ref>{{cite book |last=Pullman |first=B. |title=The Atom in the History of Human Thought |publisher=Oxford University Press |year=1998 |page=227 |isbn=0-19-515040-6|others=Translated by Axel Reisinger}}</ref> Mendelejev was niet de eerste chemicus die dit deed, maar hij was de eerste waarvan aanvaardt wordt dat hij ze gebruikte om de eigenschappen van nog onbekende elementen, zoals [[gallium]] en [[germanium]].<ref>Ball, p. 105</ref> De tweede beslissing was om soms de voorgestelde rangschikking van atoomgewicht te negeren en aangrenzende elementen te wisselen, zoals [[telluur]] en [[Jodium (element)|jodium]], om ze zo beter te kunnen groeperen in [[Groep (periodiek systeem)|chemische families]]. Later in 1913 stelde [[Henry Moseley]] de experimentele waarden van kernlading of atoomnummer van elk element vast, en toonde aan dat Mendelejev's ordening overeenkomt met toenemende atoomnummers.<ref>{{cite book |title=The Periodic Kingdom |author=Atkins, P. W. |publisher=HarperCollins Publishers, Inc. |year=1995 |page=87|isbn=0-465-07265-8}}</ref> |
|||
Het belang van atoomnummers voor de organisatie van het periodiek systeem werd niet volledig erkend men beter het bestaan en de eigenschappen van protonen en neutronen begreep. Mendelejev's periodiek systeem gebruikte atoomgewicht om de elementen te organiseren, omdat die informatie vrij precies bepaald kon worden in die tijd. Atoomgewicht werkte in de meeste gevallen goed genoeg om een voorstelling te maken dat de eigenschappen van onbekende elementen preciezer kon voorspellen dan vorige methoden. De vervanging van atoomnummers, zodra ze begrepen werden, gaf een definitieve, geheel getal-gebaseerde reeks van de elementen, en Moseley voorspelde dat de enige onbekende elementen (in 1913) tussen aluminium (Z=13) en goud (Z=79) (in 1913) waren Z=43, 61, 72 en 75, die allemaal later werden ontdekt. De reeks atoomnummers wordt vandaag nog gebruikt, met nieuwe synthetische elementen die geproduceerd en bestudeerd worden.<ref>{{cite journal|journal=Nucl. Phys. A|volume=789|pages=142–154|year=2007|title=Predictions of alpha decay half lives of heavy and superheavy elements|last1=Samanta|first1=C.|last2=Chowdhury|first2=P. Roy|last3=Basu|first3=D.N.|doi=10.1016/j.nuclphysa.2007.04.001|bibcode=2007NuPhA.789..142S|arxiv = nucl-th/0703086 }}</ref> |
|||
===Tweede versie en verdere ontwikkeling=== |
|||
[[File:Periodic table by Mendeleev, 1871.svg|thumb|left|500px|upright=1.80|Mendelejev's 1871 periodiek systeem met acht groepen elementen. Streepjes vertegenwoordigen onbekende elementen in 1871.]][[File:ShortPT20b.png|thumb|left|500px|Acht-kolom vorm van periodiek systeem, bijgewerkt met alle ontdekte elementen tot 2015]] |
|||
In 1871 publiceerde Mendelejev zijn periodiek systeem in een nieuwe vorm, met groepen gelijkaardige elementen gesorteerd in kolommen in plaats van rijen. Die kolommen, genummerd I tot VIII komen overeen met de [[oxidatietoestand]] van het element. Hij maakte ook gedetailleerde voorspellingen over de eigenschappen van nog onbekende elementen, maar die moeten bestaan.<ref>Scerri 2007, p. 112</ref> Deze gaten werden gevuld toen chemici meer natuurlijke elementen ontdekten.<ref>{{cite journal |last=Kaji |first=M.|year=2002 |title=D.I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry |journal=Bull. Hist. Chem. |volume=27 |issue=1 |pages=4–16 |publisher=Tokyo Institute of Technology |doi= |url=http://www.scs.illinois.edu/~mainzv/HIST/awards/OPA%20Papers/2005-Kaji.pdf |accessdate=11 June 2012 }}</ref> Er wordt vaak beweerd dat het laatst ontdekte natuurlijk element [[francium]] was (wat Mendelejev ''eka-caesium'' noemde) in 1939.<ref>{{cite web |url=http://chemeducator.org/sbibs/s0010005/spapers/1050387gk.htm|title= Francium (Atomic Number 87), the Last Discovered Natural Element|last1=Adloff|first1= J-P. |last2=Kaufman|first2=G. B. |date=25 September 2005 |publisher=The Chemical Educator |accessdate=26 March 2007}}</ref> [[Plutonium]] werd synthetisch geproduceerd in 1940, maar werd in zeer kleine hoeveelheden in de natuur gevonden in 1971.<ref>{{cite journal |doi = 10.1038/234132a0|url=http://www.nature.com/nature/journal/v234/n5325/abs/234132a0.html |title= Detection of Plutonium-244 in Nature|journal = Nature |pages = 132–134 |year = 1971 |last1 = Hoffman |first1 = D. C. |last2 = Lawrence |first2 = F. O.|last3 = Mewherter |first3 = J. L. |last4 = Rourke |first4 = F. M. |volume = 234 |bibcode = 1971Natur.234..132H|issue=5325}}</ref> |
|||
De populaire<ref>Gray, p. 12</ref> opmaak van het periodiek systeem, ook de standaardvorm genoemd, wordt toegeschreven aan Horace Groves Deming. Deming, een Amerikaanse chemicus, publiceerde in 1923 een korte ([http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=456 Mendelejev stijl]) en een medium ([http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=360 18 kolommen]) vorm van het periodiek systeem.<ref>{{cite book |last=Deming|first=H. G.|title=General chemistry: An elementary survey|year=1923 |publisher=J. Wiley & Sons |location=New York |pages =160, 165}}</ref><ref group="n">Een voorganger van Deming's 18-kolom tabel kan gevonden worden op [http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=67 Adams' 16-kolom Periodieke Tabel in 1911]. Adams laat de zeldzame aarden en de 'radioactieve elementen' (i.e. de actinides) uit het hoofdlichaam van zijn tabel en toont hen 'enkel gedekt om ruimte te sparen' (zeldzame aarden tussen Ba en eka-Yt; radioactieve elementen tussen eka-Te and eka-I). Zie: Elliot Q. A. (1911). 'A modification of the periodic table'. ''Journal of the American Chemical Society.'' '''33'''(5): 684–688 (687).</ref> In 1928 Merck and Company bereidden een pamfletvorm van Deming's 18-kolom tabel, wat wijd verspreid werd in Amerikaanse scholen. Tegen de jaren 1930 verscheen Deming's tabel in handboeken en chemische encyclopedias. Het werd ook lang verspreid door Sargent-Welch Scientific Company.<ref>{{cite book |last1=Abraham|first1=M|last2=Coshow|first2=D|last3=Fix|first3=W|title=Periodicity:A source book module, version 1.0|publisher=Chemsource, Inc.|location=New York|page=3|url=http://dwb4.unl.edu/chem_source_pdf/PERD.pdf}}</ref><ref>{{cite journal|last=Emsley|first=J|title=Mendeleyev's dream table|journal=New Scientist|date=7 March 1985|pages=32–36(36)}}</ref><ref>{{cite journal|last=Fluck|first=E|year=1988|title=New notations in the period table|journal=Pure & Applied Chemistry|volume=60|issue= 3|pages=431–436 (432)|doi=10.1351/pac198860030431}}</ref> |
|||
Met de ontwikkeling van moderne kwantummechanische theorieën van [[elektron]] configuraties in atomen, werd het duidelijk dat elke periode in de tabel overeenkwam met het vullen van een [[elektronenschil]]. Grotere atomen hebben meer elektronensubschillen, dus hadden latere tabellen steeds meer periodes nodig.<ref>Ball, p. 111</ref> |
|||
[[File:Glenn Seaborg - 1964.jpg|thumb|right|upright=0.7|[[Glenn Seaborg]] stelde in 1945 een nieuw periodiek systeem voor waarin de actinides tot een tweede f-blok reeks behoren]] |
|||
In 1945 stelde de Amerikaanse wetenschapper Glenn Seaborg voor dat de [[Actinide|actinides]], alsook de [[lanthanide|lanthanides]], een f-subschil vulden. Vroeger dacht men dat de actinides een vierde rij waren van het d-blok. Seaborg's collega's stelden voor om zo'n radicaal voorstel niet te publiceren, omdat het waarschijnlijk zijn carrière zou ruïneren. Seaborg vond destijds dat hij geen carrière had om te ruïneren, dus publiceerde hij het toch. Zijn voorstel bleek correct en hij won de [[Nobelprijs]] voor de chemie in 1951 voor zijn werk rond het synthetiseren van actinide elementen.<ref>Scerri 2007, pp. 270‒71</ref><ref>{{cite book |last1=Masterton|first1=W. L. |last2=Hurley|first2=C. N.|last3=Neth|first3=E. J.|title=Chemistry: Principles and reactions|publisher=Brooks/Cole Cengage Learning|location=Belmont, CA|edition=7th|isbn=1-111-42710-0|page=173}}</ref><ref group="n">Een tweede extra lange rij in het periodiek systeem, om bekende en onbekende elementen met een atoomgewicht groter dan dat van bismut (thorium, protactinium and uranium, bijvoorbeeld) in te groeperen, werd al voorgesteld sinds 1892. De meeste onderzoekers vonden echter dat deze elementen gelijkaardig waren aan de derde reeks overgangselementen, hafnium, tantaal and wolfraam. Het bestaan van een tweede interne overgangsreeks, in de vorm van de actinides, werd niet geaccepteerd tot gelijkheden met de elektronenstructuren van de lanthanides bevestigd werden. Zie: van Spronsen, J. W. (1969). ''The periodic system of chemical elements.'' Amsterdam: Elsevier. p. 315–316, ISBN 0-444-40776-6.</ref> |
|||
Hoewel kleine hoeveelheden van sommige [[transuraan element|transurane elementen]] te vinden zijn in de natuur,<ref name="emsley"/> werden ze eerst ontdekt in een lab. Hun productie heeft het periodiek systeem sterk uitgebreid, beginnend met [[neptunium]], gesynthetiseerd in 1939.<ref>Ball, p. 123</ref> Omdat veel transurane elementen zeer onstabiel zijn en snel bederven, zijn ze moeilijk op te sporen wanneer ze geproduceerd worden. Er zijn controverses geweest over concurrerende opeisingen voor ontdekkingen van nieuwe elementen, waardoor onafhankelijk onderzoek nodig was om te beslissen wie voorrang en dus naamrechten had. De recentst geaccepteerde en benoemde elementen zijn [[flerovium]] (element 114) en [[livermorium]] (element 116), beide benoemd op 31 mei 2012.<ref>{{cite journal |last1=Barber|first1= R. C.|last2=Karol|first2=P. J|last3=Nakahara|first3=Hiromichi|last4= Vardaci|first4= Emanuele|last5=Vogt|first5= E. W. |title=Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report) |doi=10.1351/PAC-REP-10-05-01 |journal=Pure Appl. Chem. |year=2011 |volume=83 |issue=7|page=1485}}</ref> In 2010 beweerde een Russisch-Amerikaanse samenwerking in [[Doebna (oblast Moskou)|Doebna]], [[Oblast Moskou]], Rusland dat ze zes atomen hadden gesynthetiseerd van [[ununseptium]] (element 117), wat het de recentste beweerde ontdekking maakt.<ref name=E117>{{cite web|title=Experiment on sythesis of the 117th element is to be continued|url=http://wwwold.jinr.ru/news_article.asp?n_id=1195&language=rus|year=2012|publisher=JINR|language=ru}}</ref> |
|||
Op 30 december 2015 werden elementen 113, 115, 117 en 118 formeel erkend door de [[IUPAC]], wat de zevende rij van het periodiek systeem voltooid.<ref>{{cite web|url=http://www.theguardian.com/science/2016/jan/04/periodic-tables-seventh-row-finally-filled-as-four-new-elements-are-added|title= Periodic table's seventh row finally filled as four new elements are added |work=[[The Guardian]]|date=3 January 2015|accessdate=4 January 2015}}</ref> Officiële namen en symbolen voor elk van deze elementen, die de tijdelijke namen zullen vervangen zoals ununpentium (Uup) voor element 115, worden verwacht voor 2016. |
|||
==Andere periodieke systemen== |
|||
===Gebruikelijke varianten=== |
|||
{| class="wikitable floatright" style="margin-left: 20px" |
|||
|- |
|||
|[[File:Periodic table 14CeTh form---Group 3 = Sc-Y-La-Ac.jpg|Right|x100px]]<br/><small>Type I—La, Ac onder Y</small> |
|||
|} |
|} |
||
Er zijn drie gebruikelijke varianten op de gewone of 18-kolom vorm van het periodiek systeem. Ze verschillen in hun voorstelling van groep 3.<ref name="fly">{{cite journal |last=Clark |first=R.W. |last2=White |first2=G.D. |date=2008 |title=The Flyleaf Periodic Table|journal=Journal of Chemical Education|volume=85 |issue=4 |page=497 |doi=10.1021/ed085p497}}</ref> In dit artikel zullen we naar de drie varianten verwijzen als type I, type II en type III. |
|||
'''Type I: Sc, Y La en Ac.''' Lanthaan en actinium zitten in de hoofdtabel, in groep 3, onder scandium en yttrium. De volgende 14 lanthanides en actinides staan beneden, om ruimte te sparen. Er zijn twee rijen van 14 elementen, de eerste begint met cerium en eindigt met lutetium, de lagere begint met thorium en eindigt met lawrencium. Deze variant komt het meest voor.<ref>{{cite book |last1=Myers |first1=R.T. |last2=Oldham |first2=K.B. |first3=Tocci |last3=S. |date=2004 |title=Holt Chemistry| location=Orlando |publisher=Holt, Rinehart and Winston|isbn=0-03-066463-2|page=130}}</ref><ref group="n">Clark en White bundelden hun algemene chemische tekstbundels om trends in dekblad periodieke systemen van 1948 tot 2008. Uit 35 teksten vonden ze 11 type I; negen type II; en negen type III. Over de laatste 20 jaar van hun metingen lag het aantal op negen type I; negen type II and twee type III. Zie: Clark R. W. & White G. D. (2008). 'The flyleaf periodic table'. ''Journal of Chemical Education.'' '''85'''(4): 497.</ref> Het benadrukt gelijkaardigheden in periodieke trends in groepen 1, 2 en 3, met het nadeel van discontinuïteiten in de periodieke trends tussen groepen 3 en 4 en het fragmenteren van de lanthanides en actinides.<ref group="n">Voor voorbeelden van de type I tabel, zie Atkins et al. (2006). ''Shriver & Atkins Inorganic Chemistry'' (4th ed.). Oxford: Oxford University Press • Myers et al. (2004). ''Holt Chemistry''. Orlando: Holt, Rinehart & Winston • Chang R. (2000). ''Essential Chemistry'' (2nd ed.). Boston: McGraw-Hill</ref> |
|||
== Einde van het periodiek systeem == |
|||
Elementen met een [[atoomnummer]] hoger dan 82 ([[Lood (element)|lood]]) vervallen door radioactieve processen tot elementen met lagere atoomnummers. [[Bismut]] (Bi), [[Uranium|uraan]] (U) en [[thorium]] (Th) hebben echter bijzonder langlevende [[Isotoop|isotopen]] en komen daardoor nog op aarde voor. Ook elementen die tijdens het radioactieve verval als tussenstappen optreden komen in kleine hoeveelheden op aarde voor. Elementen met hogere atoomnummers dan 92 (uraan) worden in de natuur niet aangetroffen. Misschien hebben ze ooit wel bestaan, maar aangezien hun halfwaardetijden allemaal veel korter zijn dan de leeftijd van de aarde zijn ze allang vervallen. Ze kunnen synthetisch vervaardigd worden, maar als het elementnummer boven 98 komt, [[californium]] (Cf), dan wordt dat steeds moeilijker, de elementen worden steeds minder stabiel. Of de 5g-subschil (met 18 banen) ooit helemaal gevuld zal kunnen worden met elektronen is daardoor nog een open vraag. |
|||
{| class="wikitable floatright" style="margin-left: 20px" |
|||
Op theoretische gronden vermoedt men dat nog zwaardere atoomkernen stabiel kunnen zijn. |
|||
|- |
|||
Het is echter tot op heden praktisch onmogelijk ze te maken. |
|||
||[[File:Periodic table 14LaAc form---Group 3 = Sc-Y-Lu-Lr.jpg|Right|x100px]]<br/><small>Type II—Lu, Lr onder Y</small> |
|||
|} |
|||
== Structuur in het periodiek systeem == |
|||
Wat betreft de structuur van het periodiek systeem: men onderscheidt ''groepen'' (verticaal) en ''perioden'' (horizontaal). Doordat de buitenste elektronen de chemische eigenschappen bepalen, hebben elementen in eenzelfde groep overeenkomende chemische eigenschappen, hoewel ze een heel andere massa kunnen hebben. Aangrenzende elementen binnen een periode hebben een vergelijkbare massa, maar verschillende eigenschappen. |
|||
'''Type II: Sc, Y, Lu en Lr.''' Lutetium en lawrencium zitten in de hoofdtabel, in groep 3, onder scandium en yttrium. De rijen van de voorafgaande 14 lanthanides en actinides beginnen met lanthaan en actinium en eindigen ytterbium en nobelium. Deze variant behoudt een f-blok met 14 kolommen terwijl de lanthanides en actinides gefragmenteerd worden. Het benadrukt de gelijkaardigheden in periodieke trends tussen groep 3 en de volgende groepen, met het nadeel van discontinuïteiten in de periodieke trends tussen groepen 2 en 3.<ref group="n">Voor voorbeelden van de type II tabel zie Rayner-Canham G. & Overton T. (2013). ''Descriptive Inorganic Chemistry'' (6th ed.). New York: W. H. Freeman and Company • Brown et al. (2009). ''Chemistry: The Central Science'' (11th ed.). Upper Saddle River, New Jersey: Pearson Education • Moore et al. (1978). ''Chemistry''. Tokyo: McGraw-Hill Kogakusha</ref> |
|||
=== Periode === |
|||
Een periode is een horizontale rij in het periodiek systeem. Hoewel groepen de meest voorkomende manier van classificeren van elementen zijn, zijn er plaatsen in de tabel waar de horizontale trends belangrijker zijn dan verticale groep trends, zoals het f-blok, waar de lanthaniden en actiniden de twee belangrijke horizontale reeksen van elementen vormen. |
|||
{| class="wikitable floatright" style="margin-left: 20px" |
|||
Elementen in dezelfde periode laten trends zien in [[atoomstraal]], [[ionisatiepotentiaal]], [[elektronenaffiniteit]] en [[elektronegativiteit]]. Verplaatsen van links naar rechts over een periode betekent gewoonlijk dat de atoomstraal afneemt. Dit komt doordat elk opeenvolgend element een extra proton en elektron bevat, waardoor de elektronen meer door de kern worden aangetrokken en de atoomstraal daalt. |
|||
|- |
|||
|[[File:Periodic table 15LaAc form---Group 3 = indeterminate.jpg|Right|x100px]]<br/><small>Type III—Markers onder Y</small> |
|||
|} |
|||
'''Type III: Sc, Y en markers.''' De twee posities onder scandium zijn onbezet of verwijzen op de een of andere manier naar de onderste buitenrijen. De onderstaande lanthanides en actinides beginnen met lanthaan en actinium en eindigen met lutetium en lawrencium, wat resulteert in twee rijen van 15 elementen. Deze variant benadrukt gelijkaardigheden in de chemie van de 15 lanthanides (La–Lu), met het nadeel van dubbelzinnigheid over welke twee elementen de twee groep 3 posities onder scandium en yttrium innemen, en kennelijk een f-blok van 15 kolommen (er kunnen maar 14 elementen in een rij van het f-blok zijn).<ref group="n">Voor voorbeelden van de type III tabel zie Housecroft C. E. & Sharpe A. G. (2008). ''Inorganic Chemistry'' (3rd ed.). Harlow: Pearson Education • Halliday et al. (2005). ''Fundamentals of Physics'' (7th ed.). Hoboken, NewJersey: John Wiley & Sons • Nebergall et. al. (1980). ''General Chemistry'' (6th ed.). Lexington: D. C. Heath and Company</ref> |
|||
Een voorbeeld van een periode: vlak bij het element [[Stikstof (element)|stikstof]] in de tweede periode van het schema liggen [[koolstof]] en [[Zuurstof (element)|zuurstof]]. Hoewel ze in massa overeenkomen - ze verschillen slechts enkele atomaire eenheden (A.E.) - verschillen hun eigenschappen aanzienlijk. Zo is bijvoorbeeld zuurstof met twee atomen in een molecuul een [[Gas (aggregatietoestand)|gas]] dat brandbaarheid bevordert; stikstof met zijn eveneens twee atomen is een gas dat brandbaarheid juist niet bevordert en koolstof is een [[vaste stof]] die zelf verbrand kan worden. |
|||
De drie varianten komen uit historische moeilijkheden van het plaatsen van de lanthanides in het periodiek systeem, en argumenten over waar de f-blok elementen beginnen en eindigen.<ref>{{cite book|last=Thyssen|first=P.|last2=Binnemans|first2=K|editor1-last=Gschneidner Jr.|editor1-first= K.A.|editor2-last=Bünzli|editor2-first=J-C.G|editor3-last=Vecharsky|editor3-first=Bünzli|date=2011|title=Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis|journal=Handbook on the Physics and Chemistry of Rare Earths|publisher=Elsevier|location=Amsterdam|volume=41|pages=1–94|isbn=978-0-444-53590-0}}</ref> Sommigen beweren dat zulke argumenten bewijzen dat "het een fout is het [periodiek] systeem in scherp begrensde blokken op te delen."<ref>{{cite journal |last=Stewart |first=P.J.|date=2008 |title=The Flyleaf Table: An Alternative|journal=Journal of Chemical Education|volume=85 |issue=11 |page=1490 |doi=10.1021/ed085p1490}}</ref> Sommige versies van de type III tabel zijn ook bekritiseerd voor het impliceren dat alle 15 lanthanides één plaats bezetten onder yttrium,<ref group = "n">[[File:32 column stretched periodic table.jpg|thumb|right|Lange vorm van het periodiek systeem, als resultaat van de toewijzing van de lanthanides en actinides in Groep 3, onder scandium and yttrium. Beschreven door Jensen (zie bijhorende notitie) als "verouderd" en een interpretatie dat een moderne inorganische chemicus niet zou aanbevelen, tenzij "ze alle contact zijn verloren tussen de onderliggende stelling van hun periodiek systeem en de feiten van de chemie."]]<br> Jensen schrijft: "De twee plaatsen onder scandium en yttrium…bevatten oftewel de atoomnummers 57–71 en 89–103 of de symbolen La–Lu en Ac–Lr, respectievelijk, en duiden zo aan dat alle 30 van de elementen aan de onderkant toebehoren aan enkel die twee plaatsen. Om zulke tabel uit te breiden tot een 32 kolom tabel zou het nodig zijn om de plaatsen uit te rekken voor scandium and yttrium zodat ze alle 15 kolommen omvatten."</ref> wat tegen het basisprincipe van één plaats, één element gaat.<ref name="finally"/><ref group = "n">Habashi probeerde te dit voorkomen objection by placing the 15 lanthanides in a 15-storey high rise tower rising up from the periodic table position below yttrium. See: Habashi F. (2015). '[http://www.eurchembull.com/index.php/ECB/article/view/1563/_132 Een Nieuwe Kijk op het Periodiek Systeem']. ''European Chemical Bulletin'' '''4'''(1): 1–7 (see p. 5).</ref> De controverse over welke elementen de groep 3 posities onder scandium en yttrium innemen wordt verder besproken in [[#Open vragen en controverses|Open vragen en controverses]]. |
|||
=== Groep === |
|||
Een groep is een verticale kolom in het periodiek systeem. Groepen worden beschouwd als de belangrijkste methode voor het classificeren van de elementen. In de meeste groepen bezitten de elementen gelijkwaardige eigenschappen en is er tevens een duidelijke trend in de eigenschappen (zowel fysische als chemische) van die elementen merkbaar. Zo reageren de alkalimetalen (van lithium tot cesium) alle zeer vlot met [[water]]. Echter: de [[Exotherme reactie|exothermiciteit]] van die reactie loopt op van lithium tot cesium. De groepen zijn numeriek genummerd van 1 tot en met 18 van de meest linkse kolom (de alkalimetalen) tot de meest rechtse kolom (de edelgassen). |
|||
De type II tabel, als veelgebruikte variant, wordt getoond in het overzicht van deze pagina. Vergeleken met de Type I variant "zijn er minder klaarblijkelijke uitzonderingen op de gewone opvulling van de 4f orbitalen onder de opvolgende leden van de reeks.<ref>{{cite book |last1=Brown| first1 = T. L. |last2=LeMay Jr| first2 = H. E| last3= Bursten| first3 = B. E.|date = 2009| location = Upper Saddle River, New Jersey| publisher = Pearson Education | title = Chemistry: The Central Science| edition = 11| pages = 207, 208–210 |isbn= 9780132358484}}</ref><ref group ="n"> |
|||
Een voorbeeld van een groep is uit de op één-na-laatste groep in het schema: de [[Halogeen|halogenen]] zijn [[Fluor (element)|fluor]], [[Chloor (element)|chloor]], [[broom (element)|broom]], [[jodium (element)|jodium]] en [[astaat]]. Hoewel ze binnen hun groep een enorm verschil in massa vertonen, bezitten zij sterk overeenkomende eigenschappen: ze zijn alle zeer sterke [[oxidator]]en (dat wil onder andere zeggen dat ze zich graag verbinden met [[Metaal|metalen]], waarbij metallide [[zouten]] gevormd worden). Van boven naar beneden in de kolom veranderen de fysische eigenschappen geleidelijk: fluor en chloor zijn gassen, terwijl broom een [[vloeistof]] met een laag kookpunt is. Jodium is een vaste stof. Alle vier zijn gekleurd maar de kleur wordt intenser naar beneden toe in de kolom. [[Astaat]], het vijfde element in de groep, heeft alleen maar zeer kortlevende radioactieve isotopen en komt op aarde nauwelijks voor (de totale hoeveelheid op aarde is minder dan 30 gram); de eigenschappen ervan zijn slecht tot niet bekend. |
|||
Voor Sc-Y-La-Ac en Sc-Y-Lu-Lr periodieke systemen, vergelijken de volgende twee tabellen de geïdealiseerde aantallen van ''f'' elektronen voor periode 6 en 7 elementen in het f-blok met hun echte aantallen of ''f'' elektronen. Er zijn 20 onregelmatigheden in de eerste tabel vergeleken met 9 in de tweede.<br><br> |
|||
'''TABEL 1: Sc-Y-La-Ac periodiek systeem |
|||
{| class="wikitable" |
|||
|- |
|||
|'''Periode 6''' || '''Ce'''|| '''Pr''' || '''Nd''' || '''Pm''' || '''Sm''' || '''Eu''' || '''Gd''' || '''Tb''' || '''Dy''' || '''Ho''' || '''Er''' || '''Tm''' || '''Yb''' || '''Lu''' |
|||
|- |
|||
| Geïdealiseerde f-elektronen|| 1|| 2|| 3|| 4|| 5|| 6|| 7|| 8|| 9|| 10|| 11|| 12|| 13|| 14 |
|||
|- |
|||
| Echt aantal|| 1||style="background-color: gainsboro"| 3||style="background-color: gainsboro"| 4||style="background-color: gainsboro"| 5||style="background-color: gainsboro"| 6||style="background-color: gainsboro"| 7|| 7|| style="background-color: gainsboro"|9|| style="background-color: gainsboro"|10||style="background-color: gainsboro"| 11||style="background-color: gainsboro"| 12||style="background-color: gainsboro"| 13||style="background-color: gainsboro"| 14|| 14 |
|||
|- |
|||
|'''Periode 7''' || '''Th'''|| '''Pa'''|| '''U'''|| '''Np'''|| '''Pu'''|| '''Am'''|| '''Cm'''|| '''Bk'''|| '''Cf'''|| '''Es'''|| '''Fm'''|| '''Md'''|| '''No'''|| '''Lr''' |
|||
|- |
|||
| Echt aantal|| style="background-color: gainsboro"|0|| 2|| 3|| 4|| style="background-color: gainsboro"|6|| style="background-color: gainsboro"|7|| 7||style="background-color: gainsboro"| 9|| style="background-color: gainsboro"|10|| style="background-color: gainsboro"|11||style="background-color: gainsboro"| 12||style="background-color: gainsboro"| 13||style="background-color: gainsboro"| 14|| 14 |
|||
|} |
|||
'''TABEL 2: Sc-Y-Lu-Lr periodiek systeem f-blok toont elektron configuraties''' |
|||
(lichtgrijze tint = overeenstemming met geïdealiseerd aantal ''f'' elektronen; donkergrijze tint = onregelmatigheid) |
|||
{| class="wikitable" |
|||
|- |
|||
|'''Periode 6''' || '''La'''|| '''Ce'''|| '''Pr''' || '''Nd''' || '''Pm''' || '''Sm''' || '''Eu''' || '''Gd''' || '''Tb''' || '''Dy''' || '''Ho''' || '''Er''' || '''Tm''' || '''Yb''' |
|||
|- |
|||
| Geïdealiseerde f-elektronen|| 1|| 2|| 3|| 4|| 5|| 6|| 7|| 8|| 9|| 10|| 11|| 12|| 13|| 14 |
|||
|- |
|||
| Echt aantal|| style="background-color: gainsboro"|0||style="background-color: gainsboro"|1|| 3|| 4|| 5|| 6|| 7|| style="background-color: gainsboro"|7|| 9|| 10|| 11|| 12|| 13|| 14 |
|||
|- |
|||
|'''Periode 7''' || '''Ac''' || '''Th'''|| '''Pa'''|| '''U'''|| '''Np'''|| '''Pu'''|| '''Am'''|| '''Cm'''|| '''Bk'''|| '''Cf'''|| '''Es'''|| '''Fm'''|| '''Md'''|| '''No''' |
|||
|- |
|||
| Echt aantal|| style="background-color: gainsboro"|0||style="background-color: gainsboro"|0||style="background-color: gainsboro"| 2||style="background-color: gainsboro"| 3||style="background-color: gainsboro"| 4|| 6|| 7||style="background-color: gainsboro"| 7|| 9|| 10|| 11|| 12|| 13|| 14 |
|||
|} |
|||
Voor geïdealiseerde f-elektron aantallen in Tabel 1 zie: Newell, S. B. (1977). ''Chemistry: An Introduction.'' Boston: Little, Brown and Company, p. 196. Voor Tabel 2 zie: Brown et al. (2009). ''Chemistry: The Central Science'' (11<sup>ed.</sup>). Upper Saddle River, New Jersey: Pearson Education, pp. 207, 208–210. In beide gevallen zijn de aantallen consequent met een ideaal [[elektronenconfiguratie|grondniveau configuratie]] voor f-blok elementen van [Edelgas](n–2)''f'' <sup>x</sup>ns<sup>2</sup> waar n = het periode nummer en x = een geheel getal van 1 tot 14. Zie: Rouvray D. H. (2015). 'The Surprising Periodic Table: Ten Remarkable Facts'. In B. Hargittai & I. Hargittai (eds). ''Culture of Chemistry: The Best Articles on the Human Side of 20th-Century Chemistry from the Archives of the Chemical Intelligencer.'' New York: Springer Science+Business Media, pp. 183–193 (190).</ref> Anders dan bij variant III, is er geen dubbelzinnigheid in de compositie van groep 3. |
|||
===Andere indelingen=== |
|||
[[File:32 column PT.jpg|thumb|650px|Een 32-kolom periodiek systeem]] |
|||
In de 100 jaar sinds Mendelejev zijn systeem eerst publiceerde in 1869 zijn er een geschatte 700 versies van het periodiek systeem gepubliceerd.<ref name=Scerri20>Scerri 2007, p. 20</ref> Naast de vele rechthoekige variaties, zijn er ook andere formaten voor het periodiek systeem ontwikkelt, bijvoorbeeld<ref group="n">Zie [http://www.meta-synthesis.com/webbook//35_pt/pt_database.php ''The Internet database of periodic tables''] voor afbeeldingen van dit soort varianten.</ref> een cirkel, kubus, cilinder, gebouw, spiraal, [[lemniscaat]],<ref>{{cite web |url=http://cultureofchemistry.fieldofscience.com/2009/03/weird-words-of-science-lemniscate.html |title=Weird Words of Science: Lemniscate Elemental Landscapes|last=|first=|publisher=fieldofscience.com |date=22 March 2009 |website=Fields of Science |access-date=4 January 2016}}</ref> octagonaal prisma, piramide, bol en driehoek. Zulke alternatieven worden vaak ontworpen om de chemische of fysische eigenschappen te benadrukken die niet even klaarblijkelijk zijn als in traditionele periodieke systemen.<ref name=Scerri20/> |
|||
Het modern periodiek systeem word soms uitgebreid tot het lange, of 32-kolom formaat, door de f-blok elementen in hun natuurlijke positie te plaatsen tussen de s- en d-blokken. In tegenstelling tot de 18-kolom versie zorgt deze indeling voor "geen verstoringen in de reeks stijgende atoomnummers."<ref>{{cite book|last = Scerri |first = E. |title= A Tale of 7 Eelements| place= Oxford|publisher = Oxford University Press|isbn=978-0-19-539131-2}}</ref> De relatie tussen het f-blok en de andere blokken van het periodiek systeem worden zo ook makkelijker te zien.<ref>{{cite book|last = Newell |first = S. B. |title= Chemistry: An introduction| place= Boston|publisher = Little, Brown and Company|page= 196|isbn=978-0-19-539131-2}}</ref> Jensen beveelt een tabelvorm aan met 32 kolommen, omdat de lanthanides en actinides anders voor studenten als onbelangrijk worden gezien, die kunnen genegeerd worden.<ref>{{cite journal |last=Jensen |first=W. B. |date=1982 |title=Classification, Symmetry and the Periodic Table |journal=Computers & Mathematics with Applications |volume=12B |issue=1/2 |doi=10.1016/0898-1221(86)90167-7 |pages=487–510(498)}}</ref> Ondanks deze voordelen van het 32-kolom formaat, wordt het meestal ontweken in boeken, omdat het veel te groot is voor een boekformaat.<ref>{{cite journal|last=Leach|first = M. R.|title=Concerning electronegativity as a basic elemental property and why the periodic table is usually represented in its medium form|journal= Foundations of Chemistry|volume=15|issue=1|pages=13–29|doi=10.1007/s10698-012-9151-3}}</ref> |
|||
[[File:Elementspiral (polyatomic).svg|thumb|left|Theodor Benfey's spiraal periodiek systeem]] |
|||
Een populaire<ref>{{cite journal|last1=Emsely |first1=J |last2=Sharp |first2=R|title=The periodic table: Top of the charts|journal=The Independent |date=21 June 2010 |url=http://www.independent.co.uk/news/science/the-periodic-table-top-of-the-charts-2005992.html}}</ref> alternatieve structuur is dat van Theodor Benfey (1960). De elementen worden gerangschikt in een doorlopende spiraal, met waterstof in het centrum en de overgangsmetalen, lanthanides en actinides in schiereilanden.<ref>{{cite journal |last=Seaborg |first=G. |year=1964 |title=Plutonium: The Ornery Element |journal=Chemistry |volume=37 |issue=6 |page=14}}</ref> |
|||
De meeste periodieke systemen zijn 2-dimensionaal;<ref name=emsley/> maar 3-dimensionale systemen bestonden al sinds 1862 (wat het periodiek systeem van Mendelejev uit 1869 voorafgaat). Recentere voorbeelden zijn Courtines' Periodieke Classificatie (1925)<ref>{{cite web |url=http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=65 |title=1925 Courtines' Periodic Classification|author=Mark R. Leach |accessdate=16 October 2012}}</ref> Wringley's Lamina Systeem (1949),<ref>{{cite web |url=http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=295 |title=1949 Wringley's Lamina System|author=Mark R. Leach |accessdate=16 October 2012}}</ref> Giguère's Periodieke Helix (1965)<ref>{{cite book |title=Graphical Representations of the Periodic System During One Hundred Years |last=Mazurs |first= E.G. |year= 1974 |publisher=University of Alabama Press |location=Alabama |page=111 |isbn=978-0-8173-3200-6}}</ref> en Dufour's Periodieke Boom (1996).<ref>{{cite web |url=http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=39 |title=1996 Dufour's Periodic Tree|author=Mark R. Leach |accessdate=16 October 2012}}</ref> Om nog verder te gaan, Stowe's Fysicus Periodieke Tabel (1989)<ref>{{cite web |url=http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=38 |title=1989 Physicist's Periodic Table by Timothy Stowe|author=Mark R. Leach |accessdate=16 October 2012}}</ref> wordt beschreven als 4-dimensionaal (drie ruimtelijke dimensies en één kleurdimensie).<ref>{{cite journal |last=Bradley |first=D.|title=At last, a definitive periodic table?|journal=ChemViews Magazine |
|||
|date=20 July 2011|url=http://www.chemistryviews.org/details/ezine/1247399/At_Last_A_Definitive_Periodic_Table.html|doi=10.1002/chemv.201000107}}</ref> |
|||
De verschillende vormen van het periodiek systeem kan beschreven worden als "liegen" op een chemisch-fysiek continuüm.<ref>Scerri 2007, pp. 285‒86</ref> Richting het chemische uiteinde kan men bijvoorbeeld Rayner-Canham's "onhandelbare"<ref>Scerri 2007, p. 285</ref> Inorganische Chemicus' Periodiek Systeem (2002),<ref>{{cite web |url=http://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=429|title=2002 Inorganic Chemist's Periodic Table|author=Mark R. Leach |accessdate=16 October 2012}}</ref> wat trends en patronen, en ongewone chemische relaties en eigenschappen benadrukt. Aan het fysische uiteinde van het continuüm ligt Janet's Linkse-Stap Periodiek Systeem (1928). Het heeft een structuur met een dichtere band met de volgorde van het vullen van de elektronenschillen, en dus ook met [[kwantummechanica]].<ref>{{cite journal |last=Scerri |first=E. |title=The role of triads in the evolution of the periodic table: Past and present|journal=Journal of Chemical Education|year=2008|volume=85|issue=4|pages=585–89 (see p.589)|doi=10.1021/ed085p585|bibcode = 2008JChEd..85..585S }}</ref> Ergens in het midden van het continuüm ligt de alomtegenwoordige standaardvorm van het periodiek systeem. Het wordt beschouwd als beter in het vertonen van empirische trends in een fysische staat, elektrische en thermische conductiviteit, en oxidatiegetallen, en andere eigenschappen die makkelijk kunnen afgeleid worden uit traditionele technieken uit het chemisch laboratorium.<ref>{{cite journal |last1=Bent |first1=H. A. |last2=Weinhold |first2=F|title=Supporting information: News from the periodic table: An introduction to "Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships"|journal=Journal of Chemical Education|year=2007|volume=84|issue=7|pages=3–4|doi=10.1021/ed084p1145}}</ref> |
|||
{{clear}} |
|||
{|cellpadding="1" cellspacing="1" style="font-size:90%; border:1px solid #a9a9a9; text-align:center; padding:2px; background:#f8f8f8;" |
|||
! colspan=33 style="background:#d8d8d8;" | Janet linkse-stap periodiek systeem |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 1s |
|||
| colspan=30 | |
|||
| style="background:#ff9999"|[[Waterstof|H]] |
|||
| style="background:#ff9999"|[[Helium|He]] |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 2s |
|||
| colspan=30 | |
|||
| style="background:#ff9999"|[[Lithium|Li]] |
|||
| style="background:#ff9999"|[[Beryllium|Be]] |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 2p 3s |
|||
| colspan=24 | |
|||
|style="background:#fdff8c"|[[Boron|B]] |
|||
|style="background:#fdff8c"|[[Koolstof|C]] |
|||
|style="background:#fdff8c"|[[Stikstof|N]] |
|||
|style="background:#fdff8c"|[[Zuurstof|O]] |
|||
|style="background:#fdff8c"|[[Fluor|F]] |
|||
|style="background:#fdff8c"|[[Neon|Ne]] |
|||
|style="background:#ff9999"|[[Natrium|Na]] |
|||
|style="background:#ff9999"|[[Magnesium|Mg]] |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 3p 4s |
|||
| colspan=24 | |
|||
|style="background:#fdff8c"|[[Aluminium|Al]] |
|||
|style="background:#fdff8c"|[[Silicium|Si]] |
|||
|style="background:#fdff8c"|[[Fosfor|P]] |
|||
|style="background:#fdff8c"|[[Zwavel|S]] |
|||
|style="background:#fdff8c"|[[Chloor|Cl]] |
|||
|style="background:#fdff8c"|[[Argon|Ar]] |
|||
|style="background:#ff9999"|[[Kalium|K]] |
|||
|style="background:#ff9999"|[[Calcium|Ca]] |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 3d 4p 5s |
|||
| colspan=14 | |
|||
|style="background:#99ccff"|[[Scandium|Sc]] |
|||
|style="background:#99ccff"|[[Titanium|Ti]] |
|||
|style="background:#99ccff"|[[Vanadium|V]] |
|||
|style="background:#99ccff"|[[Chroom|Cr]] |
|||
|style="background:#99ccff"|[[Mangaan|Mn]] |
|||
|style="background:#99ccff"|[[Ijzer|Fe]] |
|||
|style="background:#99ccff"|[[Kobalt|Co]] |
|||
|style="background:#99ccff"|[[Nikkel|Ni]] |
|||
|style="background:#99ccff"|[[koper|Cu]] |
|||
|style="background:#99ccff"|[[Zink|Zn]] |
|||
|style="background:#fdff8c"|[[Gallium|Ga]] |
|||
|style="background:#fdff8c"|[[Germanium|Ge]] |
|||
|style="background:#fdff8c"|[[Arseen|As]] |
|||
|style="background:#fdff8c"|[[Seleen|Se]] |
|||
|style="background:#fdff8c"|[[Broom|Br]] |
|||
|style="background:#fdff8c"|[[Krypton|Kr]] |
|||
|style="background:#ff9999"|[[Rubidium|Rb]] |
|||
|style="background:#ff9999"|[[Strontium|Sr]] |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 4d 5p 6s |
|||
| colspan=14 | |
|||
|style="background:#99ccff"|[[Yttrium|Y]] |
|||
|style="background:#99ccff"|[[Zirkonium|Zr]] |
|||
|style="background:#99ccff"|[[Niobium|Nb]] |
|||
|style="background:#99ccff"|[[Molybdeen|Mo]] |
|||
|style="background:#99ccff"|[[Technetium|Tc]] |
|||
|style="background:#99ccff"|[[Ruthenium|Ru]] |
|||
|style="background:#99ccff"|[[Rodium|Rh]] |
|||
|style="background:#99ccff"|[[Palladium|Pd]] |
|||
|style="background:#99ccff"|[[Zilver|Ag]] |
|||
|style="background:#99ccff"|[[Cadmium|Cd]] |
|||
|style="background:#fdff8c"|[[Indium|In]] |
|||
|style="background:#fdff8c"|[[Tin|Sn]] |
|||
|style="background:#fdff8c"|[[Antimoon|Sb]] |
|||
|style="background:#fdff8c"|[[Telluur|Te]] |
|||
|style="background:#fdff8c"|[[Jodium| I ]] |
|||
|style="background:#fdff8c"|[[Xenon|Xe]] |
|||
|style="background:#ff9999"|[[Cesium|Cs]] |
|||
|style="background:#ff9999"|[[Barium|Ba]] |
|||
|- |
|||
| width="3.04%" style="text-align:right; padding-right:2px;" | {{nowrap|4f 5d 6p 7s}} |
|||
| width="3.03%" style="background:#9bff99"|[[Lanthaan |La]] |
|||
| width="3.03%" style="background:#9bff99"|[[Cerium|Ce]] |
|||
| width="3.03%" style="background:#9bff99"|[[Praseodymium|Pr]] |
|||
| width="3.03%" style="background:#9bff99"|[[Neodymium|Nd]] |
|||
| width="3.03%" style="background:#9bff99"|[[Promethium|Pm]] |
|||
| width="3.03%" style="background:#9bff99"|[[Samarium|Sm]] |
|||
| width="3.03%" style="background:#9bff99"|[[Europium|Eu]] |
|||
| width="3.03%" style="background:#9bff99"|[[Gadolinium|Gd]] |
|||
| width="3.03%" style="background:#9bff99"|[[Terbium|Tb]] |
|||
| width="3.03%" style="background:#9bff99"|[[Dysprosium|Dy]] |
|||
| width="3.03%" style="background:#9bff99"|[[Holmium|Ho]] |
|||
| width="3.03%" style="background:#9bff99"|[[Erbium|Er]] |
|||
| width="3.03%" style="background:#9bff99"|[[Thulium|Tm]] |
|||
| width="3.03%" style="background:#9bff99"|[[Ytterbium|Yb]] |
|||
| width="3.03%" style="background:#99ccff"|[[Lutetium|Lu]] |
|||
| width="3.03%" style="background:#99ccff"|[[Hafnium|Hf]] |
|||
| width="3.03%" style="background:#99ccff"|[[Tantaal|Ta]] |
|||
| width="3.03%" style="background:#99ccff"|[[Wolfraam|W]] |
|||
| width="3.03%" style="background:#99ccff"|[[Renium|Re]] |
|||
| width="3.03%" style="background:#99ccff"|[[Osmium|Os]] |
|||
| width="3.03%" style="background:#99ccff"|[[Iridium|Ir]] |
|||
| width="3.03%" style="background:#99ccff"|[[Platina|Pt]] |
|||
| width="3.03%" style="background:#99ccff"|[[Goud|Au]] |
|||
| width="3.03%" style="background:#99ccff"|[[Kwik|Hg]] |
|||
| width="3.03%" style="background:#fdff8c"|[[Thallium|Tl]] |
|||
| width="3.03%" style="background:#fdff8c"|[[Lood|Pb]] |
|||
| width="3.03%" style="background:#fdff8c"|[[Bismut |Bi]] |
|||
| width="3.03%" style="background:#fdff8c"|[[Polonium|Po]] |
|||
| width="3.03%" style="background:#fdff8c"|[[Astaat|At]] |
|||
| width="3.03%" style="background:#fdff8c"|[[Radon|Rn]] |
|||
| width="3.03%" style="background:#ff9999"|[[Francium|Fr]] |
|||
| width="3.03%" style="background:#ff9999"|[[Radium|Ra]] |
|||
|- |
|||
| style="text-align:right; padding-right:2px;" | 5f 6d 7p 8s |
|||
|style="background:#9bff99"|[[Actinium|Ac]] |
|||
|style="background:#9bff99"|[[Thorium|Th]] |
|||
|style="background:#9bff99"|[[Protactinium|Pa]] |
|||
|style="background:#9bff99"|[[Uranium|U]] |
|||
|style="background:#9bff99"|[[Neptunium|Np]] |
|||
|style="background:#9bff99"|[[Plutonium|Pu]] |
|||
|style="background:#9bff99"|[[Americium|Am]] |
|||
|style="background:#9bff99"|[[Curium|Cm]] |
|||
|style="background:#9bff99"|[[Berkelium|Bk]] |
|||
|style="background:#9bff99"|[[Californium|Cf]] |
|||
|style="background:#9bff99"|[[Einsteinium|Es]] |
|||
|style="background:#9bff99"|[[Fermium|Fm]] |
|||
|style="background:#9bff99"|[[Mendelevium|Md]] |
|||
|style="background:#9bff99"|[[Nobelium|No]] |
|||
|style="background:#99ccff"|[[Lawrencium|Lr]] |
|||
|style="background:#99ccff"|[[Rutherfordium|Rf]] |
|||
|style="background:#99ccff"|[[Dubnium|Db]] |
|||
|style="background:#99ccff"|[[Seaborgium|Sg]] |
|||
|style="background:#99ccff"|[[Bohrium|Bh]] |
|||
|style="background:#99ccff"|[[Hassium|Hs]] |
|||
|style="background:#99ccff"|[[Meitnerium|Mt]] |
|||
|style="background:#99ccff"|[[Darmstadtium|Ds]] |
|||
|style="background:#99ccff"|[[Röntgenium|Rg]] |
|||
|style="background:#99ccff"|[[Copernicium|Cn]] |
|||
|style="background:#fdff8c"|[[Ununtrium|113]] |
|||
|style="background:#fdff8c"|[[Flerovium|Fl]] |
|||
|style="background:#fdff8c"|[[Ununpentium|115]] |
|||
|style="background:#fdff8c"|[[Livermorium|Lv]] |
|||
|style="background:#fdff8c"|[[Ununseptium|117]] |
|||
|style="background:#fdff8c"|[[Ununoctium|118]] |
|||
|style="background:#ff9999"|119 |
|||
|style="background:#ff9999"|120 |
|||
|- |
|||
| colspan=33 style="height:7px; border-bottom:1px solid black" | |
|||
|- style="font-size:90%; line-height:100%;" |
|||
| |
|||
| colspan=14 style="background:#9bff99" | [[f-blok]] |
|||
| colspan=10 style="background:#99ccff" | [[d-blok]] |
|||
| colspan=6 style="background:#fdff8c" | [[p-blok]] |
|||
| colspan=2 style="background:#ff9999" | [[s-blok]] |
|||
|- |
|||
| colspan=33 style="text-align:left;"|Dit periodiek systeem is congruenter met deze volgorde waarin elektronenschillen gevuld zijn, zoals getoond in de bijhorende reeks aan de linkse zijde (lees van boven naar beneden, links naar rechts). |
|||
|} |
|||
==Open vragen en controverses== |
|||
===Elementen met onbekende chemische eigenschappen=== |
|||
Hoewel alle elementen tot ununoctium ontdekt zijn, van alle elementen boven Hassium (element 108) hebben enkel copernicium (element 112) en flerovium (element 114) bekende chemische eigenschappen. De andere elementen kunnen zich mogelijk anders gedragen dan wat met extrapolatie voorspelt wordt, vanwege relativistische effecten; bijvoorbeeld, er wordt voorspeld dat flerovium enkele edelgas-achtige eigenschappen vertoont, maar het wordt momenteel in de koolstofgroep geplaatst.<ref>{{cite book|title=The Chemistry of Superheavy Elements|last=Schändel|first=M|year=2003|publisher=Kluwer Academic Publishers|location=Dordrecht|isbn=1-4020-1250-0|page=277}}</ref> Recentere experimenten tonen echter aan dat flerovium zich chemisch als lood gedraagt, zoals verwacht van zijn plaats in het periodiek systeem.<ref>Scerri 2011, pp. 142–143</ref> |
|||
===Verdere uitbreidingen van het periodiek systeem=== |
|||
Het is onduidelijk of nieuwe elementen het patroon van het huidige periodiek systeem zullen blijven volgen in periode 8, of verdere aanpassing nodig zal zijn. [[Glenn Seaborg|Seaborg]] verwachtte dat periode 8 de rest van het systeem precies zou volgen, zodat er een nieuw s-blok zou komen voor elementen 119 en 120, en een g-blok voor de volgende 18 elementen, en 30 extra nieuwe elementen voor de f-, d- en p-blokken.<ref>{{cite journal|doi=10.2307/3963006|last=Frazier|first=K.|title=Superheavy Elements|journal=Science News|volume=113|issue=15|pages=236–238|year=1978|jstor=3963006}}</ref> Recenter hebben fysici zoals Pekka Pyykkö getheoretiseerd dat deze extra elementen de Madelung regel, wat voorspelt hoe elektronenschillen worden opgevuld en dus het uitzicht van het periodiek systeem beïnvloedt, niet volgen.<ref>{{Cite journal|last1=Pyykkö|first1=P.|authorlink=Pekka Pyykkö|title=A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions|journal=Physical Chemistry Chemical Physics|volume=13|issue=1|pages=161–168|year=2011|pmid=20967377|doi=10.1039/c0cp01575j|bibcode = 2011PCCP...13..161P}}</ref> |
|||
===Element met hoogst mogelijk atoomnummer=== |
|||
Het aantal mogelijke elementen is niet gekend. Een zeer vroege suggestie van Elliot Adams in 1911, gebaseerd op rangschikking van elementen in elke periode, was dat elementen met een atoomgewicht groter dan 256± (wat tussen elementen 99 en 100 zou liggen in het moderne systeem) niet bestonden.<ref>{{cite journal |last=Elliot|first=Q. A. |title=A modification of the periodic table|journal=Journal of the American Chemical Society|year=1911|volume=33 |issue=5 |pages=684–688 (688)|doi=10.1021/ja02218a004}}</ref> Een hogere, recentere schatting zegt dat het periodiek systeem binnenkort zal eindigen na het stabiliteitseiland,<ref name=EB>{{cite web|last1= Seaborg|first1=G.|url=http://www.britannica.com/EBchecked/topic/603220/transuranium-element|title=transuranium element (chemical element)|publisher=Encyclopædia Britannica|date=c. 2006|accessdate=16 March 2010}}</ref> wat verwacht wordt rond element 126, omdat de uitbreiding van de periodieke en nuclide systemen beperkt wordt door de driplijnen van protonen en neutronen.<ref>{{cite journal | first1=S.|last1=Cwiok|first2= P.-H.|last2= Heenen |first3= W.|last3= Nazarewicz |year=2005|title=Shape coexistence and triaxiality in the superheavy nuclei|journal=Nature|volume=433|bibcode = 2005Natur.433..705C |doi = 10.1038/nature03336 | issue=7027 | pmid=15716943 | pages=705–9}}</ref> Andere voorspellingen van het einde van het periodiek systeem zijn element 128 door John Emsley,<ref name="emsley"/> element 137 door [[Richard Feynman]],<ref>[http://www.rsc.org/chemistryworld/Issues/2010/November/ColumnThecrucible.asp Ball, P. 2010, Column: The crucible] in ''Chemistry World,'' November, Royal Society of Chemistry</ref> en element 155 door Albert Khazan.<ref name="emsley"/><ref group="n">Karol (2002, p. 63) beweert dat zwaartekrachtseffecten belangrijk zouden worden wanneer atoomnummers astronomisch groot worden, en zo andere fenomenen van super-massieve kern onstabiliteit overstijgen, en dat [[neutronenster]]ren (met atoomnummers tot 10<sup>21</sup>) kunnen gezien worden als voorstellingen van de zwaarste bekende elementen in het universum. See: Karol P. J. (2002). "The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond". ''Journal of Chemical Education'' '''79''' (1): 60–63.</ref> |
|||
====Atoommodel van Bohr==== |
|||
Het [[atoommodel van Bohr]] vertoont moeilijkheden voor atoomnummers groter dan 137, omdat zulke atomen 1s elektronen zouden hebben met een grotere snelheid dan licht.<ref>{{cite book |
|||
|first1=R. |last1=Eisberg|first2= R.|last2= Resnick |
|||
|year=1985 |
|||
|title=Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles |
|||
|publisher=[[John Wiley & Sons|Wiley]] |
|||
|isbn= |
|||
}}</ref> Het onrelativistische Bohr model is dus niet precies wanner het toegepast word op zulke elementen. |
|||
====Relativistische Dirac vergelijking==== |
|||
De relativistische Dirac vergelijking vertoont moeilijkheden voor atomen met meer dan 137 protonen. Voor zulke elementen is de golffunctie van het Dirac grondniveau ritmisch in plaats van gebonden, en zijn er geen gaten tussen de positieve en negatieve energiespectra, zoals bij de Klein paradox.<ref> |
|||
{{cite book |
|||
|first1=J. D.|last1= Bjorken|first2=S. D.|last2= Drell |
|||
|year=1964 |
|||
|title=Relativistic Quantum Mechanics |
|||
|publisher=McGraw-Hill |
|||
|isbn= |
|||
}}</ref> Preciezere berekeningen die rekening houden met de eindige grootte van de kern tonen aan dat de bindingsenergie eerst de limiet voor elementen overstijgt bij meer dan 173 protonen. Voor zwaardere elementen, als de binnenste orbitaal niet gevuld is, zal het elektrisch veld van de kern een elektron uit de vacuüm trekken, wat resulteert in het spontaan uitstoten van een positron;<ref> |
|||
{{cite journal |
|||
|first1=W. |last1=Greiner|first2= S. |last2=Schramm |
|||
|year=2008 |
|||
|title=American Journal of Physics |
|||
|volume=76 |pages=509 |
|||
|doi= |
|||
}}, and references therein.</ref> maar dit gebeurt niet als de binnenste orbitaal gevuld word, dus is element 173 niet noodzakelijk het einde van het periodiek systeem.<ref name="rscend">{{cite web|last=Ball |first=P.|url=http://www.rsc.org/chemistryworld/Issues/2010/November/ColumnThecrucible.asp |title=Would Element 137 Really Spell the End of the Periodic Table? Philip Ball Examines the Evidence |date=November 2010 |publisher=[[Royal Society of Chemistry]] |accessdate=30 September 2012}}</ref> |
|||
===Plaatsen van waterstof en helium=== |
|||
Volgens normale elektronenconfiguratie staan waterstof en helium in groepen 1 en 2, boven lithium en beryllium.<ref name="Gray12">Gray, p. 12</ref> Maar zulke plaatsing wordt zelden gebruikt buiten de context van elektronenconfiguratie: toen de edelgassen eerst ontdekt werden rond 1900, werden ze "groep 0" genoemd, omdat er toen nog geen chemische reactiviteit bekend was in die elementen, en helium werd bovenaan deze groep geplaatst, omdat het ook chemisch inert was. Toen de groep van formeel nummer veranderde, bleven veel auteurs toch helium boven neon plaatsen, in groep 18; deze notatie wordt ook gebruikt in de moderne IUPAC tabel.<ref>{{Cite web|url = http://www.iupac.org/fileadmin/user_upload/news/IUPAC_Periodic_Table-1May13.pdf|title = IUPAC Periodic Table of the Elements|date = 2013-05-01|accessdate = 2015-09-20|website = iupac.org|publisher = IUPAC|author = IUPAC}}</ref> |
|||
De chemische eigenschappen van waterstof zijn niet gelijkaardig aan die van de alkalimetalen in groep 1, dus wordt waterstof soms ergens andere geplaatst: het populairste alternatief is groep 17; onder andere vanwege de strikt univalente, grotendeels niet-metallische chemie van waterstof, vergelijkbaar met dat van fluor (wat normaal gezien bovenaan groep 17 staat). Soms wordt waterstof in twee groepen tegelijkertijd geplaatst, om te duiden op de eigenschappen die waterstof deelt met zowel de alkalimetalen en de halogenen.<ref>{{cite journal |last=Seaborg |first= G.|title=The chemical and radioactive properties of the heavy elements |journal= Chemical English Newspaper |year=1945 |volume=23 |issue=23 |pages=2190–2193}}</ref> Een ander voorstel is boven koolstof in groep 14, omdat het zo past in de trends van stijgend ionisatiepotentiaal en elektronenaffiniteit.<ref name="hydrogen">{{cite journal |last=Cronyn |first=M. W. |title=The Proper Place for Hydrogen in the Periodic Table |journal=Journal of Chemical Education |volume=80 |issue=8 |date=August 2003 |pages=947–951|bibcode = 2003JChEd..80..947C |doi = 10.1021/ed080p947 }}</ref> Waterstof word ook soms apart van de rest van het periodiek systeem geplaatst, omdat de algemene eigenschappen van waterstof niet perfect passen in enige groep: in tegenstelling tot waterstof tonen de andere groep 1 elementen metallisch gedrag; de groep 17 elementen vormen in het algemeen zouten; de andere groepen tonen wat multivalente chemie. Het andere periode 1 element, helium, word soms ook apart getoond.<ref>Greenwood & Earnshaw, throughout the book</ref> Helium heeft enkel twee valentie-elektronen, terwijl de rest van de edelgassen er acht hebben (hoewel de buitengewone inertie van helium vergelijkbaar is met dat neon en argon<ref>{{Cite book|title = Modeling Marvels: Computational Anticipation of Novel Molecules|url = https://books.google.com/books?id=IoFzgBSSCwEC|publisher = Springer Science & Business Media|date = 2008-12-05|isbn = 9781402069734|first = Errol G.|last = Lewars|pages = 69–71}}</ref>). |
|||
===Groepen van de overgangsmetalen=== |
|||
De IUPAC definitie van een overgangsmetaal als een element wiens atoom een incomplete d-subschil heeft, of waaruit kationen met een incomplete d-subschil kunnen voortkomen.<ref name="ReferenceA"> [[IUPAC]], ''Compendium of Chemical Terminology'' 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006-) [http://goldbook.iupac.org/T06456.html "Transition Element"]</ref> Met deze definitie zijn alle elementen in groepen 3-11 overgangsmetalen. Dit betekent dat, volgens de IUPAC, groep 12 geen overgangsmetalen bevat, waaronder zink, cadmium en kwik. |
|||
Sommige chemici zien de d-blok elementen en overgangsmetalen als één en dezelfde, en zien groep 12 dus wel als deel van de overgangsmetalen. In dit geval worden de elementen van groep 12 beschouwd als speciale gevallen, waar de d-elektronen normaal geen deel uitmaken van chemische bindingen. De recente ontdekking dat kwik zijn d-elektronen kan binden tot kwik(IV) fluoride heeft sommigen overtuigt dat kwik als overgangsmetaal beschouwd kan worden.<ref>{{cite journal |last1=Xuefang|first1= W. |last2=Andrews|first2=L.|last3=Riedel|first3=S.|last4= Kaupp|first4=M |title=Mercury Is a Transition Metal: The First Experimental Evidence for HgF<sub>4</sub> |journal=Angew. Chem. Int. Ed. |year=2007 |volume=46 |issue=44 |pages=8371–8375 |doi=10.1002/anie.200703710 |pmid=17899620}}</ref> Anderen, waaronder Jensen,<ref name=Jensen2008>{{cite journal |title=Is Mercury Now a Transition Element? |last = Jensen |first= W. B.|journal=J. Chem. Educ. |year=2008 |volume=85 |pages=1182–1183 |doi=10.1021/ed085p1182|bibcode = 2008JChEd..85.1182J |issue=9 }}</ref> beredeneren dat de formatie van een binding als kwikfluoride enkel kan ontstaan onder zeer abnormale condities. Hierdoor kan kwik niet als overgangsmetaal beschouwd worden met een redelijke interpretatie van de definitie.<ref name=Jensen2008/> |
|||
Nog andere chemici vinden dat groep 3 niet tot de overgangsmetalen behoord, omdat die elementen geen ionen met een gedeeltelijk gevulde d-schil vormen en dus geen karakteristieke eigenschappen van overgangsmetalen vertonen.<ref>{{cite book |last1=Rayner-Canham|first1=G|last2=Overton|first2=T|title=Descriptive inorganic chemistry|publisher=W H Freeman|pages=484–485|location=New York|edition=4th|isbn=0-7167-8963-9}}</ref> In dit geval worden groepen 4-11 als overgangsmetalen beschouwd. |
|||
===Periodes 6 en 7 in groep 3=== |
|||
Hoewel scandium en yttrium altijd de eerste twee elementen van groep 3 zijn, is er onenigheid over de andere twee plaatsen. Deze zijn oftewel lanthaan en actinium, of lutetium en lawrencium. Fysische en chemische argumenten zijn gegeven voor die laatste,<ref>{{cite book |last1=Thyssen |first1=P. |last2=Binnemanns|first2=K. |editor-last1=Gschneidner Jr.|editor-first1=K. A. |editor-last2=Büzli |editor-first2=J-C. J.|editor-last3=Pecharsky |editor-first3=V. K.| title=Handbook on the Physics and Chemistry of Rare Earths | volume=41| publisher=Elsevier |date=2011 |pages=80–81|chapter=1: Accommodation of the rare earths in the periodic table: A historical analysis |isbn=978-0-444-53590-0|location=Amsterdam}}</ref><ref>{{cite book |last1=Keeler |first1=J. |last2=Wothers |first2=P. |publisher=Oxford University|location=Oxford |date=2014 |title=Chemical Structure and Reactivity: An Integrated Approach| ISBN=978-0-19-9604135|page=259}}</ref> maar niet iedereen is overtuigd.<ref name="finally">{{cite journal|last=Scerri|first=E.|year=2012|journal=Chemistry International|volume=34|issue= 4|url=http://www.iupac.org/publications/ci/2012/3404/ud.html|title=Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?}}</ref> De meeste chemici zijn zich niet bewust van deze controverse.<ref>{{cite web |url=http://www.nature.com/news/exotic-atom-struggles-to-find-its-place-in-the-periodic-table-1.17275 |title= Exotic atom struggles to find its place in the periodic table|last1=Castelvecchi |first1=D. |date= 8 April 2015|website= Nature News|access-date=20 Sep 2015}}</ref> |
|||
Lanthaan en actinium worden traditioneel als de twee lagere leden van groep 3.<ref>{{cite book |last=Emsley |first=J. |date=2011 |title=Nature's Building Blocks |publisher=Oxford University | edition=new|location =Oxford |isbn=978-0-19-960563-7|page=651}}</ref><ref>See, for example: {{cite web |url= http://www.rsc.org/periodic-table|title= Periodic Table|author=<!--Staff writer(s); no by-line.--> |date= |website= |publisher= Royal Society of Chemistry|access-date=20 Sep 2015}}</ref> Men heeft voorgesteld dat deze opmaak opkwam in 1940, toen periodieke systemen gebaseerd op elektronenconfiguratie het concept van de genuanceerde elektron. De configuraties van cesium, barium en lanthaan zijn [Xe]6s<sup>1</sup>, [Xe]6s<sup>2</sup> en [Xe]5d<sup>1</sup> 6s<sup>2</sup>. Lanthaan heeft dus een 5d differentiërend elektron, wat het het eerste lid van het d-blok in groep 3 voor periode 6.<ref name=Jensen1982>{{cite journal |title=The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table |author=William B. Jensen |journal=J. Chem. Educ. |year=1982 |volume=59 |issue = 8|pages=634–636 |doi=10.1021/ed059p634}}</ref> Een consequente reeks elektronenconfiguraties wordt zo zichtbaar in groep 3: scandium [Ar]3d<sup>14</sup>s<sup>2</sup>, yttrium [Kr]4d<sup>15</sup>s<sup>2</sup> en lanthaan [Xe]5d<sup>16</sup>s<sup>2</sup>. In periode 6 kreeg ytterbium een elektronenconfiguratie van [Xe]4f<sup>13</sup>5d<sup>1</sup>6s<sup>2</sup> en lutetium [Xe]4f<sup>14</sup>5d<sup>1</sup>6s<sup>2</sup>, wat resulteert in een 4f differentiërend elektron voor lutetium, wat het het laatste lid van periode 6 maakt.<ref name=Jensen1982/> Matthias<ref>{{cite book |last=Matthias |first=B. T. |editor-last=Wallace |editor-first=P. R. |title=Superconductivity, Proceedings of the Advanced Summer Study Institute, McGill University, Montreal |volume = 1|chapter= Systematics of Super Conductivity |publisher=Gordon and Breach, Science Publishers |date=1969 |pages=225–294 (249)|location=New York}}</ref> beschrijft de plaatsing van lanthaan onder yttrium als "een fout in het periodiek systeem – helaas bevorderd door Sargent-Welch...en...iedereen kopieerde hen." Lavelle<ref>{{cite journal| last = Lavelle| first = L.| date = 2009| title = Response to Misapplying the periodic law| journal = Journal of Chemical Education| volume = 86| issue = 10| pages = 1187| doi = 10.1021/ed086p118}}</ref> argumenteerde voor het behoud van lanthaan onder yttrium aangezien meerdere bekende handboeken periodieke systemen in deze versie gebruikten. |
|||
In andere systemen zijn lutetium en lawrencium de overblijvende groep 3 leden.<ref>See, for example: {{cite book |last1=Brown |first1=T. L. |last2=LeMay Jr. |first2=H. E. |last3=Bursten |first3=B. E. |last4=Murphy |first4=C. J.|date=2009 |title=Chemistry: The Central Science|publisher=Pearson Education |location=Upper Saddle River, New Jersey |isbn=0-13-235848-4 |edition=11th |page=endpapers}}</ref> Vroege technieken voor het scheiden van scandium, yttrium en lutetium waren gebaseerd op het feit dat deze elementen samenhoorden in de zogenaamde "yttrium-groep", terwijl lanthaan en actinium in de "cerium groep" hoorden.<ref name=Jensen1982/> Daarom werd niet lanthaan, maar lutetium ondergebracht in groep 3 door sommige chemici in de jaren 1920 en 1930.<ref group = "n">Het fenomeen van verschillende groepen werd veroorzaakt door stijgende basiciteit met stijgende straal, en is geen fundamentele reden om dat Lu, en niet La, onder Y te plaatsen. Dus, onder de Groep 2 [[aardalkalimetalen]], behoort Mg (minder basisch) in de "oplosbare groep" en Ca, Sr en Ba (meer basisch) komen voor in de "ammoniumcarbonaat groep". Toch worden Mg, Ca, Sr en Ba routinematig in Groep 2 van het periodiek systeem geplaatst. See: Moeller et al. (1989). ''Chemistry with Inorganic Qualitative Analysis'' (3rd ed.). SanDiego: Harcourt Brace Jovanovich, pp. 955–956, 958.</ref> Later spectroscopisch werk vond dat de elektronenconfiguratie van ytterbium eigenlijk [Xe]4f<sup>14</sup>6s<sup>2</sup> was. Dit betekent dat ytterbium en lutetium –de configuratie van de tweede is [Xe]4f<sup>14</sup>5d<sup>1</sup>6s<sup>2</sup>– beide 14 f-elektronen hebben, wat voor een differentiërend d-elektron zorgt, in plaats van een f-elektron voor lutetium, waardoor het een even goede kandidaat is als [Xe]5d<sup>1</sup>6s<sup>2</sup> lutetium voor de groep 3 positie onder yttrium.<ref name=Jensen1982/> Meerdere fysici in de jaren 1950 en 1960 kozen voor lutetium, door de gelijkaardigheid met de fysische eigenschappen van lanthaan.<ref name=Jensen1982/> Deze schikking, waar lanthaan het eerste lid van het f-blok is, wordt tegengewerkt door sommige auteurs omdat lanthaan geen f-elektronen heeft. Op deze zorgen werd geantwoord dat dit niet erg is, gezien andere abnormaliteiten in het systeem – bijvoorbeeld thorium heeft geen f-elektronen, maar is toch deel van het f-blok.<ref>{{cite web |url= http://www.rsc.org/blogs/eic/2015/09/periodic-table-group-3|title= Five ideas in chemical education that must die - part five |last1= Scerri|first1= E|date= 2015|website= educationinchemistryblog|publisher= Royal Society of Chemistry|access-date= Sep 19, 2015 |quote=It is high time that the idea of group 3 consisting of Sc, Y, La and Ac is abandoned}}</ref> Lawrencium, met een elektronenconfiguratie [Rn]5f<sup>14</sup>7s<sup>2</sup>7p<sup>1</sup>, is ook een abnormaliteit, of die nu in het f-blok of het d-blok, omdat de enige mogelijke p-blok positie al is ingenomen door ununtrium, met een voorspelde elektronenconfiguratie [Rn]5f<sup>14</sup>6d<sup>10</sup>7s<sup>2</sup>7p<sup>1</sup>.<ref name=Jensen2015>{{cite web |url=http://www.che.uc.edu/jensen/W.%20B.%20Jensen/Reprints/251.%20Lawrencium.pdf|title= Some Comments on the Position of Lawrencium in the Periodic Table|last1=Jensen |first1=W. B. |date=2015 |access-date=20 Sep 2015 }}</ref> |
|||
De 32-kolom versie van het periodiek systeem, waar lanthanides en actinides binnen het systeem worden geplaatst, is een voorgestelde oplossing op dit probleem.<ref group = "n">Clark vindt dat, "de pedagogische discussie over enige ongefragmenteerde lang-formaat systeem [32-kolom] zal duidelijker gezien worden als een zoektocht naar symmetrie en orde in de natuur dan de verkorte [18-kolom] versies." See: Clark R. W. (2008). "Author of 'The Flyleaf Periodic Table' Responds" ''Journal of Chemical Education'' '''85''' (11): 1493.</ref> Oftewel lutetium en lawrencium of lanthaan en actinium kunnen onder scandium en yttrium geplaatst worden. Scerri<ref name="finally"/><ref>{{cite web |url=http://www.rsc.org/blogs/eic/2015/09/periodic-table-group-3 |title=Five ideas in chemical education that must die - part five |last=Scerri |first=E. |date=15 September 2015|website=educationinchemistryblog |publisher=Royal Society of Chemistry |access-date=27 October 2015}}</ref> verkeist de eerste optie, omdat de tweede optie het d-blok fragmenteert. Aan de andere kant geeft de tweede optie een betere opmaak voor de chemie van Sc, Y, La en Ac die gelijkaardig zijn aan de aardalkalimetalen van groep 2,<ref>{{cite book |last=Steele|first=D.|title=The Chemistry of the Metallic Elements|publisher=Pergamon Press|location=Oxford|pages=59–60}}</ref> en de s-blok metalen in het algemeen,<ref>{{cite book |last1=Phillips |first1=C.S.G. |last2=Williams |first2=R.J.P. |date=1966 |title=Inorganic Chemistry| volume=II Metals|location=Oxford |publisher=Oxford University Press |pages=4, 48, 55}}</ref><ref>{{cite book |last1=Kneen |first1=W.R. |last2=Rogers |first2=M.J.W. |date=1972 |title=Chemistry: Facts, Patterns, and Principles|location=London |publisher=Addison-Wesley| page=501}}</ref> maar weinig gelijkenissen met ware overgangsmetalen<ref>{{cite book |last1=Greenwood|first1=N.N.|last2=Earnshaw|first2=A|title=Chemistry of the Elements|publisher=Elsevier Science Ltd.|location=Oxford|edition=2nd|pages=946|isbn=0-7506-3365-4}}</ref> (hoewel Sc, Y, La en Ac fysisch dichter staan bij overgangsmetalen).<ref>{{cite book |last1=Greenwood|first1=N.N.|last2=Earnshaw|first2=A|title=Chemistry of the Elements|publisher=Elsevier Science Ltd.|location=Oxford|edition=2nd|pages=947–948|isbn=0-7506-3365-4}}</ref><ref group ="n">Mazurs, in zijn survey van 100 jaar periodieke systemen, waaronder 46 vormen met La onder Y, en 43 met Lu onder Y. Zie: Mazurs, E. G. (1974). ''Graphic Representations of the Periodic System during One Hundred Years.'' 2nd ed. Alabama: University of Alabama Press.</ref> |
|||
===Optimale vorm=== |
|||
De vele vormen van het periodieke systeem stellen de vraag of er een optimale vorm is van het systeem. Men denkt dat het antwoord afhankelijk is van of de chemische periodiciteit onder de elementen een onderliggende waarheid bevat, als vast deel van het universum, of het een product is subjectieve interpretatie, gebaseerd op de omstandigheden en voornemens van mensen. Een objectieve basis voor chemische periodiciteit zou de vragen over de plaatsing van waterstof en helium en de compositie van groep 3 oplossen. Als zulke onderliggende waarheid bestaat, is het nog niet ontdekt. Ondertussen kunnen de vele periodieke systemen als variaties gezien worden op chemische periodiciteit, die elk andere aspecten, eigenschappen, perspectieven en relaties tussen de elementen benadrukken.<ref group = "n"> Scerri, een van de voornaamste autoriteiten van de geschiedenis van het periodiek systeem (Sella 2013), prefereerde het concept van een optimale vorm van het periodiek systeem maar is recent veranderd van positie en steunt nu de een aantal verschillende periodieke systemen. Zie: Sella A. (2013). '[http://www.newscientist.com/article/mg21929291.200-an-elementary-history-lesson.html#.Uiear8saySM An elementary history lesson']. ''New Scientist.'' 2929, 13 August: 51, accessed 4 September 2013; and Scerri, E. (2013). '[http://ericscerri23.blogspot.com/ Is there an optimal periodic table and other bigger questions in the philosophy of science']. 9 August, accessed 4 September 2013.</ref> De alomtegenwoordigheid van het standaard periodiek systeem komt mogelijk doordat deze opmaak een goede balans van de constructie en belang van kenmerken heeft, alsook zijn uitbeelding van de atomische volgorde en periodieke trends.<ref name="Scerri 2011" /><ref>{{cite journal |last=Francl |first=M.|title=Table manners |journal=Nature Chemistry |volume=1 |date=May 2009|pages=97–98|url=http://ericscerri.com/Michelle-Nat%20Chem.pdf|bibcode = 2009NatCh...1...97F |doi = 10.1038/nchem.183 |issue=2 |pmid=21378810 }}</ref> |
|||
==Zie ook== |
|||
*[[abundantie (scheikunde)|Scheikundige abundantie]] |
|||
*[[Lijst van elementen]] |
|||
*[[Isotopentabel (in delen)/kb|Isotopentabel]] |
|||
*[[Ezelsbruggetje#Scheikunde|Ezelsbruggetjes voor de eerste twintig elementen]] |
|||
*[[Geschiedenis van het periodiek systeem]] |
|||
==Notities== |
|||
<references group="n"/> |
|||
==Appendix == |
==Appendix == |
||
{{Appendix||2={{References||2}}}} |
|||
{{appendix}} |
|||
== |
==Bibliografie== |
||
* {{cite book |last=Ball |first=P. |title=The Ingredients: A Guided Tour of the Elements |location=Oxford|publisher=Oxford University Press |year=2002 |isbn=0-19-284100-9}} |
|||
* [[Ezelsbruggetje#Scheikunde|Ezelsbruggetjes voor de eerste twintig elementen]] |
|||
* {{cite book|last=Chang|first=R.|title=Chemistry|year=2002|edition=7th|publisher=McGraw-Hill Higher Education|location=New York|isbn=978-0-19-284100-1}} |
|||
* [[Geschiedenis van het periodiek systeem]] |
|||
* {{cite book|last=Gray|first=T.|title=The Elements: A Visual Exploration of Every Known Atom in the Universe|year=2009|publisher=Black Dog & Leventhal Publishers|location=New York|isbn=978-1-57912-814-2}} |
|||
* {{cite book|last1=Greenwood|first1=N. N.| last2=Earnshaw|first2= A.| date= 1984| title=Chemistry of the Elements|place=Oxford|publisher=Pergamon Press|isbn=0-08-022057-6}} |
|||
* {{cite book |last1=Huheey|first1=J. E.|last2=Keiter|first2=EA|last3=Keiter|first3=RL|title=Principles of structure and reactivity|publisher=Harper Collins College Publishers|location=New York|edition=4th|isbn=0-06-042995-X}} |
|||
* {{cite book |last=Moore |first=J. |title=Chemistry For Dummies |year=2003 |publisher=Wiley Publications |location=New York |isbn=978-0-7645-5430-8|page=111}} |
|||
* {{cite book|last=Scerri |first=E.|title=The periodic table: Its story and its significance|publisher=Oxford University Press|location=Oxford|year=2007|isbn=0-19-530573-6}} |
|||
* {{cite book |last=Scerri|first=E.|title=The periodic table: A very short introduction|year=2011|publisher=Oxford University Press|location=Oxford|isbn=978-0-19-958249-5}} |
|||
* {{cite book |last=Venable|first=F. P.|title=The Development of the Periodic Law|year=1896|url=http://books.google.com/books?id=tF0vAQAAMAAJ|publisher=Chemical Publishing Company|location=Easton, Pennsylvania}} |
|||
== Externe links == |
== Externe links == |
||
{{Zusterproject klein |
|||
| wiktionary = periodic table |
|||
| commons = Periodic Table of Elements |
|||
| wikibooks = Periodiek systeem |
|||
}} |
|||
* [http://www.systeemderelementen.nl/ Overzichtelijk Periodiek Systeem der Elementen] |
* [http://www.systeemderelementen.nl/ Overzichtelijk Periodiek Systeem der Elementen] |
||
* [http://www.periodicvideos.com/ Periodic Table of Videos - een video over elk element] |
* [http://www.periodicvideos.com/ Periodic Table of Videos - een video over elk element] |
||
* {{cite web |url=http://www.ptable.com |title=Dynamic Periodic Table |author=M. Dayah|accessdate=14 mei 2012}} |
|||
* {{cite web |url=http://www.periodicvideos.com |title=The Periodic Table of Videos |author=Brady Haran |publisher=University of Nottingham |accessdate=14 mei 2012}} |
|||
* {{cite web |url=http://www.webelements.com |title=WebElements: the periodic table on the web |author=Mark Winter |publisher=University of Sheffield |accessdate=14 mei 2012}} |
|||
* {{cite web |url=http://www.meta-synthesis.com/webbook//35_pt/pt_database.php |title=The INTERNET Database of Periodic Tables |author=Mark R. Leach |accessdate=14 mei 2012}} |
|||
{{wikibooks|Periodiek systeem}} |
|||
{{Navigatie elementen}} |
{{Navigatie elementen}} |
||
{{Commonscat|Periodic table}} |
|||
[[Categorie:Natuurkunde]] |
[[Categorie:Natuurkunde]] |
||
Versie van 12 jan 2016 19:47

Het Periodiek systeem is een tabellarische schikking van de chemische elementen, geordend op hun atoomnummer (aantal protonen in de atoomkern), elektronenconfiguratie en terugkerende stofeigenschappen. De tabel bevat ook vier rechthoekige blokken: s-, p-, d- en f-blokken. Over het algemeen zijn binnen één rij (periode) de linkse elementen metalen en de rechtse elementen niet-metalen.
De rijen van de tabel worden periodes genoemd; de kolommen worden groepen. Zes groepen (kolommen) hebben namen en nummers: bijvoorbeeld, de elementen uit groep 17 zijn de halogenen en groep 18 zijn de edelgassen. Het periodiek systeem kan gebruikt worden om connecties te vinden tussen de eigenschappen van elementen, en de eigenschappen te ontdekken van nieuwe of nog onbekende elementen. Het periodiek systeem is een nuttig raamwerk om chemisch gedrag mee te analyseren, en wordt uitgebreid gebruikt in de chemie en andere wetenschappen.
Hoewel er voorgangers bestaan, werd de eerste herkenbare tabel gepubliceerd door Dmitri Mendelejev in 1869. Hij ontwikkelde zijn tabel om periodieke tendensen aan te tonen in de toen gekende elementen. Mendelejev voorspelde ook enkele eigenschappen van toen onbekende elementen, waarvan hij verwachte dat die de gaten in de tabel zouden vullen. Toen die elementen werden ontdekt bleken zijn voorspellingen grotendeels correct te zijn geweest. Mendelejev's periodiek systeem is sindsdien uitgebreid en verfijnd door het ontdekken of synthetiseren van meer nieuwe elementen en het ontwikkelen van nieuwe theoretische modellen om het chemisch gedrag te verklaren.
Alle elementen van atoomnummer 1 (waterstof) tot 118 (ununoctium) werden ontdekt of gesynthetiseerd, en elementen 113, 115, 117 en 118 werden op 30 december 2015 door de IUPAC bevestigd.[2] De eerste 94 elementen verschijnen in de natuur, hoewel sommigen zeer weinig voorkomen en eerst in een laboratorium gesynthetiseerd werden voor ze in de natuur ontdekt werden.[n 1] Elementen met atoomnummer 95 tot 118 zijn enkel gesynthetiseerd in laboratoria. Er werd aangetoond dat elementen 95 tot 100 ooit in de natuur voorkwamen, maar nu niet meer.[3] Men is momenteel bezig met het synthetiseren van elementen met hogere atoomnummers. Men heeft ook meerdere synthetische radionuclides van elementen die in de natuur verschijnen in een lab kunnen produceren.
Overzicht
| 1 Ia |
18 0 | ||||||||||||||||||
| 1 | 1 H |
2 IIa |
13 IIIa |
14 IVa |
15 Va |
16 VIa |
17 VIIa |
2 He | |||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||
| 3 | 11 Na |
12 Mg |
3 IIIb |
4 IVb |
5 Vb |
6 VIb |
7 VIIb |
8 VIIIb |
9 VIIIb |
10 VIIIb |
11 Ib |
12 IIb |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
(43) Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 Fr |
88 Ra |
** |
(104) Rf |
(105) Db |
(106) Sg |
(107) Bh |
(108) Hs |
(109) Mt |
(110) Ds |
(111) Rg |
(112) Cn |
(113) Uut |
(114) Fl |
(115) Uup |
(116) Lv |
(117) Uus |
(118) Uuo |
|
| *Lanthaniden | 57 La |
58 Ce |
59 Pr |
60 Nd |
(61) Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | ||||
| **Actiniden | 89 Ac |
90 Th |
91 Pa |
92 U |
(93) Np |
(94) Pu |
(95) Am |
(96) Cm |
(97) Bk |
(98) Cf |
(99) Es |
(100) Fm |
(101) Md |
(102) No |
(103) Lr | ||||
| Alkalimetalen | Aardalkalimetalen | Overgangsmetalen | Hoofdgroepmetalen | Metalloïden |
| Niet-metalen | Halogenen | Edelgassen | Lanthaniden | Actiniden |
Elk chemisch element heeft een uniek atoomnummer, wat het aantal protonen in de atoomkern voorstelt.[n 2] De meeste elementen hebben verschillende aantallen neutronen tussen verschillende atomen, en deze varianten worden isotopen genoemd. Bijvoorbeeld, koolstof heeft drie isotopen die in de natuur voorkomen: alle koolstofatomen hebben zes protonen en de meeste hebben ook zes neutronen, maar ongeveer 1% heeft zeven neutronen en een zeer kleine fractie heeft er acht. In het periodiek systeem worden isotopen niet onderscheidden, maar worden samen gegroepeerd als één element. Elementen zonder stabiele isotopen krijgen de atoommassa van hun stabielste isotoop, waar zulke massa's vermeld worden, tussen haakjes.[4]
In een standaard periodiek systeem worden de elementen naar stijgend atoomnummer (aantal protonen in de atoomkern) geordend. Een nieuwe rij (periode) begint wanneer een nieuwe elektronenschil zijn eerste elektron krijgt. Kolommen (groepen) worden vastgesteld door de elektronenconfiguratie van de atoom; elementen met eenzelfde aantal elektronen in een bepaalde schil vallen onder dezelfde kolom (bv. zuurstof en seleen zitten in dezelfde kolom omdat ze beide vier elektronen hebben in de buitenste p-schil). Elementen met gelijkaardige chemische eigenschappen vallen in het algemeen in dezelfde groep in het periodiek systeem, hoewel in het f-blok, en in sommige gevallen in het d-blok, de elementen in dezelfde periode ook gelijkaardige eigenschappen hebben. Het is dus relatief makkelijk om de chemische eigenschappen van een element te voorspellen als men de eigenschappen van de aangrenzende elementen kent.[5]
In 2016 heeft het periodiek systeem 118 bevestigde elementen. Elementen 113, 115, 117 en 118 werden officieel bevestigd door de IUPAC in december 2015, hoewel hun officiële namen nog onbeslist zijn.[6] Daarom worden ze momenteel geïdentificeerd volgens hun atoomnummer (bv. "Element 113"), of volgens hun voorlopige systematische elementnaam ("Ununtrium", symbool "Uut").[7]
94 elementen verschijnen in de natuur; de andere 20 elementen, van americium tot copernicium en flerovium tot livermorium, kunnen enkel in een laboratorium gesynthetiseerd worden. Uit de natuurlijke 94 elementen, zijn er 84 oerelementen, wat betekent dat ze sinds het begin op aarde voorkwamen. De andere 10 natuurlijke elementen ontstaan enkel tijdens het vervallen van de oerelementen.[3] Het zwaarste geobserveerde element in macroscopische hoeveelheden in pure vorm is einsteinium (element 99). Astaat (element 85) is nog nooit geobserveerd geweest; francium kon enkel gefotografeerd worden in de vorm van het licht dat microscopische hoeveelheden (300 000 atomen) uitstralen.[8]
Groeperingen
Groepen
Een groep of familie is een verticale kolom in het periodiek systeem. Groepen hebben meestal belangrijkere periodieke tendensen dan periodes en blokken, die later uitgelegd worden. Moderne kwantummechanische theorieën van atoomstructuur leggen groep tendensen uit door het feit dat elementen binnen dezelfde groep algemeen dezelfde elektronenconfiguratie in hun buitenste elektronenschil hebben.[9] Hierdoor hebben elementen in eenzelfde groep gelijkaardige eigenschappen en is er een duidelijke tendens bij stijgende atoomnummers.[10] Maar in sommige delen van de tabel, voornamelijk het d-blok en f-blok, kunnen de horizontale gelijkheden even belangrijk zijn als verticale gelijkheden.[11][12][13]
Volgens een internationale naamconventie, worden de groepen genummerd van 1 tot 18 van de linkse kolom (alkalimetalen) tot de rechtse kolom (edelgassen).[14] Vroeger werden ze genummerd met Romeinse cijfers. In Amerika werden deze cijfers gevolgd door een "A" als de groep deel was van het s- of p-blok, of een "B" als de groep deel uitmaakte van het d-blok. De Romeinse cijfers kwamen overeen met het laatste cijfer van de moderne naamconventie (bv. groep 4 was IVB en groep 14 was groep IVA). In Europa was de nummering gelijksoortig, behalve dat de "A" gebruikt werd voor groepen 1-9 en "B" voor groepen 10 en hoger. Groepen 8, 9 en 10 werden ook beschouwd als één groep met driemaal de breedte, die in beide notaties als groep VIII bekend was. In 1988 kwam het nieuwe IUPAC naamsysteem in gebruik, en de oude groepen werden afgeschaft.[15]
Sommige groepen kregen een triviale reeksnaam, zoals in de onderstaande tabel te zien, hoewel sommige zelden worden gebruikt. Groepen 3-16 hebben in het Nederlands geen triviale naam (3-10 in het Engels) en worden naar verwezen met hun groepsnummer of de naam van het eerste element in de groep (zoals Scandium groep), omdat ze minder gelijkheden en/of verticale trends hebben.[14]
Elementen in dezelfde groep neigen tot het vertonen van patronen in atoomstraal, ionisatiepotentiaal en elektronegativiteit. Van top tot bodem per groep zal de atoomstraal van de elementen stijgen, aangezien er meer elektronen zijn en de valentie-elektronen verder van de kern te vinden zullen zijn. Van bovenaf heeft elk opeenvolgend element een lager ionisatiepotentiaal, omdat het makkelijker is een elektron te verwijderen omdat de atomen minder sterk verbonden zijn. Groepen zullen ook van boven naar beneden een lagere elektronegativiteit hebben door de grotere afstand tussen valentie-elektronen en de kern.[16] Er zijn echter uitzonderingen, zoals in groep 11 waar de elektronegativiteit stijgt naarmate je de groep afdaalt.[17]
| Groepsnummer | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CAS (Amerika, patroon A-B-A) |
IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||||
| oud IUPAC (Europa, patroon A-B) |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | Group 0 | ||||
| Triviale naam | Alkalimetalen | Aardalkalimetalen | Halogenen | Edelgassen | ||||||||||||||||
| Naam volgens element | Lithium groep | Beryllium groep | Scandium groep | Titanium groep | Vanadium groep | Chroom groep | Mangaan groep | ijzer groep | Kobalt groep | Nikkel groep | Koper groep | Zink groep | Boor groep | koolstof groep | Stikstof groep | Zuurstof groep | Fluor groep | Helium of Neon groep | ||
| Periode 1 | H | He | ||||||||||||||||||
| Periode 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||
| Periode 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
| Periode 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| Periode 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| Periode 6 | Cs | Ba | La–Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Periode 7 | Fr | Ra | Ac–No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| Waterstof (H), hoewel het geplaatst wordt in kolom 1, wordt het niet beschouwd deel te zijn van de groep alkalimetalen. | ||||||||||||||||||||
| Groep 3: afhankelijk van de bron kunnen Lutetium (Lu) and Lawrencium (Lr) inbegrepen worden; het f-blok (met 14 lanthanides and 14 actinides) kan ook inbegrepen worden. | ||||||||||||||||||||
Periode
Een periode is een horizontale rij in het periodiek systeem. Hoewel de groepen algemeen de duidelijkste periodieke trends vertonen, zijn er enkele regio's waar horizontale trends duidelijker zijn dan de verticale, zoals in het f-blok, waar de lanthanides en actinides twee aanzienlijke horizontale series vormen.[21]
Elementen in dezelfde periode vertonen trends in atoomstraal, ionisatiepotentiaal, elektronenaffiniteit en elektronegativiteit. Van links naar rechts in een periode zal de atoomstraal algemeen dalen. Dit komt doordat elk opeenvolgend element een extra proton en elektron heeft, en de elektron dichter naar de kern word getrokken.[22] Deze daling in atoomstraal zorgt ervoor dat van links naar rechts in een periode het ionisatiepotentiaal ook zal stijgen. Hoe strakker een atoom gebonden is, hoe meer energie er nodig is om een elektron te verwijderen. Elektronegativiteit stijgt op dezelfde manier als ionisatiepotentiaal door de trekkracht van de kern op de elektronen.[16] Elektronenaffiniteit toont ook een lichte trend in periodes. Metalen (aan de linkerkant) hebben in het algemeen een lagere elektronenaffiniteit dan niet-metalen (aan de rechterkant), met de uitzondering van edelgassen.[23]
Blokken

Specifieke regio's van het periodiek systeem kunnen naar verwezen worden als blokken, door de reeks waarin de elektronenschillen van de elementen gevuld worden. Elk blok wordt genoemd naar de schil waarin de "laatste" elektron zich bevindt.[24][n 3] Het s-blok omvat de eerste twee groepen (alkalimetalen en aardalkalimetalen), alsook waterstof en helium. Het p-blok omvat de laatste zes groepen, 13 tot 18 in IUPAC (3A tot 8A in Amerika) en bevat onder andere alle metalloïden. Het d-blok omvat groepen 3 tot 12 (of 3B tot 2B in Amerikaans) en bevat alle overgangsmetalen. Het f-blok, vaak onder de rest van de tabel, heeft geen groepsnummers en omvat de lanthanides en actinides.[25] vormen met elkaar
Metalen, metalloïden en niet-metalen

Bronnen zijn het oneens over de classificatie van sommige elementen.
Volgens hun gedeelde fysieke en chemische eigenschappen kunnen de elementen geclassificeerd worden in de grote categorieën metalen, metalloïden en niet-metalen. Metalen zijn in het algemeen glanzende, zeer geleidende vaste lichamen, die allooien vormen met elkaar en zoutachtige ionische verbindingen vormen met niet-metalen (behalve edelgassen). De meeste niet-metalen zijn gekleurde of kleurloze isolerende gassen; niet-metalen die verbindingen vormen met andere niet-metalen hebben een covalente binding. Tussen de metalen en niet-metalen liggen de metalloïden die tussenliggende eigenschappen bevatten.[26]
Metalen en niet-metalen kunnen verder geordend worden in subcategorieën die een gradatie van metallische naar niet-metallische eigenschappen tonen, van links naar rechts in de rijen. De metalen zijn onderverdeeld in de zeer reactieve alkalimetalen, de minder reactieve aardalkalimetalen, de lanthanides en actinides, via de overgangsmetalen, eindigend met de fysiek- en chemisch zwakke hoofdmetalen. De niet-metalen worden onderverdeeld in de polyatomische niet-metalen, die zich het dichtst bij de metalen bevinden en dus enkele licht metallische eigenschappen hebben; de diatomische niet-metalen, die in wezen niet-metallisch zijn; en de monatomische edelgassen, die niet-metallisch en bijna compleet inert zijn. Gespecialiseerde groeperingen, zoals de dwarsmetalen en edelmetalen, die subcategorieën zijn van de doorgangsmetalen, zijn ook mogelijk en worden soms zo aangegeven.[27][28]
De elementen in categorieën en subcategorieën verdelen volgens gedeelde eigenschappen is onvolmaakt. Er is een spectrum van eigenschappen binnen elke categorie, en men kan makkelijk overlappingen vinden, zoals het geval is bij de meeste classificatieschema's.[29] Bijvoorbeeld beryllium wordt geclassificeerd als een aardalkalimetaal, hoewel zijn amfotere chemie en neiging om meestal covalente verbindingen te maken zijn eigenschappen van een chemisch zwak hoofdmetaal. Radon wordt geclassificeerd als niet-metaal en edelgas, hoewel het kationische chemie heeft wat beter past bij metalen. Er zijn andere classificatieschema's mogelijk, zoals het verdelen van de elementen volgens affiniteit met een bepaalde chemische fase of volgens kristalstructuur. De elementen op deze manier categoriseren dateert van 1869 toen Hinrichs[30] schreef dat simpele grenzen konden getekend worden op een periodiek systeem om elementen met gelijkaardige eigenschappen te groeperen, zoals metalen en niet-metalen, of de gaselementen.
Periodieke Trends
Elektronenconfiguratie

De elektronen configuratie, of de organisatie van de elektronen die draaien om neutrale atomen, toont een weerkerend patroon or periodiciteit. De elektronen bezetten een serie elektronenschillen (schil 1, schil 2, enz). Elke schil bevat een of meer subschillen (genaamd s, p, d, f, en g). Zoals het atoomnummer stijgt, zullen elektronen geleidelijk deze schillen en subschillen vullen ongeveer volgens de Madelung regel, zoals te zien in het diagram. De elektronenconfiguratie van neon bijvoorbeeld is 1s2 2s2 2p6. Met atoomnummer 10 heeft neon 2 elektronen in de eerste schil en 8 elektronen in de tweede schil – 2 in de s-subschil en 6 in de p-subschil. In De taal van het periodiek systeem, de eerste keer dat een elektron een nieuwe schil bezet is de start van een nieuwe periode.[31][32]

Aangezien de eigenschappen van een element grotendeels bepaalt worden door de elektronenconfiguratie, tonen die eigenschappen weerkerende patronen en periodiek gedrag, met enkele voorbeelden in de onderstaande tabel. Deze periodiciteit, die al lang opgemerkt werden voor de onderliggende theorie werd ontwikkeld, leidde tot de periodieke wet (de eigenschappen van de elementen herhalen zich in intervallen) en het formuleren van de eerste periodieke systemen.[31][32]
Atoomstraal
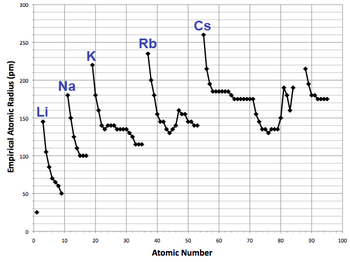
Atoomstraal varieert in een voorspelbare en verklaarbare manier over het hele periodiek systeem. Bijvoorbeeld, de straal daalt in het algemeen met elke periode van de tabel, van alkalimetalen tot edelgassen; en ze stijgen met elke groep. De straal stijgt stijl tussen elk edelgas aan het einde van de periode en het opvolgende alkalimetaal aan het begin van de volgende periode. Deze trends kunnen verklaart worden door de elektronenschil theorie van de atoom; ze waren belangrijk bewijs voor het ontwikkelen en bevestigen van de kwantum theorie.[33]
De elektronen in de 4f-subschil, wat gevuld wordt van cerium (element 58) tot Ytterbium (element 70) zijn niet erg effectief in het beschermen van de stijgende nucleaire lading voor de volgende subschillen. De elementen die direct volgen op de lanthanides hebben kleinere atoomstralen dan verwacht en die bijna identiek zijn aan de atoomstralen van de bovenliggende elementen.[34] Zo heeft hafnium virtueel dezelfde atoomstraal (en chemie) als zirkonium, en tantaal heeft een gelijkaardige atoomstraal als niobium, enzovoort. Dit wordt de lanthanide samentrekking genoemd. Het effect van de lanthanide samentrekking is merkbaar tot aan platina (element 78), waarna het vermomd wordt door het relativistisch effect, het inerte paren effect genaamd.[35] De d-blok samentrekking, een gelijkaardig effect tussen het d-blok en p-blok, is minder opvallend dan de lanthanide samentrekking, maar ontstaat voor een vergelijkbare reden.[34]
Ionisatiepotentiaal

Het eerste ionisatiepotentiaal is de energie die nodig is om één elektron uit een atoom te verwijderen, het tweede ionisatiepotentiaal is de energie die nodig is om een tweede elektron uit de atoom te verwijderen, enzovoort. Bij een gegeven atoom zullen opeenvolgende ionisatiepotentialen stijgen volgens een ionisatiegraad. Magnesium bijvoorbeeld heeft als eerste ionisatiepotentiaal 738 kJ/mol en als tweede 1450 kJ/mol. Elektronen in de dichtere orbitalen ondergaan sterkere elektrostatische aantrekking, waardoor hun verwijdering steeds meer energie vereist. Het ionisatiepotentiaal stijgt richting boven en rechts in het periodiek systeem.[35]
Grote sprongen in opeenvolgende ionisatiepotentialen vinden plaats na het verwijderen van een elektron uit een edelgas configuratie. De twee eerste ionisatiepotentialen van magnesium, zoals eerder vermeld, komen overeen met het verwijderen van de twee 3s elektronen, en het derde ionisatiepotentiaal is 7730 kJ/mol voor de verwijdering van een 2p elektron uit de zeer stabiele, neon-achtige configuratie van Mg2+. Gelijkaardige sprongen komen voor in het ionisatiepotentiaal voor andere derde-rij atomen.[35]
Elektronegativiteit

Elektronegativiteit is de neiging van een atoom om elektronen aan te trekken.[36] De elektronegativiteit van atomen wordt beïnvloed door het atoomnummer en de afstand tussen de valentie-elektronen en de kern. Hoe hoger de elektronegativiteit, hoe meer een element elektronen aantrekt. Het werd eerst voorgesteld Linus Pauling in 1932.[37] In het algemeen stijgt de elektronegativiteit van links naar rechts in een periode en dalen van boven naar onder in een groep. Zo is fluor het meest elektronegatieve element,[n 5] terwijl cesium het minst elektronegatief is, tenminste onder de elementen waarover genoeg informatie beschikbaar is.[17]
Er zijn uitzonderingen op deze algemene regel. Gallium en germanium hebben een hogere elektronegativiteit dan respectievelijk aluminium en silicium, door d-blok samentrekking. Elementen in de vierde periode meteen na de eerste rij van de overgangsmetalen, hebben bijzonder kleine atoomstralen omdat de 3d-elektronen de stijgende nucleaire lading niet goed kunnen afschermen, en kleinere atoomgrootte hangt samen met hogere elektronegativiteit.[17] De abnormaal hoge elektronegativiteit van lood, vooral wanneer vergeleken met thallium en bismut, lijkt een artefact van data selectie (en data beschikbaarheid) – berekeningsmethodes anders dan de Pauling methode tonen een normale periodieke trend voor deze elementen.[38]
Elektronenaffiniteit

De elektronenaffiniteit van een atoom is de hoeveelheid energie die vrijkomt wanneer een elektron aan een neutraal atoom wordt toegevoegd om een negatief ion te vormen. Hoewel elektronenaffiniteit veel varieert, zijn er toch zichtbare trends. In het algemeen hebben niet-metalen meer positieve elektronenaffiniteit dan metalen. Chloor trekt het sterkst een extra elektron aan. De elektronenaffiniteit van de edelgassen zijn nog niet beslissend gemeten, dus hebben ze misschien licht negatieve waarden.[41]
In het algemeen zal elektronenaffiniteit toenemen van links naar rechts in een periode. Dit komt door het vullen van de valentie-schil (buitenste schil) van de atoom; een atoom uit groep 17 geeft meer energie vrij dan een atoom uit groep 1 wanneer het een extra elektron krijgt, omdat het zo de valentie-schil vult en het resultaat stabieler is.[41]
Men zou een trend van dalende elektronenaffiniteit van boven naar onder in een groep verwachten. De extra elektron zal een orbitaal bezetten die verder weg is van de kern. Daarom zou de elektron minder aangetrokken worden door de kern en zou minder energie vrijkomen wanneer die wordt toegevoegd. Daarentegen is één derde van de elementen bij het dalen langs een groep abnormaal, en zwaardere elementen hebben een hogere elektronenaffiniteit dan hun lichtere buren. Dit komt grotendeels door de zwakkere afscherming van d- en f-elektronen. Een gelijke daling in elektronenaffiniteit geldt enkel voor de elementen in groep 1.[42]
Metaalkarakter
Hoe lager de waarden van het ionisatiepotentiaal, de elektronegativiteit en de elektronenaffiniteit zijn, hoe metallischer het karakter van een element is. Aan de andere kant zal het niet-metallisch karakter stijgen bij hogere waarden.[43] Gezien de trends van deze drie eigenschappen, zal het metallisch karakter dalen langs een periode, en met enkele uitzonderingen door de zwakke afscherming van de kern door d- en f-elektronen en relativistische effecten,[44] stijgt het ook bij het afdalen langs een groep. Dus zijn de meest metallische elementen (zoals cesium of francium) te vinden in de links onderste hoek van traditionele periodieke systemen, en de meest niet-metallische elementen (zuurstof, fluor, chloor) in de rechts bovenste hoek. De combinatie van horizontale en verticale trends in metaalkarakter verklaren de trapvormige grenslijn tussen metalen en niet-metalen die te vinden is op sommige periodieke systemen, alsook de gewoonte om soms meerdere elementen dichtbij die lijn te categoriseren als metalloïden.[45][46]
Geschiedenis
Eerste pogingen tot systematisering

In 1789 publiceerde Antoine Lavoisier een lijst met 33 chemische elementen, gegroepeerd als gassen, metalen, niet-metalen en aarden.[47] Chemici zochten de volgende eeuw lang naar een preciezere classificatie. In 1829 observeerde Johann Döbereiner dat veel elementen in trio's konden gegroepeerd worden, gebaseerd op hun chemische eigenschappen. Bijvoorbeeld, lithium, natrium en kalium kunnen in een trio gegroepeerd worden als zachte, reactieve elementen. Döberreiner merkte ook op dat wanneer ze gerangschikt werden op atoomgewicht, het tweede lid van elk trio ongeveer het gemiddelde was van het eerste en derde;[48] dit stond bekent als de Wet van Trio's.[49] De Duitse chemicus Leopold Gmelin werkte met dit systeem, en tegen 1843 had hij tien trio's, drie groepen van vier en een groep van vijf geïdentificeerd. Jean-Baptiste Dumas publiceerde zijn werk in 1857 wat de relaties tussen verschillende groepen metalen beschrijft. Hoewel meerdere chemici relaties konden ontdekken tussen kleine groepen elementen, was er nog geen systeem wat ze allemaal kon bevatten.[48]
In 1857 observeerde de Duitse chemicus Friedrich Kekulé dat koolstof vaak met vier andere atomen verbonden is. Methaan bijvoorbeeld bestaat uit één koolstofatoom en vier waterstofatomen. Dit concept werd bekent als valentie; verschillende elementen binden verschillende aantallen atomen.[50]
In 1862 publiceerde de Franse geoloog Alexandre-Émile Béguyer de Chancourtois een vroege vorm van het periodiek systeem, wat hij de aardse helix, of schroef noemde. Hij was de eerste die de periodiciteit van de elementen opmerkte. Hij rangschikte de elementen in een spiraal op een cilinder volgens atoomgewicht, en toonde zo dat elementen met gelijkaardige eigenschappen met regelmatige tussenpozen lijken te verschijnen. Dit systeem bevatte enkele ionen en verbindingen samen met de elementen. Zijn werk gebruikte ook geologische termen in plaats van chemische, en bevatte geen schema; hierdoor kreeg het weinig aandacht tot het werk van Dmitri Mendelejev.[51]
In 1864 publiceerde de Duitse chemicus Julius Lothar Meyer een tabel met 44 elementen, gerangschikt volgens valentie. De tabel toonde aan dat elementen met gelijkaardige eigenschappen vaak dezelfde valentie hebben.[52] Tegelijkertijd publiceerde de Engelse chemicus William Odling een rangschikking van 57 elementen, geordend op atoomgewicht. Hoewel er onregelmatigheden en gebreken in zaten, merkte hij een periodiciteit op in het atoomgewicht van de elementen, en dat deze overeenkomstig waren met "hun normaal verkregen groeperingen."[53] Odling speelde met het idee van een periodieke wet, maar volgde dit niet op.[54] Hij stelde achteraf (in 1870) een valentie-gebaseerde classificatie voor.[55]

De Engelse chemicus John Newlands schreef een reeks werkstukken van 1863 tot 1866, en merkte op dat wanneer de elementen op stijgend atoomgewicht worden geordend, gelijkaardige fysieke en chemische eigenschappen zich voordoen met intervallen van acht; hij vergeleek die periodiciteit met die van muzikale octaven.[56][57] Deze zogenoemde Wet van Octaven werd echter bespot door Newlands' tijdgenoten, en de Chemical Society weigerde zijn werk te publiceren.[58] Newlands kon toch een tabel van de elementen maken, en gebruikte het om het bestaan van onbekende elementen te voorspellen, zoals germanium.[59] De Chemical Society erkende het belang van zijn ontdekkingen pas vijf jaar nadat ze het aan Mendelejev toeschreven.[60]
In 1867 publiceerde de Deens-Amerikaanse chemicus Gustavus Hinrichs een spiraal periodiek systeem, gebaseerd op atoomgewichten en spectra, en chemische gelijkaardigheden. Het werk werd gezien als idiosyncratisch, opzichtig en ondoorgrondelijk waardoor het minder herkenbaar en minder geaccepteerd werd.[61][62]
Mendelejev's Tabel


De Russische chemieprofessor Dmitri Mendelejev en de Duitse chemicus Julius Lothar Meyer publiceerden beide (onafhankelijk) hun periodieke systemen, in 1869 en 1870 respectievelijk.[63] Mendelejev's systeem was zijn eerste gepubliceerde versie; dat van Meyer was een uitbreiding op zijn vorige systeem uit 1864.[64] Zij maakten beide hun systemen door het opsommen van elementen in rijen en kolommen volgens atoomgewicht, met een nieuwe rij of kolom wanneer de eigenschappen zich begonnen te herhalen.[65]
De erkenning en aanvaarding van Mendelejev's systeem kwam van twee beslissingen die hij maakte. De eerste was om leegtes in het systeem te houden, als het leek dat het element nog niet ontdekt was.[66] Mendelejev was niet de eerste chemicus die dit deed, maar hij was de eerste waarvan aanvaardt wordt dat hij ze gebruikte om de eigenschappen van nog onbekende elementen, zoals gallium en germanium.[67] De tweede beslissing was om soms de voorgestelde rangschikking van atoomgewicht te negeren en aangrenzende elementen te wisselen, zoals telluur en jodium, om ze zo beter te kunnen groeperen in chemische families. Later in 1913 stelde Henry Moseley de experimentele waarden van kernlading of atoomnummer van elk element vast, en toonde aan dat Mendelejev's ordening overeenkomt met toenemende atoomnummers.[68]
Het belang van atoomnummers voor de organisatie van het periodiek systeem werd niet volledig erkend men beter het bestaan en de eigenschappen van protonen en neutronen begreep. Mendelejev's periodiek systeem gebruikte atoomgewicht om de elementen te organiseren, omdat die informatie vrij precies bepaald kon worden in die tijd. Atoomgewicht werkte in de meeste gevallen goed genoeg om een voorstelling te maken dat de eigenschappen van onbekende elementen preciezer kon voorspellen dan vorige methoden. De vervanging van atoomnummers, zodra ze begrepen werden, gaf een definitieve, geheel getal-gebaseerde reeks van de elementen, en Moseley voorspelde dat de enige onbekende elementen (in 1913) tussen aluminium (Z=13) en goud (Z=79) (in 1913) waren Z=43, 61, 72 en 75, die allemaal later werden ontdekt. De reeks atoomnummers wordt vandaag nog gebruikt, met nieuwe synthetische elementen die geproduceerd en bestudeerd worden.[69]
Tweede versie en verdere ontwikkeling


In 1871 publiceerde Mendelejev zijn periodiek systeem in een nieuwe vorm, met groepen gelijkaardige elementen gesorteerd in kolommen in plaats van rijen. Die kolommen, genummerd I tot VIII komen overeen met de oxidatietoestand van het element. Hij maakte ook gedetailleerde voorspellingen over de eigenschappen van nog onbekende elementen, maar die moeten bestaan.[70] Deze gaten werden gevuld toen chemici meer natuurlijke elementen ontdekten.[71] Er wordt vaak beweerd dat het laatst ontdekte natuurlijk element francium was (wat Mendelejev eka-caesium noemde) in 1939.[72] Plutonium werd synthetisch geproduceerd in 1940, maar werd in zeer kleine hoeveelheden in de natuur gevonden in 1971.[73]
De populaire[74] opmaak van het periodiek systeem, ook de standaardvorm genoemd, wordt toegeschreven aan Horace Groves Deming. Deming, een Amerikaanse chemicus, publiceerde in 1923 een korte (Mendelejev stijl) en een medium (18 kolommen) vorm van het periodiek systeem.[75][n 6] In 1928 Merck and Company bereidden een pamfletvorm van Deming's 18-kolom tabel, wat wijd verspreid werd in Amerikaanse scholen. Tegen de jaren 1930 verscheen Deming's tabel in handboeken en chemische encyclopedias. Het werd ook lang verspreid door Sargent-Welch Scientific Company.[76][77][78]
Met de ontwikkeling van moderne kwantummechanische theorieën van elektron configuraties in atomen, werd het duidelijk dat elke periode in de tabel overeenkwam met het vullen van een elektronenschil. Grotere atomen hebben meer elektronensubschillen, dus hadden latere tabellen steeds meer periodes nodig.[79]

In 1945 stelde de Amerikaanse wetenschapper Glenn Seaborg voor dat de actinides, alsook de lanthanides, een f-subschil vulden. Vroeger dacht men dat de actinides een vierde rij waren van het d-blok. Seaborg's collega's stelden voor om zo'n radicaal voorstel niet te publiceren, omdat het waarschijnlijk zijn carrière zou ruïneren. Seaborg vond destijds dat hij geen carrière had om te ruïneren, dus publiceerde hij het toch. Zijn voorstel bleek correct en hij won de Nobelprijs voor de chemie in 1951 voor zijn werk rond het synthetiseren van actinide elementen.[80][81][n 7]
Hoewel kleine hoeveelheden van sommige transurane elementen te vinden zijn in de natuur,[3] werden ze eerst ontdekt in een lab. Hun productie heeft het periodiek systeem sterk uitgebreid, beginnend met neptunium, gesynthetiseerd in 1939.[82] Omdat veel transurane elementen zeer onstabiel zijn en snel bederven, zijn ze moeilijk op te sporen wanneer ze geproduceerd worden. Er zijn controverses geweest over concurrerende opeisingen voor ontdekkingen van nieuwe elementen, waardoor onafhankelijk onderzoek nodig was om te beslissen wie voorrang en dus naamrechten had. De recentst geaccepteerde en benoemde elementen zijn flerovium (element 114) en livermorium (element 116), beide benoemd op 31 mei 2012.[83] In 2010 beweerde een Russisch-Amerikaanse samenwerking in Doebna, Oblast Moskou, Rusland dat ze zes atomen hadden gesynthetiseerd van ununseptium (element 117), wat het de recentste beweerde ontdekking maakt.[84]
Op 30 december 2015 werden elementen 113, 115, 117 en 118 formeel erkend door de IUPAC, wat de zevende rij van het periodiek systeem voltooid.[85] Officiële namen en symbolen voor elk van deze elementen, die de tijdelijke namen zullen vervangen zoals ununpentium (Uup) voor element 115, worden verwacht voor 2016.
Andere periodieke systemen
Gebruikelijke varianten
 Type I—La, Ac onder Y |
Er zijn drie gebruikelijke varianten op de gewone of 18-kolom vorm van het periodiek systeem. Ze verschillen in hun voorstelling van groep 3.[86] In dit artikel zullen we naar de drie varianten verwijzen als type I, type II en type III.
Type I: Sc, Y La en Ac. Lanthaan en actinium zitten in de hoofdtabel, in groep 3, onder scandium en yttrium. De volgende 14 lanthanides en actinides staan beneden, om ruimte te sparen. Er zijn twee rijen van 14 elementen, de eerste begint met cerium en eindigt met lutetium, de lagere begint met thorium en eindigt met lawrencium. Deze variant komt het meest voor.[87][n 8] Het benadrukt gelijkaardigheden in periodieke trends in groepen 1, 2 en 3, met het nadeel van discontinuïteiten in de periodieke trends tussen groepen 3 en 4 en het fragmenteren van de lanthanides en actinides.[n 9]
 Type II—Lu, Lr onder Y |
Type II: Sc, Y, Lu en Lr. Lutetium en lawrencium zitten in de hoofdtabel, in groep 3, onder scandium en yttrium. De rijen van de voorafgaande 14 lanthanides en actinides beginnen met lanthaan en actinium en eindigen ytterbium en nobelium. Deze variant behoudt een f-blok met 14 kolommen terwijl de lanthanides en actinides gefragmenteerd worden. Het benadrukt de gelijkaardigheden in periodieke trends tussen groep 3 en de volgende groepen, met het nadeel van discontinuïteiten in de periodieke trends tussen groepen 2 en 3.[n 10]
 Type III—Markers onder Y |
Type III: Sc, Y en markers. De twee posities onder scandium zijn onbezet of verwijzen op de een of andere manier naar de onderste buitenrijen. De onderstaande lanthanides en actinides beginnen met lanthaan en actinium en eindigen met lutetium en lawrencium, wat resulteert in twee rijen van 15 elementen. Deze variant benadrukt gelijkaardigheden in de chemie van de 15 lanthanides (La–Lu), met het nadeel van dubbelzinnigheid over welke twee elementen de twee groep 3 posities onder scandium en yttrium innemen, en kennelijk een f-blok van 15 kolommen (er kunnen maar 14 elementen in een rij van het f-blok zijn).[n 11]
De drie varianten komen uit historische moeilijkheden van het plaatsen van de lanthanides in het periodiek systeem, en argumenten over waar de f-blok elementen beginnen en eindigen.[88] Sommigen beweren dat zulke argumenten bewijzen dat "het een fout is het [periodiek] systeem in scherp begrensde blokken op te delen."[89] Sommige versies van de type III tabel zijn ook bekritiseerd voor het impliceren dat alle 15 lanthanides één plaats bezetten onder yttrium,[n 12] wat tegen het basisprincipe van één plaats, één element gaat.[90][n 13] De controverse over welke elementen de groep 3 posities onder scandium en yttrium innemen wordt verder besproken in Open vragen en controverses.
De type II tabel, als veelgebruikte variant, wordt getoond in het overzicht van deze pagina. Vergeleken met de Type I variant "zijn er minder klaarblijkelijke uitzonderingen op de gewone opvulling van de 4f orbitalen onder de opvolgende leden van de reeks.[91][n 14] Anders dan bij variant III, is er geen dubbelzinnigheid in de compositie van groep 3.
Andere indelingen

In de 100 jaar sinds Mendelejev zijn systeem eerst publiceerde in 1869 zijn er een geschatte 700 versies van het periodiek systeem gepubliceerd.[92] Naast de vele rechthoekige variaties, zijn er ook andere formaten voor het periodiek systeem ontwikkelt, bijvoorbeeld[n 15] een cirkel, kubus, cilinder, gebouw, spiraal, lemniscaat,[93] octagonaal prisma, piramide, bol en driehoek. Zulke alternatieven worden vaak ontworpen om de chemische of fysische eigenschappen te benadrukken die niet even klaarblijkelijk zijn als in traditionele periodieke systemen.[92]
Het modern periodiek systeem word soms uitgebreid tot het lange, of 32-kolom formaat, door de f-blok elementen in hun natuurlijke positie te plaatsen tussen de s- en d-blokken. In tegenstelling tot de 18-kolom versie zorgt deze indeling voor "geen verstoringen in de reeks stijgende atoomnummers."[94] De relatie tussen het f-blok en de andere blokken van het periodiek systeem worden zo ook makkelijker te zien.[95] Jensen beveelt een tabelvorm aan met 32 kolommen, omdat de lanthanides en actinides anders voor studenten als onbelangrijk worden gezien, die kunnen genegeerd worden.[96] Ondanks deze voordelen van het 32-kolom formaat, wordt het meestal ontweken in boeken, omdat het veel te groot is voor een boekformaat.[97]

Een populaire[98] alternatieve structuur is dat van Theodor Benfey (1960). De elementen worden gerangschikt in een doorlopende spiraal, met waterstof in het centrum en de overgangsmetalen, lanthanides en actinides in schiereilanden.[99]
De meeste periodieke systemen zijn 2-dimensionaal;[3] maar 3-dimensionale systemen bestonden al sinds 1862 (wat het periodiek systeem van Mendelejev uit 1869 voorafgaat). Recentere voorbeelden zijn Courtines' Periodieke Classificatie (1925)[100] Wringley's Lamina Systeem (1949),[101] Giguère's Periodieke Helix (1965)[102] en Dufour's Periodieke Boom (1996).[103] Om nog verder te gaan, Stowe's Fysicus Periodieke Tabel (1989)[104] wordt beschreven als 4-dimensionaal (drie ruimtelijke dimensies en één kleurdimensie).[105]
De verschillende vormen van het periodiek systeem kan beschreven worden als "liegen" op een chemisch-fysiek continuüm.[106] Richting het chemische uiteinde kan men bijvoorbeeld Rayner-Canham's "onhandelbare"[107] Inorganische Chemicus' Periodiek Systeem (2002),[108] wat trends en patronen, en ongewone chemische relaties en eigenschappen benadrukt. Aan het fysische uiteinde van het continuüm ligt Janet's Linkse-Stap Periodiek Systeem (1928). Het heeft een structuur met een dichtere band met de volgorde van het vullen van de elektronenschillen, en dus ook met kwantummechanica.[109] Ergens in het midden van het continuüm ligt de alomtegenwoordige standaardvorm van het periodiek systeem. Het wordt beschouwd als beter in het vertonen van empirische trends in een fysische staat, elektrische en thermische conductiviteit, en oxidatiegetallen, en andere eigenschappen die makkelijk kunnen afgeleid worden uit traditionele technieken uit het chemisch laboratorium.[110]
| Janet linkse-stap periodiek systeem | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | 113 | Fl | 115 | Lv | 117 | 118 | 119 | 120 |
| f-blok | d-blok | p-blok | s-blok | |||||||||||||||||||||||||||||
| Dit periodiek systeem is congruenter met deze volgorde waarin elektronenschillen gevuld zijn, zoals getoond in de bijhorende reeks aan de linkse zijde (lees van boven naar beneden, links naar rechts). | ||||||||||||||||||||||||||||||||
Open vragen en controverses
Elementen met onbekende chemische eigenschappen
Hoewel alle elementen tot ununoctium ontdekt zijn, van alle elementen boven Hassium (element 108) hebben enkel copernicium (element 112) en flerovium (element 114) bekende chemische eigenschappen. De andere elementen kunnen zich mogelijk anders gedragen dan wat met extrapolatie voorspelt wordt, vanwege relativistische effecten; bijvoorbeeld, er wordt voorspeld dat flerovium enkele edelgas-achtige eigenschappen vertoont, maar het wordt momenteel in de koolstofgroep geplaatst.[111] Recentere experimenten tonen echter aan dat flerovium zich chemisch als lood gedraagt, zoals verwacht van zijn plaats in het periodiek systeem.[112]
Verdere uitbreidingen van het periodiek systeem
Het is onduidelijk of nieuwe elementen het patroon van het huidige periodiek systeem zullen blijven volgen in periode 8, of verdere aanpassing nodig zal zijn. Seaborg verwachtte dat periode 8 de rest van het systeem precies zou volgen, zodat er een nieuw s-blok zou komen voor elementen 119 en 120, en een g-blok voor de volgende 18 elementen, en 30 extra nieuwe elementen voor de f-, d- en p-blokken.[113] Recenter hebben fysici zoals Pekka Pyykkö getheoretiseerd dat deze extra elementen de Madelung regel, wat voorspelt hoe elektronenschillen worden opgevuld en dus het uitzicht van het periodiek systeem beïnvloedt, niet volgen.[114]
Element met hoogst mogelijk atoomnummer
Het aantal mogelijke elementen is niet gekend. Een zeer vroege suggestie van Elliot Adams in 1911, gebaseerd op rangschikking van elementen in elke periode, was dat elementen met een atoomgewicht groter dan 256± (wat tussen elementen 99 en 100 zou liggen in het moderne systeem) niet bestonden.[115] Een hogere, recentere schatting zegt dat het periodiek systeem binnenkort zal eindigen na het stabiliteitseiland,[116] wat verwacht wordt rond element 126, omdat de uitbreiding van de periodieke en nuclide systemen beperkt wordt door de driplijnen van protonen en neutronen.[117] Andere voorspellingen van het einde van het periodiek systeem zijn element 128 door John Emsley,[3] element 137 door Richard Feynman,[118] en element 155 door Albert Khazan.[3][n 16]
Atoommodel van Bohr
Het atoommodel van Bohr vertoont moeilijkheden voor atoomnummers groter dan 137, omdat zulke atomen 1s elektronen zouden hebben met een grotere snelheid dan licht.[119] Het onrelativistische Bohr model is dus niet precies wanner het toegepast word op zulke elementen.
Relativistische Dirac vergelijking
De relativistische Dirac vergelijking vertoont moeilijkheden voor atomen met meer dan 137 protonen. Voor zulke elementen is de golffunctie van het Dirac grondniveau ritmisch in plaats van gebonden, en zijn er geen gaten tussen de positieve en negatieve energiespectra, zoals bij de Klein paradox.[120] Preciezere berekeningen die rekening houden met de eindige grootte van de kern tonen aan dat de bindingsenergie eerst de limiet voor elementen overstijgt bij meer dan 173 protonen. Voor zwaardere elementen, als de binnenste orbitaal niet gevuld is, zal het elektrisch veld van de kern een elektron uit de vacuüm trekken, wat resulteert in het spontaan uitstoten van een positron;[121] maar dit gebeurt niet als de binnenste orbitaal gevuld word, dus is element 173 niet noodzakelijk het einde van het periodiek systeem.[122]
Plaatsen van waterstof en helium
Volgens normale elektronenconfiguratie staan waterstof en helium in groepen 1 en 2, boven lithium en beryllium.[24] Maar zulke plaatsing wordt zelden gebruikt buiten de context van elektronenconfiguratie: toen de edelgassen eerst ontdekt werden rond 1900, werden ze "groep 0" genoemd, omdat er toen nog geen chemische reactiviteit bekend was in die elementen, en helium werd bovenaan deze groep geplaatst, omdat het ook chemisch inert was. Toen de groep van formeel nummer veranderde, bleven veel auteurs toch helium boven neon plaatsen, in groep 18; deze notatie wordt ook gebruikt in de moderne IUPAC tabel.[123]
De chemische eigenschappen van waterstof zijn niet gelijkaardig aan die van de alkalimetalen in groep 1, dus wordt waterstof soms ergens andere geplaatst: het populairste alternatief is groep 17; onder andere vanwege de strikt univalente, grotendeels niet-metallische chemie van waterstof, vergelijkbaar met dat van fluor (wat normaal gezien bovenaan groep 17 staat). Soms wordt waterstof in twee groepen tegelijkertijd geplaatst, om te duiden op de eigenschappen die waterstof deelt met zowel de alkalimetalen en de halogenen.[124] Een ander voorstel is boven koolstof in groep 14, omdat het zo past in de trends van stijgend ionisatiepotentiaal en elektronenaffiniteit.[125] Waterstof word ook soms apart van de rest van het periodiek systeem geplaatst, omdat de algemene eigenschappen van waterstof niet perfect passen in enige groep: in tegenstelling tot waterstof tonen de andere groep 1 elementen metallisch gedrag; de groep 17 elementen vormen in het algemeen zouten; de andere groepen tonen wat multivalente chemie. Het andere periode 1 element, helium, word soms ook apart getoond.[126] Helium heeft enkel twee valentie-elektronen, terwijl de rest van de edelgassen er acht hebben (hoewel de buitengewone inertie van helium vergelijkbaar is met dat neon en argon[127]).
Groepen van de overgangsmetalen
De IUPAC definitie van een overgangsmetaal als een element wiens atoom een incomplete d-subschil heeft, of waaruit kationen met een incomplete d-subschil kunnen voortkomen.[128] Met deze definitie zijn alle elementen in groepen 3-11 overgangsmetalen. Dit betekent dat, volgens de IUPAC, groep 12 geen overgangsmetalen bevat, waaronder zink, cadmium en kwik.
Sommige chemici zien de d-blok elementen en overgangsmetalen als één en dezelfde, en zien groep 12 dus wel als deel van de overgangsmetalen. In dit geval worden de elementen van groep 12 beschouwd als speciale gevallen, waar de d-elektronen normaal geen deel uitmaken van chemische bindingen. De recente ontdekking dat kwik zijn d-elektronen kan binden tot kwik(IV) fluoride heeft sommigen overtuigt dat kwik als overgangsmetaal beschouwd kan worden.[129] Anderen, waaronder Jensen,[130] beredeneren dat de formatie van een binding als kwikfluoride enkel kan ontstaan onder zeer abnormale condities. Hierdoor kan kwik niet als overgangsmetaal beschouwd worden met een redelijke interpretatie van de definitie.[130]
Nog andere chemici vinden dat groep 3 niet tot de overgangsmetalen behoord, omdat die elementen geen ionen met een gedeeltelijk gevulde d-schil vormen en dus geen karakteristieke eigenschappen van overgangsmetalen vertonen.[131] In dit geval worden groepen 4-11 als overgangsmetalen beschouwd.
Periodes 6 en 7 in groep 3
Hoewel scandium en yttrium altijd de eerste twee elementen van groep 3 zijn, is er onenigheid over de andere twee plaatsen. Deze zijn oftewel lanthaan en actinium, of lutetium en lawrencium. Fysische en chemische argumenten zijn gegeven voor die laatste,[132][133] maar niet iedereen is overtuigd.[90] De meeste chemici zijn zich niet bewust van deze controverse.[134]
Lanthaan en actinium worden traditioneel als de twee lagere leden van groep 3.[135][136] Men heeft voorgesteld dat deze opmaak opkwam in 1940, toen periodieke systemen gebaseerd op elektronenconfiguratie het concept van de genuanceerde elektron. De configuraties van cesium, barium en lanthaan zijn [Xe]6s1, [Xe]6s2 en [Xe]5d1 6s2. Lanthaan heeft dus een 5d differentiërend elektron, wat het het eerste lid van het d-blok in groep 3 voor periode 6.[137] Een consequente reeks elektronenconfiguraties wordt zo zichtbaar in groep 3: scandium [Ar]3d14s2, yttrium [Kr]4d15s2 en lanthaan [Xe]5d16s2. In periode 6 kreeg ytterbium een elektronenconfiguratie van [Xe]4f135d16s2 en lutetium [Xe]4f145d16s2, wat resulteert in een 4f differentiërend elektron voor lutetium, wat het het laatste lid van periode 6 maakt.[137] Matthias[138] beschrijft de plaatsing van lanthaan onder yttrium als "een fout in het periodiek systeem – helaas bevorderd door Sargent-Welch...en...iedereen kopieerde hen." Lavelle[139] argumenteerde voor het behoud van lanthaan onder yttrium aangezien meerdere bekende handboeken periodieke systemen in deze versie gebruikten.
In andere systemen zijn lutetium en lawrencium de overblijvende groep 3 leden.[140] Vroege technieken voor het scheiden van scandium, yttrium en lutetium waren gebaseerd op het feit dat deze elementen samenhoorden in de zogenaamde "yttrium-groep", terwijl lanthaan en actinium in de "cerium groep" hoorden.[137] Daarom werd niet lanthaan, maar lutetium ondergebracht in groep 3 door sommige chemici in de jaren 1920 en 1930.[n 17] Later spectroscopisch werk vond dat de elektronenconfiguratie van ytterbium eigenlijk [Xe]4f146s2 was. Dit betekent dat ytterbium en lutetium –de configuratie van de tweede is [Xe]4f145d16s2– beide 14 f-elektronen hebben, wat voor een differentiërend d-elektron zorgt, in plaats van een f-elektron voor lutetium, waardoor het een even goede kandidaat is als [Xe]5d16s2 lutetium voor de groep 3 positie onder yttrium.[137] Meerdere fysici in de jaren 1950 en 1960 kozen voor lutetium, door de gelijkaardigheid met de fysische eigenschappen van lanthaan.[137] Deze schikking, waar lanthaan het eerste lid van het f-blok is, wordt tegengewerkt door sommige auteurs omdat lanthaan geen f-elektronen heeft. Op deze zorgen werd geantwoord dat dit niet erg is, gezien andere abnormaliteiten in het systeem – bijvoorbeeld thorium heeft geen f-elektronen, maar is toch deel van het f-blok.[141] Lawrencium, met een elektronenconfiguratie [Rn]5f147s27p1, is ook een abnormaliteit, of die nu in het f-blok of het d-blok, omdat de enige mogelijke p-blok positie al is ingenomen door ununtrium, met een voorspelde elektronenconfiguratie [Rn]5f146d107s27p1.[142]
De 32-kolom versie van het periodiek systeem, waar lanthanides en actinides binnen het systeem worden geplaatst, is een voorgestelde oplossing op dit probleem.[n 18] Oftewel lutetium en lawrencium of lanthaan en actinium kunnen onder scandium en yttrium geplaatst worden. Scerri[90][143] verkeist de eerste optie, omdat de tweede optie het d-blok fragmenteert. Aan de andere kant geeft de tweede optie een betere opmaak voor de chemie van Sc, Y, La en Ac die gelijkaardig zijn aan de aardalkalimetalen van groep 2,[144] en de s-blok metalen in het algemeen,[145][146] maar weinig gelijkenissen met ware overgangsmetalen[147] (hoewel Sc, Y, La en Ac fysisch dichter staan bij overgangsmetalen).[148][n 19]
Optimale vorm
De vele vormen van het periodieke systeem stellen de vraag of er een optimale vorm is van het systeem. Men denkt dat het antwoord afhankelijk is van of de chemische periodiciteit onder de elementen een onderliggende waarheid bevat, als vast deel van het universum, of het een product is subjectieve interpretatie, gebaseerd op de omstandigheden en voornemens van mensen. Een objectieve basis voor chemische periodiciteit zou de vragen over de plaatsing van waterstof en helium en de compositie van groep 3 oplossen. Als zulke onderliggende waarheid bestaat, is het nog niet ontdekt. Ondertussen kunnen de vele periodieke systemen als variaties gezien worden op chemische periodiciteit, die elk andere aspecten, eigenschappen, perspectieven en relaties tussen de elementen benadrukken.[n 20] De alomtegenwoordigheid van het standaard periodiek systeem komt mogelijk doordat deze opmaak een goede balans van de constructie en belang van kenmerken heeft, alsook zijn uitbeelding van de atomische volgorde en periodieke trends.[54][149]
Zie ook
- Scheikundige abundantie
- Lijst van elementen
- Isotopentabel
- Ezelsbruggetjes voor de eerste twintig elementen
- Geschiedenis van het periodiek systeem
Notities
- ↑ De elementen die origineel door synthesis ontdekt werden en later in de natuur zijn technetium (Z=43), promethium (61), astaat (85), neptunium (93), and plutonium (94).
- ↑ Een nulde element (neutronium) (d.i. een stof die compleet uit neutronen bestaat), word in enkele alternatieve voorstellingen opgenomen, zoals in het Chemische sterrenstelsel.
- ↑ Er is een tegenstrijdigheid en enkele onregelmatigheden in deze conventie. Zo wordt helium als deel van het p-blok beschouwt, maar is werkelijk een s-blok element, en de d-schil in the d-blok is werkelijk pas gevuld tegen de tijd dat groep 11 bereikt is, in plaats van groep 12.
- ↑ De edelgassen, astaat, francium, en alle elementen zwaarder dan americium werden weggelaten omdat er geen data voor hen bestaat.
- ↑ Ook al is fluor het meest elektronegatieve elementen in de Pauling schaal, neon is het meest elektronegatieve element in andere schalen, zoals de Allen schaal.
- ↑ Een voorganger van Deming's 18-kolom tabel kan gevonden worden op Adams' 16-kolom Periodieke Tabel in 1911. Adams laat de zeldzame aarden en de 'radioactieve elementen' (i.e. de actinides) uit het hoofdlichaam van zijn tabel en toont hen 'enkel gedekt om ruimte te sparen' (zeldzame aarden tussen Ba en eka-Yt; radioactieve elementen tussen eka-Te and eka-I). Zie: Elliot Q. A. (1911). 'A modification of the periodic table'. Journal of the American Chemical Society. 33(5): 684–688 (687).
- ↑ Een tweede extra lange rij in het periodiek systeem, om bekende en onbekende elementen met een atoomgewicht groter dan dat van bismut (thorium, protactinium and uranium, bijvoorbeeld) in te groeperen, werd al voorgesteld sinds 1892. De meeste onderzoekers vonden echter dat deze elementen gelijkaardig waren aan de derde reeks overgangselementen, hafnium, tantaal and wolfraam. Het bestaan van een tweede interne overgangsreeks, in de vorm van de actinides, werd niet geaccepteerd tot gelijkheden met de elektronenstructuren van de lanthanides bevestigd werden. Zie: van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 315–316, ISBN 0-444-40776-6.
- ↑ Clark en White bundelden hun algemene chemische tekstbundels om trends in dekblad periodieke systemen van 1948 tot 2008. Uit 35 teksten vonden ze 11 type I; negen type II; en negen type III. Over de laatste 20 jaar van hun metingen lag het aantal op negen type I; negen type II and twee type III. Zie: Clark R. W. & White G. D. (2008). 'The flyleaf periodic table'. Journal of Chemical Education. 85(4): 497.
- ↑ Voor voorbeelden van de type I tabel, zie Atkins et al. (2006). Shriver & Atkins Inorganic Chemistry (4th ed.). Oxford: Oxford University Press • Myers et al. (2004). Holt Chemistry. Orlando: Holt, Rinehart & Winston • Chang R. (2000). Essential Chemistry (2nd ed.). Boston: McGraw-Hill
- ↑ Voor voorbeelden van de type II tabel zie Rayner-Canham G. & Overton T. (2013). Descriptive Inorganic Chemistry (6th ed.). New York: W. H. Freeman and Company • Brown et al. (2009). Chemistry: The Central Science (11th ed.). Upper Saddle River, New Jersey: Pearson Education • Moore et al. (1978). Chemistry. Tokyo: McGraw-Hill Kogakusha
- ↑ Voor voorbeelden van de type III tabel zie Housecroft C. E. & Sharpe A. G. (2008). Inorganic Chemistry (3rd ed.). Harlow: Pearson Education • Halliday et al. (2005). Fundamentals of Physics (7th ed.). Hoboken, NewJersey: John Wiley & Sons • Nebergall et. al. (1980). General Chemistry (6th ed.). Lexington: D. C. Heath and Company
- ↑

Lange vorm van het periodiek systeem, als resultaat van de toewijzing van de lanthanides en actinides in Groep 3, onder scandium and yttrium. Beschreven door Jensen (zie bijhorende notitie) als "verouderd" en een interpretatie dat een moderne inorganische chemicus niet zou aanbevelen, tenzij "ze alle contact zijn verloren tussen de onderliggende stelling van hun periodiek systeem en de feiten van de chemie."
Jensen schrijft: "De twee plaatsen onder scandium en yttrium…bevatten oftewel de atoomnummers 57–71 en 89–103 of de symbolen La–Lu en Ac–Lr, respectievelijk, en duiden zo aan dat alle 30 van de elementen aan de onderkant toebehoren aan enkel die twee plaatsen. Om zulke tabel uit te breiden tot een 32 kolom tabel zou het nodig zijn om de plaatsen uit te rekken voor scandium and yttrium zodat ze alle 15 kolommen omvatten." - ↑ Habashi probeerde te dit voorkomen objection by placing the 15 lanthanides in a 15-storey high rise tower rising up from the periodic table position below yttrium. See: Habashi F. (2015). 'Een Nieuwe Kijk op het Periodiek Systeem'. European Chemical Bulletin 4(1): 1–7 (see p. 5).
- ↑
Voor Sc-Y-La-Ac en Sc-Y-Lu-Lr periodieke systemen, vergelijken de volgende twee tabellen de geïdealiseerde aantallen van f elektronen voor periode 6 en 7 elementen in het f-blok met hun echte aantallen of f elektronen. Er zijn 20 onregelmatigheden in de eerste tabel vergeleken met 9 in de tweede.
TABEL 1: Sc-Y-La-Ac periodiek systeemPeriode 6 Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Geïdealiseerde f-elektronen 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Echt aantal 1 3 4 5 6 7 7 9 10 11 12 13 14 14 Periode 7 Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Echt aantal 0 2 3 4 6 7 7 9 10 11 12 13 14 14 TABEL 2: Sc-Y-Lu-Lr periodiek systeem f-blok toont elektron configuraties (lichtgrijze tint = overeenstemming met geïdealiseerd aantal f elektronen; donkergrijze tint = onregelmatigheid)
Periode 6 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Geïdealiseerde f-elektronen 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Echt aantal 0 1 3 4 5 6 7 7 9 10 11 12 13 14 Periode 7 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Echt aantal 0 0 2 3 4 6 7 7 9 10 11 12 13 14 Voor geïdealiseerde f-elektron aantallen in Tabel 1 zie: Newell, S. B. (1977). Chemistry: An Introduction. Boston: Little, Brown and Company, p. 196. Voor Tabel 2 zie: Brown et al. (2009). Chemistry: The Central Science (11ed.). Upper Saddle River, New Jersey: Pearson Education, pp. 207, 208–210. In beide gevallen zijn de aantallen consequent met een ideaal grondniveau configuratie voor f-blok elementen van [Edelgas](n–2)f xns2 waar n = het periode nummer en x = een geheel getal van 1 tot 14. Zie: Rouvray D. H. (2015). 'The Surprising Periodic Table: Ten Remarkable Facts'. In B. Hargittai & I. Hargittai (eds). Culture of Chemistry: The Best Articles on the Human Side of 20th-Century Chemistry from the Archives of the Chemical Intelligencer. New York: Springer Science+Business Media, pp. 183–193 (190).
- ↑ Zie The Internet database of periodic tables voor afbeeldingen van dit soort varianten.
- ↑ Karol (2002, p. 63) beweert dat zwaartekrachtseffecten belangrijk zouden worden wanneer atoomnummers astronomisch groot worden, en zo andere fenomenen van super-massieve kern onstabiliteit overstijgen, en dat neutronensterren (met atoomnummers tot 1021) kunnen gezien worden als voorstellingen van de zwaarste bekende elementen in het universum. See: Karol P. J. (2002). "The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond". Journal of Chemical Education 79 (1): 60–63.
- ↑ Het fenomeen van verschillende groepen werd veroorzaakt door stijgende basiciteit met stijgende straal, en is geen fundamentele reden om dat Lu, en niet La, onder Y te plaatsen. Dus, onder de Groep 2 aardalkalimetalen, behoort Mg (minder basisch) in de "oplosbare groep" en Ca, Sr en Ba (meer basisch) komen voor in de "ammoniumcarbonaat groep". Toch worden Mg, Ca, Sr en Ba routinematig in Groep 2 van het periodiek systeem geplaatst. See: Moeller et al. (1989). Chemistry with Inorganic Qualitative Analysis (3rd ed.). SanDiego: Harcourt Brace Jovanovich, pp. 955–956, 958.
- ↑ Clark vindt dat, "de pedagogische discussie over enige ongefragmenteerde lang-formaat systeem [32-kolom] zal duidelijker gezien worden als een zoektocht naar symmetrie en orde in de natuur dan de verkorte [18-kolom] versies." See: Clark R. W. (2008). "Author of 'The Flyleaf Periodic Table' Responds" Journal of Chemical Education 85 (11): 1493.
- ↑ Mazurs, in zijn survey van 100 jaar periodieke systemen, waaronder 46 vormen met La onder Y, en 43 met Lu onder Y. Zie: Mazurs, E. G. (1974). Graphic Representations of the Periodic System during One Hundred Years. 2nd ed. Alabama: University of Alabama Press.
- ↑ Scerri, een van de voornaamste autoriteiten van de geschiedenis van het periodiek systeem (Sella 2013), prefereerde het concept van een optimale vorm van het periodiek systeem maar is recent veranderd van positie en steunt nu de een aantal verschillende periodieke systemen. Zie: Sella A. (2013). 'An elementary history lesson'. New Scientist. 2929, 13 August: 51, accessed 4 September 2013; and Scerri, E. (2013). 'Is there an optimal periodic table and other bigger questions in the philosophy of science'. 9 August, accessed 4 September 2013.
Appendix
|
Bibliografie
- Ball, P. (2002). The Ingredients: A Guided Tour of the Elements. Oxford University Press, Oxford. ISBN 0-19-284100-9.
- Chang, R. (2002). Chemistry, 7th. McGraw-Hill Higher Education, New York. ISBN 978-0-19-284100-1.
- Gray, T. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal Publishers, New York. ISBN 978-1-57912-814-2.
- Greenwood, N. N., Earnshaw, A. (1984). Chemistry of the Elements. Pergamon Press, Oxford. ISBN 0-08-022057-6.
- Huheey, J. E., Keiter, EA, Keiter, RL. Principles of structure and reactivity, 4th. Harper Collins College Publishers, New York. ISBN 0-06-042995-X.
- Moore, J. (2003). Chemistry For Dummies. Wiley Publications, New York, p. 111. ISBN 978-0-7645-5430-8.
- Scerri, E. (2007). The periodic table: Its story and its significance. Oxford University Press, Oxford. ISBN 0-19-530573-6.
- Scerri, E. (2011). The periodic table: A very short introduction. Oxford University Press, Oxford. ISBN 978-0-19-958249-5.
- Venable, F. P. (1896). The Development of the Periodic Law. Chemical Publishing Company, Easton, Pennsylvania.
Externe links
- Overzichtelijk Periodiek Systeem der Elementen
- Periodic Table of Videos - een video over elk element
- M. Dayah, Dynamic Periodic Table. Geraadpleegd op 14 mei 2012.
- Brady Haran, The Periodic Table of Videos. University of Nottingham. Geraadpleegd op 14 mei 2012.
- Mark Winter, WebElements: the periodic table on the web. University of Sheffield. Geraadpleegd op 14 mei 2012.
- Mark R. Leach, The INTERNET Database of Periodic Tables. Geraadpleegd op 14 mei 2012.

