Vitamine B12
| Vitamine B12 | ||||
|---|---|---|---|---|
| Chemische structuur | ||||
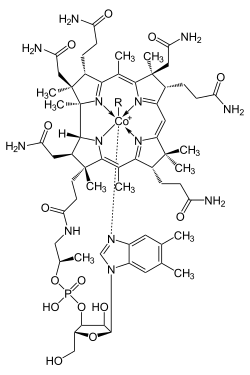
| ||||
▵ Algemene structuurformule van vitamine B12
| ||||
| Farmaceutische gegevens | ||||
| Beschikbaarheid (F) | Snelle opname in het laatste deel van het ileum | |||
| Metabolisatie | Hepatisch | |||
| Halveringstijd (t1/2) | ca. 6 dagen | |||
| Uitscheiding | Renaal | |||
| Databanken | ||||
| CAS-nummer | 68-19-9 | |||
| ATC-code | B03BA01 | |||
| PubChem | 5311498 | |||
| MeSH | D014805 | |||
| Chemische gegevens | ||||
| Molecuulformule | C63H88N14O14PCo | |||
| Molmassa | 1355,365 g/mol | |||
| Smeltpunt | (ontleedt) > 392°C | |||
| Oplosbaarheid | (water) 12 g/L | |||
| Aggregatietoestand | Kristallijne vaste stof | |||
| ||||
Vitamine B12, ook wel cobalamine, is een groep van wateroplosbare vitaminen die een belangrijke rol speelt bij de stofwisseling. Vitamine B12 is een cofactor, een organische verbinding die nodig is bij enzymatische reacties, en speelt als zodanig een rol in DNA-synthese en metabolisatie van vetzuren en aminozuren. Voor de mens is vitamine B12 met name belangrijk voor de normale werking van het zenuwstelsel via zijn rol bij de aanmaak van myeline, en voor de ontwikkeling van rode bloedcellen in het beenmerg.
Vitamine B12 heeft een complexe moleculaire structuur. Er bestaan vier bijna identieke vormen (vitameren) van deze vitamine: cyanocobalamine, hydroxocobalamine, adenosylcobalamine en methylcobalamine.[a]
Mensen, dieren, planten en schimmels kunnen zelf geen cobalamines maken en zijn daarom aangewezen op bacteriën die daar wel toe in staat zijn. Bepaalde diersoorten komen aan hun vitamine B12 door micro-organismen in het maagdarmkanaal die cobalamine aanmaken. Bij de mens zitten die cobalamineproducerende bacteriën te laag in de darm, op een plek waar de vitamine B12 niet opgenomen kan worden. Andere diersoorten zoals konijnen en varkens hebben dit probleem ook, maar voorkomen een B12-tekort door coprofagie (eigen uitwerpselen opeten) zodat de geproduceerde cobalamines alsnog geïncorporeerd worden.
Alle vormen van cobalamine bevatten het biochemisch zeldzame element kobalt. Herkauwers zoals koeien en schapen hebben een spijsverteringsstelsel dat, door bacteriën en gisten in het darmstelsel, kobalt kan omzetten in opneembare cobalamines. Om de activiteit van de micro-organismen op peil te houden is het voor deze dieren dus belangrijk om voldoende kobalt binnen te krijgen. In de veeteelt gebeurt dit via de voeding (voormengsels voor dierenvoer) of via een injectie. Koeien die vooral maïs te eten krijgen, hebben nood aan krachtvoer met kobaltsupplementen. Schapen krijgen drinkwater met toegevoegd kobaltsulfiet om te voorkomen dat een vitamine B12-tekort wordt ontwikkeld.[b]
In ontwikkelde landen krijgen de meeste mensen voldoende vitamine B12 binnen via dierlijke levensmiddelen, zoals vlees, vis, melkproducten en eieren. Ook in plantaardige producten kan vitamine B12 voorkomen, bijvoorbeeld in gedroogd zeewier.[1] Voor veganisten en strenge vegetariërs luidt het advies om voedingssupplementen te slikken en/of voedingsmiddelen te gebruiken die met vitamine B12 zijn verrijkt.
Een tekort aan vitamine B12 kan naast een onvoldoende inname het gevolg zijn van een verminderde absorptie (door verlies van de zogenaamde intrinsieke factor) of een verminderde productie van maagzuur (achloorhydrie). Ernstig B12-tekort kan leiden tot zenuwschade en bepaalde vormen van bloedarmoede, zoals pernicieuze anemie. Het verloop van deze ziekten en de gevoeligheid voor deficiëntie wordt mogelijk beïnvloed door de niveaus van foliumzuur in het lichaam.[2]
Biochemie[bewerken | brontekst bewerken]
Algemene structuur[bewerken | brontekst bewerken]
Vitamine B12 heeft van alle vitamines de meest ingewikkelde moleculaire architectuur. Alle vormen (vitameren) van vitamine B12 zijn macrocyclische organometaalverbindingen met een positief geladen kobalt-ion. Aan dit ion is een zijketen verbonden – voor ieder vitameer is dit een unieke groep – die essentieel is voor de functie van de vitamine. De structuur van vitamine B12 is gebaseerd op twee karakteristieke componenten:
- een corrinering, die vergelijkbaar is met de ring in heem, chlorofyl en cytochroom. Het centrale metaalion hierin is kobalt. Het kobalt is zeer sterk gebonden aan de corrinering en kan eigenlijk alleen maar door vernietiging van de ringstructuur daaruit losgemaakt worden.
- een ribonucleotide (5,6-dimethylbenzimidazol). Vaak staat deze onderaan in een structuurformule weergegeven.
Vitameren[bewerken | brontekst bewerken]

Vier van de zes coördinatieposities van het centrale kobaltatoom worden bezet door de corrinering en een vijfde door de ribonucleotide. De laatste van de 6 coördinatieposities is veel minder sterk aan het kobalt gebonden (met een R van restgroep aangegeven) en door daar verschillende liganden te binden kunnen verschillende vormen van vitamine B12 ontstaan.
- een cyanide. Deze vorm van vitamine B12 wordt cyanocobalamine genoemd. Cyanocobalamine komt normaal gesproken niet in de natuur voor, maar wordt gebruikt in vele farmaceutische producten en in voedingssupplementen vanwege de stabiliteit en de lage kosten. In het lichaam kan het worden omgezet in de metabolisch actieve vormen van vitamine B12: methylcobalamine en adenosylcobalamine, waarbij cyanide vrijkomt (zij het in minieme hoeveelheden).
- een hydroxylgroep: Deze vorm heet hydroxocobalamine. Het wordt vaak gebruikt voor intramusculaire injecties.
- een methylgroep: Deze vorm wordt methylcobalamine genoemd. Het is de enzymatisch actieve vorm die in het lichaam voorkomt, preciezer gezegd in het cytosol van lichaamscellen.
- een desoxyadenosinegroep: deze vorm staat bekend als adenosylcobalamine. Eveneens een enzymatisch actieve vorm die voornamelijk in de mitochondriën werkzaam is.
De covalente C-Co-verbinding in bijvoorbeeld methylcobalamine is een van de eerste voorbeelden van koolstof-metaalverbindingen die ontdekt zijn in de natuur. Alle vier de verbindingen tussen kobalt en de (stikstofgroepen van de) corrinemoleculen moeten gemaakt worden door bacteriën. Als deze verbindingen zijn gelegd, heeft het lichaam slechts een bescheiden capaciteit om vitamine B12 in een van de andere vormen van B12 om te zetten.
Fysiologie[bewerken | brontekst bewerken]
Absorptie en transport[bewerken | brontekst bewerken]
Zoogdieren hebben een complexe manier ontwikkeld voor de absorptie, het transport en de cellulaire opname van vitamine B12. Drie bindingseiwitten spelen hierin een centrale rol: haptocorrine, intrinsieke factor en transcobalamine.
Cobalamine wordt in de maag vrijgemaakt van de omhullende eiwitten uit het voedsel door de werking van maagzuur en verteringsenzymen. Vervolgens vormt het vrije cobalamine een complex met haptocorrine, een eiwit geproduceerd door de speekselklieren, en wordt het naar de twaalfvingerige darm (duodenum) vervoerd.[3] Aldaar verbreken protease-enzymen uit de alvleesklier de verbinding met het haptocorrine, waarna cobalamine met intrinsieke factor bindt. Dit is een glycoproteïne gemaakt in de pariëtale cellen in de maagwand. Het complex wordt vervolgens opgenomen in het laatste stuk van de dunne darm (distale ileum) door specifieke receptoren. Bij dit proces is calcium nodig.
In de enterocyten wordt intrinsieke factor afgebroken en het vrije cobalamine bindt daar aan transcobalamine. Dit transcobalamine-cobalamine-complex wordt vervolgens in het plasma uitgescheiden.[3]
Plasmavitamine B12 is gebonden aan twee eiwitten:
- Haptocorrine: Het grootste deel (circa 80%) is in het bloed gebonden aan haptocorrine. Haptocorrine is een vrijwel volledig verzadigd vitamine B12 bindend glycoproteïne, dat het grootste deel (circa 80%) van het plasmavitamine B12 bindt. De binding van vitamine B12 aan haptocorrine leidt niet tot opname in lichaamscellen.
- Transcobalamine: Ongeveer 20% van de vitamine in de bloedcirculatie is gebonden aan transcobalamine, wat het actieve transporteiwit voor vitamine B12 is. Dit eiwit transporteert het vitamine naar alle lichaamscellen. Specifieke membraanreceptoren op de doelcellen binden het transcobalamine-complex en nemen het via endocytose op. Uitsluitend aan transcobalamine gebonden vitamine B12 is beschikbaar voor lichaamscellen. In de lysosomen van de doelcellen wordt dit complex afgebroken, waarna vrij cobalamine wordt uitgescheiden en omgezet in de twee actieve vormen: methylcobalamine in het cytosol en adenosylcobalamine in de mitochondria.[3]
Cobalamine is zeer sterk gebonden aan elk van de twee transporteiwitten. De dissociatieconstante Kd is voor deze de eiwit-cobalaminecomplexen erg klein: 10−15 M. Om deze reden moet telkens bij het vrijkomen van cobalamine, het transporteiwit worden afgebroken.
Absorptieniveaus[bewerken | brontekst bewerken]
De hoeveelheid vitamine B12 die geabsorbeerd wordt neemt toe met de hoeveelheid die ingenomen wordt, maar het percentage neemt af met toenemende doses. Van een voedingssupplement met 1 microgram vitamine B12 wordt 50% opgenomen, van een dosering van 5 microgram wordt 20% opgenomen en slechts 5% van een dosering van 25 microgram. Er lijkt dus verzadiging op te treden van het (actieve) transportmechanisme, maar binnen 4 tot 6 uur is de absorptiecapaciteit weer op het uitgangsniveau teruggekeerd, waardoor een nieuwe dosering weer efficiënt kan worden opgenomen. Circa een procent van een ingenomen hoge dosering (1000 microgram) die in sommige voedingssupplementen aanwezig is, kan passief worden opgenomen, zelfs zonder intrinsieke factor of receptoren in de darm. Vitamine B12 uit voedingssupplementen is ook beter biologisch beschikbaar omdat het niet van voedingseiwit hoeft te worden losgemaakt.
De schillingtest was de klassieke procedure voor het bepalen van de absorptie van vitamine B12, maar wordt nu zelden meer gebruikt. Er is geen echte vervanger, daarom zijn er een aantal individuele bepalingen nodig voor het bepalen van de oorzaak van een vitamine B12-deficiëntie. Testen om atrofische gastritis te bepalen, een veelvoorkomende oorzaak van vitamine B12-malabsorptie, zijn bijvoorbeeld gastroscopie of het bepalen van de serumwaarden van gastrine en pepsinogeen.
Uitscheiding[bewerken | brontekst bewerken]
Vitamine B12 wordt uitgescheiden in gal en vervolgens opnieuw geabsorbeerd via de enterohepatische cyclus door specifieke receptoren in het ileum. Om deze reden ontwikkelen mensen die geen of onvoldoende intrinsieke factor aanmaken sneller dan normaal een vitamine B12-deficiëntie. De vitamine B12 die wordt uitgescheiden via de ontlasting bestaat uit niet-geabsorbeerde vitamine B12 uit de galvloeistof, uit darmcellen en uit vitamine B12 die door darmbacteriën is geproduceerd.
Functies[bewerken | brontekst bewerken]
Vitamine B12 fungeert als cofactor van verschillende enzymen en voert zo zijn biologische rol uit:
- Methylcobalamine is cofactor in het enzym methioninesynthase. Dit enzym draagt de methylgroep van foliumzuur (5-methyltetrahydrofolaat) over op homocysteïne waardoor methionine wordt gemaakt, een aminozuur dat essentieel is voor de DNA-synthese. Een tekort aan vitamine B12 belemmert sneldelende cellen in hun aanmaak van DNA. Het duidelijkst is dit bij de ontwikkeling van rode bloedcellen, maar ook de epitheelcellen van de darmen, de vagina en tong kunnen minder goed worden aangemaakt.
- Een andere functie van cobalamine is het stimuleren van de vorming van myeline. Dit eiwit omhult de zenuwuitlopers, waardoor de impulsgeleiding van de zenuw wordt versneld.
- Methylcobalamine fungeert daarnaast ook als cofactor in het enzym L-methyl-malonyl-CoA-mutase, een enzym uit de enzymgroep van de isomerasen. Een tekort aan cobalamine leidt tot een defect in de reactie die door deze mutase wordt gekatalyseerd. Daardoor hoopt L-methyl-malonyl-CoA zich op in de cellen. De ophoping van deze stof wordt verantwoordelijk geacht voor neurologische defecten.
- Methylcorrinoïdes, waaronder methylcobalamine, zijn cofactoren van enzymen die de kooldioxidebinding katalyseren in anaerobe, acetaatvormende bacteriën en in methaanvormende archaea.
- Cobalamines zijn cofactoren van enzymen in anaerobe sulfaatreducerende bacteriën, die gechloreerde alifatische en aromatische koolwaterstoffen omzetten.
Voorkomen[bewerken | brontekst bewerken]
Vitamine B12 wordt uitsluitend geproduceerd door bepaalde bacteriën en archaea.[4][5] Vitamine B12-behoeftige organismen kunnen aan hun behoefte komen door met deze bacteriën in symbiose te leven, of door zich te voeden met bronnen van vitamine-B12. De meeste herkauwers dragen vitamine B12-producerende bacteriën bij zich en absorberen vervolgens hun productie. Ook in de menselijke darm komen bacteriën voor die B12 produceren. Deze bacteriën bevinden zich echter in een deel van de darmen waar de vitamine B12 niet meer kan worden opgenomen. Daarom zijn mensen afhankelijk van een externe bron van B12. Andere bronnen van B12 zijn met name de lever van dieren en uitwerpselen.
Voedselbronnen van vitamine B12[bewerken | brontekst bewerken]
Er zijn nauwelijks natuurlijk voorkomende bioactieve vormen van vitamine B12 uit plantaardige bronnen.
- Rijke bronnen zijn dierlijke voedingsmiddelen zoals melk, melkproducten, vlees en vleeswaren en eieren. De vitamine B12 in schapenvlees, kippenvlees en vis wordt even goed opgenomen als kristallijne vitamine B12 als supplement.[6] De vitamine B12 in eieren wordt echter slecht opgenomen vanwege de aanwezigheid van vitamine B12-bindende eiwitten in eiwit en eierdooier.[6] Toen er nog geen B12-supplementen bestonden werd lever of leverextract gebruikt bij mensen met een B12-tekort.
- Meer dan de helft van de algen en wieren bevat vitamine B12, waarschijnlijk door in symbiose te leven met B12-producerende bacteriën.[7] Een bepaalde soort eetbaar Japans zeewier (nori) bevat zelfs evenveel vitamine B12 als lever[7] en heeft voorkomen dat vitamine B12-deficiëntie optrad bij veganisten.[8]
- Sommige plantaardige voedingsmiddelen bevatten toegevoegde vitamine B12, zoals Marmite en diverse producten voor vegetariërs en veganisten. In de Verenigde Staten zijn ontbijtgranen waaraan B-vitaminen zijn toegevoegd een belangrijke bron van vitamine B12.[8]
- In sommige voedingsmiddelen die besmet zijn met of gefermenteerd zijn door bacteriën, bijvoorbeeld groene thee, tempé en Thaise vissaus, is vitamine B12 gevonden,[8] hoewel die een lage affiniteit heeft met intrinsieke factor, waardoor hij slecht geabsorbeerd wordt.
- Soms wordt beweerd dat gist of gistextracten B12 bevatten maar dat is niet het geval.[9] Veel B12-pillen zijn gemaakt van gist waarin kunstmatig B12 is toegevoegd. Pure gist bevat van nature echter geen B12.
De biologische beschikbaarheid van vitamine B12 bij de mens hangt af van het gastrointestinale absorptievermogen van een individu. Zoals eerder uiteengezet, is de vitamine B12-absorptie complex en verandert in negatieve zin met stijgende leeftijd. Meestal wordt ervan uitgegaan dat 1,5 tot 2,0 microgram synthetische vitamine B12 de cobalamine-receptoren in het ileum verzadigt, maar andere studies hebben een hogere absorptiegraad gevonden.
Deficiëntie[bewerken | brontekst bewerken]
In Nederland heeft ongeveer 5 tot 10 procent van de totale bevolking[10] en ongeveer 25% van de bevolking ouder dan 65 jaar een vitamine B12-tekort.[11][12] Vroeger werd verondersteld dat vitamine B12-deficiëntie iets was dat vele jaren nodig had om zich te ontwikkelen en alleen tot uitdrukking kwam bij veganisten en sommige strikte vegetariërs, of bij mensen met pernicieuze anemie. Diverse studies hebben echter aangetoond dat er diverse aandoeningen zijn die samenhangen met subklinische vitamine B12-deficiëntie en die zich veelal ontwikkelen door malabsorptie of inadequate inname. Mensen die geen of onvoldoende intrinsieke factor aanmaken, raken relatief snel vitamine B12-deficiënt, aangezien de herabsorptie van B12 via de enterohepatische cyclus bij hen niet of onvoldoende plaatsvindt en er dus relatief veel verliezen optreden. De incidentie van subklinische vitamine B12-deficiëntie is hoog in ontwikkelingslanden, bij ouderen en bij vegetariërs.
Bepaling van de vitamine B12-status[bewerken | brontekst bewerken]
Van oudsher wordt de vitamine B12-status bepaald door de cobalamineconcentraties in serum te bepalen. Daarbij wordt vaak 150 pmol/L als grenswaarde gebruikt. Echter, met name in het begin van de 21e eeuw zijn er twijfels gerezen wanneer de analyse alleen het serum als indicator van de vitamine B12-status gebruikt. Hoewel lage vitamine B12-concentraties in het serum een gevoelige indicator zijn van een vitamine B12-tekort en hoge vitamine B12-concentraties in het serum doorgaans op een adequaat B12-peil wijzen, is de interpretatie van de tussenliggende range van vitamine B12-concentraties onzeker.[13]
De concentraties methylmalonzuur (MMA) en homocysteïne (tHcy) in het serum zijn eveneens belangrijke indicatoren van de vitamine B12-status. Meting van deze indicatoren kan het bestaan van een subklinische vitamine B12-deficiëntie aan het licht brengen, waarvan de gevolgen nog steeds niet goed zijn opgehelderd. MMA wordt geacht de kenmerkende indicator van cobalamine stofwisseling te zijn en tHcy speelt een rol bij vitamine B12-deficiëntie wanneer deze samengaat met tekorten aan foliumzuur en vitamine B6. Diverse fysiologische of omgevingsomstandigheden kunnen echter de functie van deze stoffen als biomarkers van vitamine B12-deficiëntie verstoren. Plasma tHcy concentraties zijn namelijk eveneens verhoogd bij een verminderde nierfunctie, polymorfismen in methyleentetrahydrofolaat (MTHFR), of het gebruik van bepaalde medicijnen. Plasma MMA concentraties zijn eveneens verhoogd bij nierinsufficiëntie, vaak bij oudere mensen.[13] Als verhoogde methylmalonzuurspiegels nog steeds gepaard gaan met verhoogde malonzuurspiegels, kan dit wijzen op de vaak over het hoofd geziene [14] stofwisselingsziekte gecombineerde malon- en methylmalonacidurie (CMAMMA).[15]
Daarom wordt bij de beoordeling van de vitamine B12-status begonnen met het meten van de serum vitamine B12-concentraties, om deze bij lage waarden aan te vullen met MMA metingen. De drempelwaarde van serum-vitamine B12, waarbij verdere testen moeten plaatsvinden staat ter discussie. Als een ondergrens van 200 ng/L of 147 pmol/L wordt gebruikt, zouden aan veel patiënten met een verhoogd MMA onterecht een adequate vitamine B12-status worden toegekend, maar als hogere waarden (500 ng/L of 370 pmol/L) worden gebruikt, zouden de meeste patiënten follow-up MMA testen moeten ondergaan terwijl hun vitamine B12-status normaal is.[13] Het Nederlands Huisartsen Genootschap spreekt in haar nieuwe standpunt hieromtrent over een grijs gebied tussen 148 en 250 pmol/L, waarin ook een MMA-test geïndiceerd is. Als dan de MMA waarde boven 350 nmol/L uitkomt, kan er sprake zijn van vitamine B12 deficiëntie, maar ook van verminderde nierfunctie.
Studies die het gebruik van holo-TC als een marker van de vitamine B12-status hebben beoordeeld, concluderen dat het ongeveer even specifiek en gevoelig is als het meten van de vitamine B12-concentraties in het serum. Echter, bij gebruik in combinatie met serum vitamine B12 verbetert de voorspellende waarde om de vitamine B12-status te bepalen.
Wanneer de lichaamsvoorraden van vitamine B12 laag zijn, kunnen hoge doseringen foliumzuur (vitamine B11) een tekort aan vitamine B12 maskeren. De DNA-synthese kan doorgaan en megaloblastaire anemie treedt niet op, terwijl de concentraties homocysteïne en methylmalonzuur wel stijgen en neurologische schade veroorzaken. Sommige wetenschappers maken zich daarom zorgen of voedselverrijking met foliumzuur, zoals in de Verenigde Staten plaatsvindt, niet te grote gezondheidsrisico's met zich meebrengt.
Oorzaken van vitamine B12-deficiëntie[bewerken | brontekst bewerken]
- Onvoldoende inname. Een tekort aan vitamine B12 komt vaak voor bij veganisten[16] (en in mindere mate vegetariërs, vooral wanneer zij zuivelproducten mijden). Ook andere bevolkingsgroepen met een lage inname van dierlijk voedsel lopen risico op een tekort. Zwangere vrouwen die op vegetarische of veganistische wijze eten, lopen een hoog risico op een tekort vanwege de toegenomen behoefte. Na het stoppen van vitamine B12-inname kan het nog 3 jaar duren voordat een tekort tot klachten leidt; het lichaam kan dus enkele jaren op een goede B12-voorraad teren.
- Malabsorptie van het vitamine vanuit de voeding wordt het meest gezien in de ouderenzorg:
- bijvoorbeeld wanneer iemand geen of onvoldoende intrinsieke factor (een glycoproteïne) maakt. Dit is bijvoorbeeld het geval na een operatieve verwijdering van een deel van de maag, bij een ontsteking van het maagslijmvlies (gastritis), een aandoening aan de dunne darm of de aanwezigheid van Helicobacter pylori zonder succesvolle eradicatie;
- achloorhydrie - gastritis komt bij ouderen relatief vaak voor en leidt dan tot een vermindering of een compleet verlies van het maagzuur dat nodig is om B12 van het voedingseiwit te splitsen;
- bij gebruik van protonpompremmers (maagzuurremmers);[17][18]
- verminderde opname van vitamine B12 in het ileum kan veroorzaakt worden door competitie voor vitamine B12 bij bacteriële overgroei of een parasitaire infectie; resectie of ziekten van het ileum zoals de ziekte van Crohn of andere inflammatoire darmziekten veroorzaken eveneens malabsorptie van vitamine B12;
- ook kan het voorkomen dat het lichaam antistoffen tegen intrinsieke factor maakt, waardoor de opname in het lichaam wordt geremd;
- pernicieuze anemie is een stofwisselingsziekte waardoor intrinsieke factor niet wordt aangemaakt of werkzaam is, met als gevolg een B12-tekort met een bepaald type bloedarmoede als gevolg. "Pernicieuze anemie" betekent letterlijk: een verderfelijke (ernstige) vorm van bloedarmoede. Deze vorm van bloedarmoede wordt niet altijd ontdekt. Vooral ouderen kunnen last krijgen van een vitamine B12-tekort als hun stofwisseling stoornissen gaat vertonen. Door het gebrek aan vitamine B12 wordt de vorming van rode bloedcellen verstoord, wat uitputting veroorzaakt. Bij bloedarmoede door gebrek aan vitamine B12 of aan foliumzuur zijn de bloedcellen die men nog heeft meestal te groot; bij ijzergebrek juist meestal te klein;
- gebruik van lachgas, een anesthesiegas dat de actieve (gereduceerde) vorm van vitamine B12 omzet in een onwerkzame analoog door een sterk oxiderende werking op kobalt[19] waardoor het enzym methioninesynthase, een sleutelenzym in de methionine- en foliumzuurstofwisseling, evenals methylmalonyl-CoA mutase sterk geremd wordt,[20] waardoor onder andere hyperhomocysteïnemie en de neurologische gevolgen van vitamine B12-deficiëntie op de loer liggen;[20]
- genetische afwijkingen in de absorptie, transport en/of intracellulaire stofwisseling van cobalamines kunnen ook tot vitamine B12-deficiëntie leiden.
Gevolgen van een tekort[bewerken | brontekst bewerken]
De effecten van subklinische vitamine B12-deficiëntie op lange termijn zijn nog onvoldoende in kaart gebracht, maar omvatten waarschijnlijk effecten op de uitkomst van de zwangerschap en op diverse aspecten van het verouderingsproces, waaronder vasculair, cognitief, de botstofwisseling en de gezondheid van het oog.
Een chronisch tekort aan vitamine B12 leidt uiteindelijk tot een vorm van bloedarmoede (macrocytaire anemie) en neurologische gevolgen zoals tintelingen in de vingers (paresthesie), geheugenverlies, coördinatiestoornissen (ataxie) en spierzwakte in de benen. De neurologische gevolgen kunnen optreden voordat er bloedarmoede is, evenals het omgekeerde.
Bij een tekort aan vitamine B12 bestaat de behandeling in Nederland uit geregelde (maandelijkse tot 3-maandelijkse) intramusculaire injecties met ongeveer 1 mg vitamine B12 per keer, na een oplaadfase waarin met een paar injecties per week gedurende enkele weken de voorraad op peil wordt gebracht. Het dagelijks innemen van B12 via een hooggedoseerd voedingssupplement (ten minste 650 microgram per dag)[21] zou even effectief blijken te zijn als injecties bij het normaliseren van de vitamine B12-status en zou kosteneffectiever zijn, hoewel suppletie gedurende een maand te kort blijkt voor een langdurig herstel.[22] Bij hooggedoseerde orale suppletie geschiedt de opname via diffusie en niet via transport van intrinsieke factor (de gebruikelijke manier). Het Nederlands Huisartsen Genootschap adviseert daarom sinds eind 2014 alleen nog B12-injecties bij ernstige gevallen waarbij een snelle normalisering gewenst is. De Vitamin B12-Research Group bestrijdt echter het NHG-standpunt, omdat het op onbetrouwbaar onderzoek zou zijn gebaseerd.
Gevolgen van een overschot[bewerken | brontekst bewerken]
Er zijn beperkt ongewenste effecten bekend bij personen die langdurig hoge doseringen gebruikten. Het lichaam reguleert de opname van vitamine B12 zelf. Een overmaat verlaat het lichaam via de nieren. Na inname van vitamine B12 worden verhoogde waarden van histamine waargenomen. Bij ratten is waargenomen dat na toediening van vitamine B12 de activiteit van het enzym DAO (diamineoxydase) afneemt en verhoogde waarden van histamine worden gemeten. Het enzym DAO voorkomt dat histamine zijn schadelijke werking kan doen. Vitamine B12 in combinatie met foliumzuur geeft een nog sterkere vermindering van activiteit van het enzym DAO. Mensen met een histamine-allergie of -intolerantie kunnen problemen ervaren en dienen dus waakzaam te zijn.[23]
Geschiedenis[bewerken | brontekst bewerken]
Beschrijving van deficiëntie[bewerken | brontekst bewerken]
Het oorspronkelijke onderzoek naar deze vitamine begon in 1824 met een beschrijving van een fatale bloedarmoede, destijds Addisonse anemie of de ziekte van Addison-Biermer genoemd, door Thomas Addison en Michael Anton Biermer (en andere auteurs). Tegenwoordig is deze ziekte bekend als pernicieuze anemie. Hierbij dient te worden opgemerkt dat de anemie géén conditio sine qua non is. Ook zonder anemie kan er sprake zijn van een vitamine B12-tekort.
Lever als middel tegen anemie[bewerken | brontekst bewerken]
In het begin van de jaren twintig van de 20e eeuw ontdekte de Amerikaanse patholoog George Whipple dat honden die aan pernicieuze anemie leden, konden genezen van deze anders dodelijke aandoening door hen rauwe lever te voeren. De zoektocht naar de voor dit effect verantwoordelijke stoffen leidde in 1926 tot de beschrijving van een ook bij mensen werkzame "antipernicieuze factor" door twee Amerikaanse artsen George Minot en William Murphy, die daarvoor in 1934 samen met Whipple de Nobelprijs voor Fysiologie of Geneeskunde ontvingen. William Bosworth Castle ontdekte vervolgens een intrinsieke factor die, indien afwezig, pernicieuze anemie veroorzaakt. Intrinsieke factor bleek nodig voor het faciliteren van de "extrinsieke factor", wat later vitamine B12 bleek te zijn.
Identificatie van vitamine B12[bewerken | brontekst bewerken]
De isolering van de eigenlijke werkzame stof, vitamine B12 (als cyanocobalamine in kristallijne vorm), vond pas in 1948 plaats. Dit gebeurde onafhankelijk van elkaar door twee onderzoeksteams: een team rondom de Amerikaanse biochemicus Karl August Folkers en kort daarna ook een Brits onderzoeksteam rondom de chemicus Ernest Lester Smith. In 1955 kon de Britse kristallograaf Dorothy Crowfoot Hodgkin met hulp van röntgenkristallografie de moleculaire structuur van vitamine B12 ophelderen, waarvoor zij in 1964 de Nobelprijs voor Scheikunde kreeg toegekend.
De synthese van vitamine B12 werd in 1972 bereikt door onderzoekers rondom Albert Eschenmoser en Robert Burns Woodward. Dit was een project waar meer dan 100 wetenschappers gedurende 11 jaar aan meegewerkt hebben. Nog steeds geldt vitamine B12 als een van de grootste ooit in een laboratorium totaalgesynthetiseerde moleculen. In deze periode werd ontdekt dat cyanocobalamine een artefact is, dat door de gebruikte isolatiemethode uit lever was ontstaan. De biologisch actieve vormen van vitamine B12 bleken cobalamine, adenosylcobalamine (preciezer 5’-deoxy-5’-adenosylcobalamine) en methylcobalamine te zijn.
In 2007 hebben onderzoekers van het MIT en van de Harvard Medical School de syntheseroute van vitamine B12 door micro-organismen opgehelderd.[24]
- Nobelprijswinnaars voor ontdekkingen met betrekking tot vitamine B12
-
George Whipple
-
George Minot
-
William P. Murphy
-
Alexander R. Todd
Externe link[bewerken | brontekst bewerken]
NotenBronnen
|




